ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ Ομάδας Προσανατολισμού Θετικών Σπουδών Κεφ1 ΟΞΕΙΔΟΑΝΑΓΩΓΗ
Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιά, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη της φετινής σχολικής χρονιάς
Δήμητρα Σπανού
αφιερώνεται στον Πάνο με την ευχή να βρεί την ζωή του
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2016-2017 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
Κεφάλαιο «ΟΞΕΙΔΟΑΝΑΓΩΓΗ – ΗΛΕΚΤΡΟΛΥΣΗ» Παρ. «Αριθμός οξείδωσης. Οξείδωση – Αναγωγή» Παρ. «Κυριότερα οξειδωτικά –αναγωγικά. Αντιδράσεις οξειδοαναγωγής»
ΕΚΤΟΣ ΑΠΟ: - την υποενότητα «Συμπλήρωση αντιδράσεων οξειδοαναγωγής» με εξαίρεση τη «Μέθοδο μεταβολής του αριθμού οξείδωσης» η οποία είναι εντός ύλης και - την υποενότητα «Παραδείγματα οξειδοαναγωγικών αντιδράσεων» με εξαίρεση τα:
1) Οξείδωση ΝΗ3 από CuO, 4) Οξείδωση CO από KMnO4 παρουσία H2SO4 και 5) Οξείδωση FeCl2 από K2Cr2O7 παρουσία HCl
τα οποία είναι εντός ύλης.
ΜΕΡΟΣ ΠΡΩΤΟ
ΟΞΕΙΔΟΑΝΑΓΩΓΗ - ΗΛΕΚΤΡΟΛΥΣΗ
Την διάθεση των υλικών σωμάτων, να έχουν την μεγαλύτερη δυνατή σταθερότητα και ισορροπία συναντάμε και στον μικρόκοσμο των ατόμων . Τα άτομα στην προσπάθειά τους να βρεθούν στην ευνοικότερη δυνατή κατάσταση, μιμούνται τις ηλεκτρονιακές δομές των ευγενών αερίων (που είναι τα σταθερότερα και αδρανέστερα των στοιχείων). 'Ετσι στην προσπάθεια αυτή, διακινούνται τα εξωτερικά τους ηλεκτρόνια, δανείζουν ή μοιράζονται ή προσφέρουν ορισμένα από αυτά. Αυτό όμως έχει σαν αποτέλεσμα την δημιουργία σωματιδίων ,που δεν είναι απολύτως ουδέτερα, όπως πρέπει να είναι τα άτομα και που γενικά αναπτύσσονται μεταξύ τους ηλεκτρικές και ηλεκτρομαγνητικές δυνάμεις και πεδία.
Ταυτόχρονα όμως, αυτό το ίδιο είναι, η αιτία της δημιουργίας του κόσμου όπως τον γνωρίζουμε και της πληθώρας των ουσιών που κατασκευάζονται. Ο κόσμος συνήθως δεν φτιαγμένος από απλάό χημικά στοιχεία αλλά μια συνεργασία μεταξύ τους που δίνει πιο πολύπλοκες κατασκευές, όπως είναι μόρια τα ιόνται κ.λ.π.
Αυτήν την διακίνηση ηλεκτρονίων από ένα άτομο, χαρακτηρίζεται σαν οξείδωση , εάν έχουμε απομάκρυνση ηλεκτρονίων και μια εμφάνιση ηλεκτροθετικότητας ή αναγωγή εάν έχουμε αύξηση του συνηθισμένου αριθμού ηλεκτρονίων ενός ατόμου ή γενικότερα της ηλεκτραρνητικότητάς του.
Λόγω του ότι η απομάκρυνση ηλεκτρονίων από ένα άτομο είχε σαν αποτέλεσμα τα ηλεκτρόνια αυτά να προσεγγίσουν κάποιο άλλο άτομο, αυτές οι δυο αντιδράσεις (της οξείδωσης και της αναγωγής ) εξετάζονται ταυτόχρονα και επικράτησε ο όρος οξειδοαναγωγή.

Το όνομα οξείδωση, προφανώς επικράτησε, γιατί οι γνωστότερες και στις πιο μελετημένες και φανερές χημικές αντιδράσεις από παλιά, συμμετείχε το δραστικό στοιχείο οξυγόνο, συνήθως το άτομο προσλάμβανε οξυγόνο στις καύσεις και τις οξειδώσεις.
Η περιγραφή των αντιδράσεων αυτών συμπληρώθηκε με την παραδοχή ότι οξείδωση μπορεί να είναι επίσης και η απομάκρυνση υδρογόνου από μια ένωση που συνήθως φέρνει το ίδιο αποτέλασμα.
 Η αναπνοή, η καύση ουσιών, η οξείδωση των μετάλλων, είναι οξειδοαναγωγικές αντιδράσεις που το στοιχείο προσλαμβάνει οξυγόνο,
Η αναπνοή, η καύση ουσιών, η οξείδωση των μετάλλων, είναι οξειδοαναγωγικές αντιδράσεις που το στοιχείο προσλαμβάνει οξυγόνο,
Η διάσπαση της αμμωνίας είναι επίσης αντίδραση οξειδοαναγωγής με την απομάκρυνση των υδρογόνων από το άζωτο

Όμως οξείδωση έχουμε επίσης , όταν ο διχλωριούχος σίδηρος μετατρέπεται σε τριχλωριούχο σίδηρο ή όταν σχηματίζεται χλωριούχο μαγνήσιο από μαγνήσιο και χλώριο
Ετσι για να περιγράψουμε τις οξειδοαναγωγικές αντιδράσεις δεν μας καλύπτει η μεταφορά ατόμων οξυγόνου και υδρογόνου ή και άλλων ατόμων γιατί εδώ πρέπει να φαίνεται καθαρά η μετακίνηση ηλεκτρονίων. Όπου
Οξείδωση είναι η αποβολή ηλεκτρονίων
Αναγωγή είναι η πρόσληψη ηλεκτρονίων
Από εδώ προέκυψε η ανάγκη ενός νέου όρου για την χημεία του αριθμού οξειδώσεως και βάσει αυτού έγινε η μελέτη της οξειδοαναγωγής και των οξειδοαναγωγικών αντιδράσεων.
Ακόμη και οι μοριακοί τύποι συηθίζεται να γράφονται με την μορφή αυτή
Ο αριθμός οξείδωσης μοιάζει αρκετά με έναν παλαιότερο ορισμό του σθένους. Εδώ όμως λαμβάνουμε υπ όψη όχι μόνο τα ηλεκτρόνια που συμμετέχουν σε δεσμούς, αλλά και την φόρτιση που προκύπτει από αυτό.
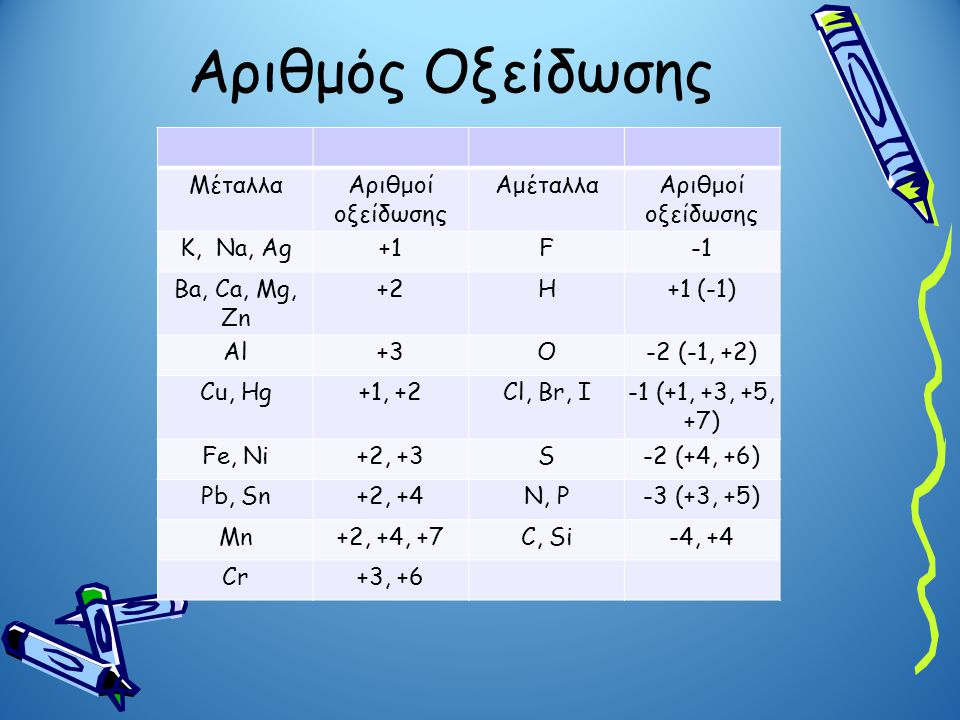
Κανόνες για να υπολογίζεται ο αριθμός οξείδωσης
Υπάρχει όμως εδώ η ανάγκη να διατυπωθούν κανόνες για να υπολογίζεται ο αριθμός οξείδωσης των ατόμων γιατί βάσει αυτού κάνουμε τους υπολογισμούς στην συνεχεια.
Αριθμός οξειδώσεως σε ένα στοιχείο είναι το μηδέν π.χ.. C0 , S0, N02, O02,
Το φθόριο( F) στις ενώσεις του έχει πάντα ΑΟ=-1 π.χ.. F-1H+1
Το οξυγόνο(Ο) στις ενώσεις του έχει συνήθως ΑΟ=-2. π.χ. Η+12Ο-2 Εξαίρεση στα υπεροξείδια που έχει ΑΟ=-1 π.χ. Η+12Ο-1 και στο OF2 που έχει +2
Το υδρογόνο(Η) στις ενώσεις με αμέταλλα του έχει συνήθως ΑΟ=+1. π.χ. Η+12S-2,
ενώ στις ενώσεις με μέταλλα του έχει συνήθως ΑΟ=-1. π.x. Ca+2H-12
Τα μέταλλα στις ενώσεις τους έχουν θετικό αριθμό οξείδωσης Τα αλκάλια έχουν +1, π.χ. οξείδιο του λίθιου Li+12O-2
οι αλκαλικές γαίες έχουν +2 π.χ. οξείδιο του μαγνησίου Mg+2O-2
Τα στοιχεία μετάπτωσης περισσότερους από έναν αριθμούς οξείδωσης. π.χ.
To χρώμιο εμφανίζει πολλούς αριθμούς οξειδώσεως όπως 6, 5, 4, 3, 2, 1, 0, −1, −2 παραδείγματα για τους συνηθισμένους Αο 3 και 6
Το οξείδιο του χρωμίουΙΙΙ (Cr+32Ο-23) και οξείδιο του χρωμίουVΙ(Cr+6Ο-23)
Το Μαγγάνιο, εμφανίζει πολλούς αριθμούς οξειδώσεως όπωςι ΑΟ +2, +3, +4, +6 και +7. Παραδείγματα για Α.Ο 2 και 7
π.χ οξείδιο του ΜαγγανίουΙΙ (Mn+2Ο-2) και οξείδιο του ΜαγγανίουVΙΙ(Mn+72Ο-27)
Ο σίδηρος έχει συνηθισμένους αριθμούς οξείδσης 2 και 3 Παραδείγματα o χλωριούχος δισθενής σίδηρος Fe+2Cl-12 και
o χλωριούχος τρισθενής σίδηρος Fe+3Cl-13
Πως υπολογίζονται οι αριθμοί οξείδωσης ενός ατόμου ανάλογα με το είδος του δεσμού του σε χημική ένωση
Αριθμός οξειδώσεως σε ομοιοπολικές ενώσεις μπορεί να είναι
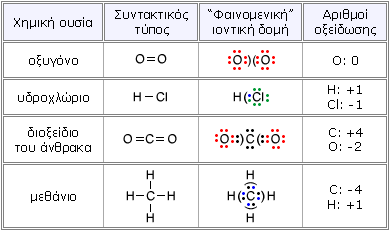
α. Ομοιοπολικός μη πολικός δεσμός
Εάν τα άτομα του ομοιοπολικού δεσμού είναι τα ίδια και το κοινό ζεύγος των ηλεκτρονίων έλκεται εξ ίσου και από τα δυο όμοια άτομα είναι το μηδέν
β. Ομοιοπολικός πολικός δεσμός
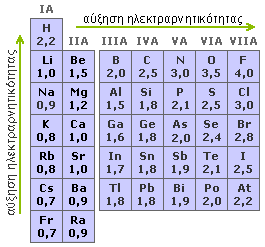
Εδώ ο αριθμός οξείδωσης είναι τα επιλπέον ηλεκτρόνια που προσεγγίζουν ή απομακρύνονται από το άτομο λόγω του δεσμού Το πρόσημο + ή - που έχουν δείνει εάν τα ηλεκτρόνια αυτά έλκονται από το ένα ή από το άλλο άτομο του δεσμού. Είναι δυνατόν ίδια άτομα να πάρουν διαφορετικό αριθμό οδείδωσης σε διαφορετικές χημικές ενώσεις εάν τα άτομα που θα συνδεθούν έχουν διαφορετική ηλεκτραρνητικότητα όπως είδαμε και στους κανόνες για τον υπολογισμό του αριθμού οξείδωσης

Εάν τα άτομα του ομοιοπολικού δεσμού είναι διαφορετικά , το κοινό ζεύγος των ηλεκτρονίων δεν έλκεται εξ ίσου και από τα δυο άτομα και καταμετράται στο άτομο από τα δυο που το έλκει περισσότερο δηλαδή αυτό που εμφανίζει μεγαλύτερη ηλεκτραρνητικότητα.
Ακόμα είναι δυνατόν μέσα στην ίδια ένωση άτομα το ίδιου στοιχείου να πάρ διαφορετικό αριθμό οξείδωσης ανάλογα με την σύνδεσή τους με άλλα άτομα και αν σε ομοιοπολικούς δεσμούς . παράδειγμα στην προπανόνη ο άνθρακας εμφανίζει αριθμό οξείδωσης +2 και -3
Για να το γνωρίζουμε αυτό πρέπει να προσδιορίσουμε την ηλεκτραρνητικότητα κάθε στοιχείου ώστε να μπορεί να τις συγκρίνουμε. Ο πίνακας (ηλεκτραρνητικότητα) στην συνέχεια βοηθάει ακριβώς αυτό.
γ. Ημιπολικός δεσμός
Στο ιόν αμμωνίου το κοινό ζεύγος που μοιράζονται τα δυο άτομα προσφέρεται αποκλειστικά από το άζωτο.

Στο ιόν αμμωνίου το ζευγάρι ηλεκτρονίων του αζώτου αποδίδεται στο ηλεκτραρνητικότερο από τα δυο που είναι το άζωτο.
και το άζωτο αριθμό οξείδωσης +5
δ.Ετεροπολικός δεσμός
Αριθμός οξειδώσεως σε ετεροπολικές ενώσεις είναι τα πραγματικά φορτία των ιόντων τους

Συνοψίζοντας: Πότε έχουμε περισσότερους από έναν αριθμό οξείδωσης για το ίδιο άτομο
Πολλούς αριθμούς οξείδωσης συναντήσαμε στα στοιχεία μετάπτωσης πράγμα που εξηγείται λόγω της ιδιεταιρότητας της ηλεκτρονιακής τους δομής στις εξωτερικές στοιβάδες και σε ομοιοπολικούς δεσμούς ανάλογα με το άτομο που συμμετέχει και σε μεμονωμένες περιπτώσεις για το Οξυγόνο και το Υδρογόνο.
Πως υπολογίζουμε έναν άγνωστο αριθμό οξείδωσης σε μια χημική ένωση και σε ένα πολυατομικό ιόν
Γενικά αν σε μια ουδέτερη ένωση ή ένα πολυατομικό ιόν έχουμε άτομο με άγνωστο αριθμό οξείδωσης υπολογίσουμε τον αριθμό οξείδωσης με αλγεβρικό τρόπο.
Σε χημική ένωση: Το αλγεβρικό άθροισμα των αριθμών οξειδώσεως σε μια χημική ένωση είναι ίσο με το μηδέν
Στην μεθανόλη ο αριθμός οξείδωσης του άνθρακα μας είναι άγνωστος ενώ γνωρίζουμε πως το υδρογόνο έχει +1 και το οξυγόνο -2 υπολογίζουμε τον άνθρακα με μια απλή αλγεβρική εξίσωση CH3OH: 4+x-2 = 0 ή x = -2 ανάλογα
Στο νερό : Η+12Ο-2 έχουμε 2.(+1) +1.(-2) =0
Στο θειικό οξύ Η+12 S+6O-24 έχουμε 2.(+1) +1.(+6) +4.(-2) =0
Εάν πρόκειται για πολυατομικό ιόν και όχι για μόριο
Αν άτομο με άγνωστο αριθμό οξείδωσης βρίσκεται μέσα σε πολυατομικό ιόν εξισώνουμε με το φορτίο του ιόντος Παράδειγμα στο ανθρακικό ιόν με -2 φορτίο έχουμε άγνωστο τον ΑΟ του άνθρακα : CO3-2 x +3(-2) =-2 ή x=4
Κάθε άτομο μπορεί να πάρει όμως συγκεκριμένες τιμές
Υπάρχουνοι σταθερές δυνατές τιμές για κάθε ένα , που εξαρτώνται κυρίως από τα ηλεκτρόνια της εξωτερικής τους στοιβάδας και τις μεταξύ τους σχέσεις. π.χ. μετάπτωση , υβριδισμός. Ο πίνακας (αριθμός οξείδωσης) δείχνει αυτό
*
Οξείδωση, αναγωγή, οξειδωτικές και αναγωγικές ουσίες
Οι χημικές αντιδράσεις είναι δυο ειδών: Αυτές που δεν μεταβάλλονται οι αριθμοί οξείδωσης των στοιχείων της (όχι οξειδοαναγωγικές ή μεταθετικές) και αυτές που μεταβάλλονται (οξειδοαναγωγικές).
Για να το εξετάσουμε την κατηγορία αυτόυπολογίζουμε τους αριθμούς των στοιχείων στο πρώτο και το δεύτρο μέρος της αντίδρασης
Η δημιουργία χημικών ενώσεων και γενικά οι μεταβολές του αριθμού οξείδωσης τουλάχιστον ενός στοιχείου λόγω αυτών, δημιουργεί μια άλλη κατηγορία χημικών αντιδράσεων τις αντιδράσεις οξειδοαναγωγής
Αναγωγικές ουσίες (Li, Να, K, Μg,)
που λαμβάνουν μέρος στις αντιδράσεις αυτές, χάνουν ηλεκτρόνια και επομένως αυξάνει αλγεβρικά ο αριθμός οξείδωσής τους, λέμε ότι οξειδώνονται. Βέβαια τα ηλεκτρόνια αυτά προσλαμβάνονται κάποια άλλα στοιχεία που συμμετέχουν στην ίδια αντίδραση που ανάγονται και για αυτό τα πρώτα είναι ταυτόχρονα αναγωγικά είναι
 Οξειδωτικές ουσίες ( F2, Cl2, I2, .... , )
Οξειδωτικές ουσίες ( F2, Cl2, I2, .... , )
που λαμβάνουν μέρος στις αντιδράσεις αυτές, προσλαμβάνουν ηλεκτρόνια και επομένως ελαττώνεται αλγεβρικά ο αριθμός οξείδωσής τους, λέμε ότι ανάγονται. Βέβαια τα ηλεκτρόνια αυτά απωθούνται από κάποια άλλα στοιχεία που συμμετέχουν στην ίδια αντίδραση τα οποία και οξειδώνονται και για αυτό τα πρώτα είναι ταυτόχρονα
Χημικές εξισώσεις
Υπάρχουν δύο τύπων 1. Αυτές που ο Αριθμός Οξείδσης ΟΛΩΝ των ατόμων παραμένει αμετάβλητος (μεταθετικές)
Παράδειγμα η διάσπαση του ανθρακικού ασβεστίου προς διοξείδιο του άνθρακα και οξυγόνο
CaCO3 CaO+CO2 μπορεί να γραφεί με τους αριθμούς οξείδωσης
Ca+2C+4O-23 -> Ca+2O-2+ C+4O-22
Εδώ φαίνεται καθαρά πως κανένας αριθμός οξείδωσης δεν μεταβάλεται
2. Αυτές κατά τις οποίες μεταβάλεται ο αριθμός οξείδωσης κάποιων ατόμων στοιχείων που συμμετέχουν (οξειδοαναγωγικές)
Η αντίδραση της καύσης του άνθρακα C+O2 -> CO2 μπορεί να γραφεί με τους αριθμούς οξείδωσης
C0 + O02 -> C+4O-22
Εδώ φαίνεται καθαρά πως οι αριθμοί οξείδωσης μεταβάλονται
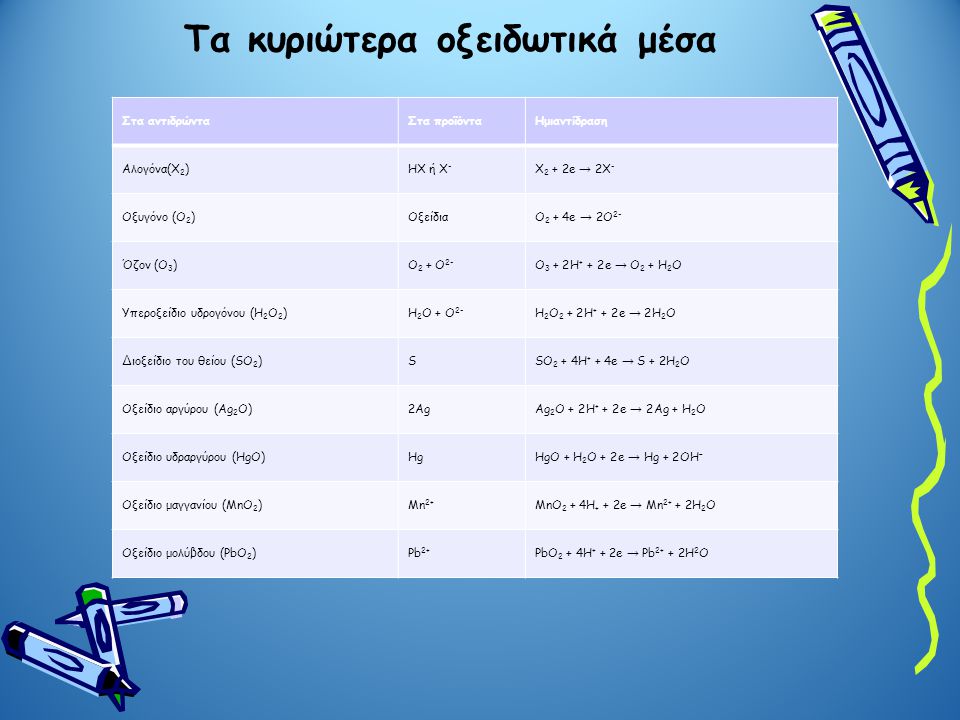
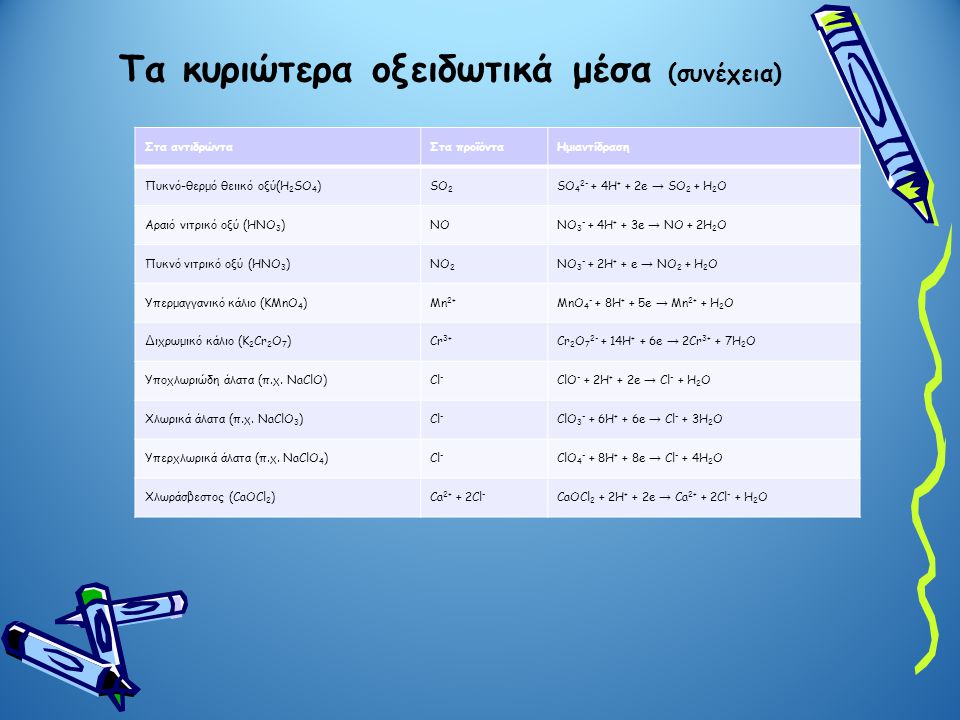
Τα κυριότερα οξειδωτικά και αναγωγικά μέσα.
Χημικές αντιδράσεις-εξισώσεις οξειδοαναγωγής
Συνήθως οι αντιδράσεις οξειδοαναγωγής τις οποίες συναντάμε, περιέχουν μια γνωστή ουσία που χαρακτηρίζεται σαν οξειδωτική ή κάποια άλλη που χαρακτηρίζεται από τις αναγωγικές της ιδιότητες. Είναι λοιπόν καλό και συνηθίζεται να δούμε τις ουσίες αυτές και την χημική συμπεριφορά τους (ας μην ξεχνάμε όμως πως υπάρχει μια πληθώρα άλλων ουσιών με οξειδοαναγωγικές ιδιότητες που δεν αναφέρονται εδώ.
Οξειδωτικές ουσίες ή οξειδωτικά (στοιχεία, χημικές ενώσεις ή ιόντα) είναι αυτές που προκαλούν οξείδωση. Πρέπει να περιέχουν κάποιο/α άτομα που να μπορούν να αναχθούν δηλαδή με την αντίδραση να ελαττώσουν τον αριθμό της οξείδωσης που έχουν
Αυτό πιθανόν νο να εξαρτάται και από τις συνθήκες(συγκέντρωση θερμοκρασία...)
(Παράδειγμα το πυκνό διάλυμα Νιτρικού οξέος σε αντιδράσεις διασπάται σε διοξείδιο του αζώτου και οξυγόνο.
π.HNO3 ->NO2+.... Το άζωτο έχει αρχικά ΑΟ +5 στο ΗΝΟ3και τον μεταβάλλει σε ΑΟ =4 στο ΝΟ2
Αντίθετα το αραιό διάλυμα Νιτρικού οξέος σε αντιδράσεις διασπάται σε μονοξείδιο του αζώτου και οξυγόνο.
αρ.HNO3 ->NO+.... Το άζωτο έχει αρχικά ΑΟ +5 στο ΗΝΟ3και τον μεταβάλλει σε ΑΟ =2 στο ΝΟ
Αναγωγικές ουσίες ή αναγωγικά (στοιχεία, χημικές ενώσεις ή ιόντα) είναι αυτές που προκαλούν αναγωγή. Πρέπει περιέχουν κάποιο/α άτομα που να μπορούν να οξειδωθούν δηλαδή με την αντίδραση να αυξήσουν τον αριθμό της οξείδωσης που έχουν.
Παράδειγμα As2O3 -> As2O5 Το άρσενικό έχει αρχικά ΑΟ +3 και τον μεταβάλλει σε ΑΟ =+5
Καλό είναι πριν προχωρήσουμε σε πολύπλοκες οξειδοαναγωγικές αντιδράσεις να έχουμε τις βασικές αυτές ουσίες και τις ημιαντιδράσεις τους
Οι πίνακες των οξειδωτικών και των αναγωγικ΄ν στοιχείων είναι πολύ βοηθητικοί

Παράδειγμα 1
Ας επιλέξουμε ένα οξειδωτικό σώμα Λ.χ. το υπεροξείδιο του υδρογόνου και ένα αναγωγικό π.χ. το υδρόθειο από τους αντίστοιχους πίνακες αντιδρούν σε δυο ημιαντιδράσεις οξειδοαναγωγής που ενώνονται σε μια τελική
Η2Ο2 +2e -> Η2Ο + Ο-2
H2S -> S+2e-+2H
Εάν αυτές οι δυο ουσίες βρεθούν μαζύ με κατάλληλες συνθήκες το οξυγόνο που ελευθερώνεται από το υπεροξείδιεο θα μετέτρεπε το Η της δεύτερης αντίδρασης σε νερό. Και τα ηλεκτρόνια που ελευθερώνονται από το υδρόθειο προσλαμβάνονται από το υπεροξείδιο του υδρογόνου.Έτσι έχουμε
Η2Ο2 + Η2S -> S + H2O
Οι συντελεστές θα υπολογιστούν αργότερα
Παράδειγμα 2
Δυο στάδια: 1. οξειδοαναγωγική αντίδραση 2. μεταθετική στην συνέχεια
Ας επιλέξουμε ένα άλλο οξειδωτικό σώμα Λ.χ. το αραιό νιτρικό οξύ και ένα αναγωγικό π.χ. το ασβέστιο από τους αντίστοιχους πίνακες . Ένα από τα προιόντα της αντίδρασης αναγωγής, το υδροξείδιο του ασβεστίου, αντιδρά στην συνέχεια με το αρχικό οξειδωτικό σε μεταθετική (όχι οξειδοαναγωγική) αντίδραση
αρ.HNO3 +3Η+ +3e ->NO+ 2H2O
Ca + 2H2O -> Ca (OH)2 +2e +2Η+
Θα μπορούσαμε εδώ από τις δυο ημιαντιδράσεις να πάρουμε την τελική οξειδοαναγωγική αντίδραση. Όμως παρατηρούμε από την ημιαντίδραση αναγωγής πως έχει δημιουργηθεί μια βάση (το υδροξείδιο του ασβεστίου) σε περιβάλλον που εξ αρχής υπάρχει και το οξύ (αρ. νιτρικό). Έτσι ένα μέρος από το νιτρικό οξύ στην συνέχεια θα αντιδράσει με τη βάση όχι πια σαν σώμα σε οξειδοαναγωγική, αντίδραση αλλά σε αντίδραση αντικατάστασης (μεταθετική)
αρ.HNO3 + Ca (OH)2 -> Ca (NO3)2+ H2O
Έτσι η τελική αντίδραση της επίδρασης αραιό νιτρικού οξέος στο ασβέστιο είναι
αρ.HNO3 + Ca -> ΝΟ + Ca (NO3)2 + H2O
Παράδειγμα 3
Ας επιλέξουμε ένα άλλο οξειδωτικό σώμα Λ.χ. το πυκνό θειικό οξύ και ένα αναγωγικό μέταλλο π.χ. τον σίδηρο με περισσότερους από έναν αριθμούς οξείδωσης από τους αντίστοιχους πίνακες Ο σίδηρος που εμφανίζει βαθμό οξείδωσης 2 και 3 θα οξειδωθεί στον ανώτερο βαθμό οξείδωσης
Στην συνέχεια όπως και προηγούμενες περιπτώσεις θα αντιδράσει με το θειικό οξύ σε αντίδραση απλής αντικατάστασης (μεταθετική)
πυκνό Η2SO4 +2e -> So2 + H2O + O-2
Fe0 -> 3e + Fe+3
Τα κατιόντα Fe+3 θα αντιδράσουν με το θειικό οξύ που υπάρχει σε μη οξειδοαναγωγική αντίδραση που θα δώσει Fe2 (SO4 )3
Fe+3 + Η2SO4 - > Fe2 (SO4 )3
Έτσι η τελική αντίδραση της επίδρασης πυκνό θειικό οξύ στο σίδηρο είναι πυκνό Η2SO4 + Fe -> Fe2 (SO4 )3 + So2 + H2O
Παράδειγμα 4
Ας επιλέξουμε ένα οξειδωτικό σώμα Λ.χ. το πυκνό νιτρικό οξύ και ένα άλλο που άλλωτε δρα σαν οξειδωτικό και άλλωτε σαν αναγωγικό π.χ. το διοξείδιο του θείου
πυκνό.HNO3 +Η+ +e ->NO2+ H2O
το SO2 + H2O - > Η2SO4 +2e +2Η+ σαν αναγωγικό
το SO2 + 4Η+ +4e -> S + 2H2O σαν οξειδωτικό
Επιλέγουμε το SO2 σαν αναγωγικό γιατι πυκνό.HNO3 είναι ισχυρό οξειδωτικό και υπερισχύει
Έχουμε πυκνό.HNO3 + SO2 -> Η2SO4 + NO2
Παράδειγμα 5
Αντιδρούν δυο ουσίες με το ίδιο στοιχείο στην μια ουσία δρα σαν οξειδωτικό και στην άλλη σαν αναγωγικό π.χ. το διοξείδιο του θείου και υδρόθειο
SO2 + 4Η+ +4e -> S + 2H2O σαν οξειδωτικό
H2S -> S+2e-+2H σαν αναγωγικό
τελικα δουλεύουμε χωρίς να το πάρουμε υπ όψη μας και έχουμε
S+4O2 +H2S-2 -> S0 +S0 +2H2O
Παράδειγμα 6
Έχουμε ένα οξειδωτικό σώμα Λ.χ. υπερμαγγανικό κάλιο KMnO4 ,και ένα άλλο που δρα σαν αναγωγικό το χλωριούχο νάτριο NaCl. Ταυτόχρονα στην αντίδραση μπαίνει και ένα τρίτο σώμα που αντιδρά με τα προυπάρχοντα και παραγόμενα σώματα: το θειικό οξύ Η2SO4
KMn+7O4 + H+ + 5e -> K+ + H2O +Mn+2O To μαγγάνιο ανάγεται
NaCl - > Na + + Cl- Διάσπαση στο διάλυμα σε ιόντα
2Cl- -> Cl2 + 2e To χλώριο οξειδώνεται
Εδώ μπαίνει το τρίτο σώμα Η2SO4 που αντιδρά με τα ιόντα μετάλλων που υπάρχουν K+, Na + και δίνει θειικά άλατα K2SO4, Na 2SO4
Το Η2SO4 αντιδρά επίσης με το οξείδιο του μαγγανίου που δημιουργήθηκε, (ανυδρίτης βάσης) και δίνει θειικό άλας του δισθενούς μαγγανίου MnSO4,
Η τελική συνολική αντίδραση είναι
KMnO4 + NaCl + Η2SO4 - > Cl2 + K2SO4 +Na 2SO4 +MnSO4 +H2O
Ισοστάθμιση (εύρεση συντελεστών) οξειδοαναγωγικών αντιδράσεων
Μέθοδος ημιαντιδράσεων
Μέθοδος της μεταβολής του αριθμού οξειδώσεως
Στις απλές οξειδωαναγωγικές αντιδράσεις υπάρχει μια ουσία που περιέχει ένα στοιχείο που οξειδώνεται και μια άλλη με ένα που ανάγεται Αυτό που πραγματικά συμβαίνει είναι πως τα ηλεκτρόνια απωθούνται από το αναγωγικό στοιχείο και απορροφώνται από το στοιχείο που οξειδώνεται. Πρέπει λοιπόν να είναι ίσα σε αριθμό. Αυτό το πετυχαίνουμε μετρώντας αρχικά πόσο μεταβλήθηκε ο αριθμός οξείδωσης κατά την αντίδραση, στο οξειδωτικό στοιχείο (δείχνει ταυτόχρονα πόσα επιπλέον ηλεκτρόνια προσλαμβάνει) και στο αναγωγικό (δείχνει πόσα ηλεκτρόνια απέβαλε). Για να πετύχουμε να είναι ίσα βάζουμε την μεταβολή του αναγωγικού σαν συντελεστή του οξειδωτικού και την μεταβολή του οξειδωτικού σαν συντελεστή του αναγωγικού.
Παράδειγμα 1
Στην αντίδραση Αμμωνία και οξείδιο του δισθενούς χαλκού εάν βρούμε τους αριθμούς οξείδωσης του αζώτου και του χαλκού που είναι τα στοιχεία που οξειδώνονται και ανάγονται.
Ν-3Η3+Cu+2O -> N02+Cu0+H2O παρατηρούμε ότι το άζωτο αυξάνει τον ΑΟ κατά 3 ενώ ο χαλκός ελαττώνει τον ΑΟ κατά 2
2ΝΗ3 + 3CuO -> N2+Cu+H2O Βάζουμε το 3 συντελεστή στο οξείδιο του χαλκού και το 2 συντελεστή στην αμμωνία
2ΝΗ3 + 3CuO -> N2 + 3Cu +H2O Με βάσει τους συν2τελεστές αυτούς υπολογίζουμε τους συντελεστές των προιόντων.
2ΝΗ3 + 3CuO -> N2 + 3Cu +3H2O Εάν έχουμε διαφορά ατόμων υδρογόνου, βάζουμε στο νερό όποιον συντελεστή πρέπει ώστε να συμφωνεί
Παράδειγμα 2
Στην αντίδραση μονοξείδιο του άνθρακα και υπερμαγγανικό κάλιο παρουσία θειικού οξέος
C+2O+ KMn+7O4+H2SO4 - > C+4O 2+Mn+2SO4+K2SO4+H2Ο Ο άνθρακας αυξάνει τον ΑΟ κατά 2 ενώ ο χαλκός ελαττώνει τον ΑΟ κατά 5
5CO+2KMnO4+H2S O 4 - > CO 2+ MnSO4+K2S O 4+H2Ο Βάζουμε το 5 συντελεστή στο μονοοξείδιο του άνθρακα και το 2 συντελεστή στο υπερμαγγανικό κάλιο
5CO+2KMnO4+H2S O 4 - > 5CO 2+ 2MnSO4+K2S O 4+H2Ο Με βάσει τους συντελεστές αυτούς υπολογίζουμε τους συντελεστές των προιόντων.
5CO+2KMnO4+3H2S O 4 - > 5CO 2+ 2MnSO4+K2S O 4+H2Ο Μετράμε στο δεύτερο μέλος τις θειικές ρίζες που προέρχονται από το θειικό οξύ που συμμετέχει χωρίς να οξειδώνεται ή να ανάγεται και υπολογίζουμε τον συντελεστή στο πρώτο μέλος
5CO+2KMnO4+3H2S O 4 - > 5CO 2+ 2MnSO4+K2S O 4+ 3H2Ο Βάζουμε στο νερό συντελεστή ώστε τα υδρογόνα να συμφωνούν με το πρώτο μέλος
Παράδειγμα3
Οξείδωση διχλωριούχος σίδηρου( FeCl2) από διχρωμικό κάλιο K2Cr2O7 παρουσία υδροχλωρίου (HCl)
Fe+2Cl2+K2Cr+62O 7 +HCl -> Fe+3Cl3+Cr+3Cl3+KCl+H2Ο Ο σίδηρος αυξάνει τον ΑΟ κατά 1 ενώ το χρώμιο ελαττώνει τον ΑΟ κατά 3. Διπλ
6FeCl2+K2Cr2O 7 +HCl -> FeCl3+CrCl3+KCl+ H2Ο Το διχρωμικό κάλιο περιέχει 2 άτομα χρωμίου και γι αυτό τα ηλεκτρόνια που ανταλλάσσονται είναι διπλάσια. Για αυτόν τον λόγο διπλασιάζουμε τις μεταβολές των αριθμών οξειδώσεων και μετά τους βάζουμε συντελεστές στις ενώσεις που οξειδώνονται και ανάγονται χιαστί στο πρώτο μέλος (όχι στο διχρωμικό κάλιο γιατί υπάρχουν ήδη τα 2 άτομα καλίου) στο μόριο
6FeCl2+K2Cr2O 7 +HCl -> 6FeCl3+ 2CrCl3+2KCl+ H2Ο
Με βάσει τους συντελεστές αυτούς υπολογίζουμε τους συντελεστές των προιόντων.
6FeCl2+K2Cr2O 7 +14HCl -> 6FeCl3+ 2CrCl3+2KCl+ 7H2Ο
Μετράμε στο δεύτερο μέλος τα άτομα χλωρίου που προέρχονται από το υδροχλώριο ( που συμμετέχει στο πρώτο μέλος χωρίς να οξειδώνεται ή να ανάγεται) και από τον χλωριούχο τρισθενή σίδηρο και υπολογίζουμε τον συντελεστή του υδροχλωρίου στο και μετά του νερού στο δεύτερο, από τα υδρογόνα
Σημειώνουμε
1. Επειδή σε οξειδοαναγωγικές αντιδράσεις πολλές φορές συναντάμε ουσίες χωρίς να γνωρίσουμε ποιο στοιχείο θα δράσει οξειδωτικά και ποιο αναγωγικά μπορούμε να χρησιμοποιούμε τις σειρές δραστικότητας των στοιχείων (από μικρότερη τάξη)
Ακόμη υπάρχει ο πίνακας των κανονικών δυναμικών οξειδοαναγωγής όπου η σχετική οξειδωτική και αναγγική ικανότητα φαίνεται καθαρά
ΠΗΓΕΣ
ΧΗΜΕΊΑ Γ ΛΥΚΕΊΟΥ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
Ερωτήσεις απαντήσεις ανοργάνου Χημείας Α. Ζύρμπα
Μεθοδολογία Χημικών αντιδράσεων Κ. Κασιάρη
https://el.wikipedia.org/wiki/Μαγγάνιοl.
https://el.wikipedia.org/wiki/Χρώμιο
