ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ Ομάδας Προσανατολισμού Θετικών Σπουδών Κεφ5 θεωρίαΟΞΕΑ -ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ (ιοντικά διαλύματα, θεωρίες,ιοντισμός οξέων βάσεων, PH, διαλύματα ισχυρών οξέων και βάσεων, διαλύματα ασθενών οξέων και βάσεων, νομος αραίωσης Ostwald))
Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιά, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος να έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη της φετινής σχολικής χρονιάς
Δήμητρα Σπανού
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2016-2017 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
Κεφάλαιο «ΟΞΕΑ – ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ»
ΕKTΟΣ ΑΠΟ: υποενότητα «Ισχύς οξέων – βάσεων και μοριακή δομή» της παρ. «Ιοντισμός οξέων – βάσεων» και
παρ. «Γινόμενο διαλυτότητας».
ΟΞΕΑ – ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ
Εισαγωγή
Εδώ εξετάζονται οι χημικές κατηγορίες ενώσεων που είναι γνωστές σαν οξέα , βάσεις και άλατα με το φως των νέων γνώσεων που έχουμε αποκτήσει για τον μηχανισμό διάσπασης ετεροπολικών ενώσεων και τον ιοντισμό των μοριακών ενώσεων.
Επίσης η θεωρία Bronsted -Lowry, η διάκριση των ηλεκτρολυτών σε ισχυρούς και ασθενείς με την εισαγωγή του βαθμού διάστασης ή βαθμού ιοντισμού (που είναι η απόδοση της αντίδρασης ιονισμού) και η σταθεράς ιοντισμού, (που προέρχεται από την σταθερά χημικής ισορροπίας για την διάσταση οξέων και βάσεων) . Το PH από τον ιονισμό του νερού. Η αρχή του Le Chatelier ερμηνεύει την επίδραση κοινού ιόντος και την δράση των ρυθμιστικών διαλυμάτων.
Οξέα -Βάσεις
Ιοντικά υδατικά διαλύματα
Η διάλυση ουσιών σε κάποιον διαλύτη κάνει τις χημικές αντιδράσεις μεταξύ τους πιο εύκολες αφού τα αντιδρώντα συστατικά έρχονται σε επαφή μεταξύ τους πιο εύκολα με αποτέλεσμα να αυξάνει η ταχύτητα της αντίδρασης.
Τα διαλύματα που θα αναφερθούν είναι ιοντικά και μοριακά
Α. Ιοντικά υδατικά διαλύματα ετεροπολικών ενώσεων
Η διάσταση των ετεροπολικών ενώσεων σε ετεροπολικά ιόντα (Άλατα οξείδια μετάλλων και υδροξείδια μετάλλων.)
Το νερό (με τις ξεχωριστές ιδιότητές του που οφείλονται στην πολικότητα και την δομή του), όταν βρεθεί κοντά σε κρυσταλλικές ενώσεις (άλατα, οξείδια μετάλλων και υδροξείδια μετάλλων) , προσανατολίζεται μεταξύ των ιόντων που δομούν το κρυσταλλικό πλέγμα. Λόγω του δυνάμεων που αναπτύσσει το δίπολο του νερού, οι άλλες δυνάμεις που συγκρατούν τα ιόντα στο πλέγμα σταθερά, εξασθενούν και αυτά μεταφέρονται ελεύθερα στο διάλυμα. Τα ελεύθερα ιόντα μέσα στο διάλυμα περιβάλλονται από μόρια νερού που προσανατολίζονται ανάλογα
NaCl(s) Η2Ο -> Na+(H2 Ο)χ + Cl- (H2 Ο)y ή
NaCl(s) -> Na+ (aq) + Cl- (aq)
Έτσι Ιοντική διάσταση σε ιοντικές (ετεροπολικές) ενώσεις είναι η απομάκρυνση των ιόντων από το κρυσταλλικό πλέγμα
Ας θυμηθούμε την απόδοση της αντίδρασης από το κεφάλαιο 4. Για τις αντιδράσεις της διάστασης των ιοντικών διαλυμάτων την ονομάζουμε τώρα βαθμό διάστασης ή βαθμό ιονισμού κσι συμβολίζεται επίσης με το α
θυμηθούμε την απόδοση της αντίδρασης από το κεφάλαιο 4. Για τις αντιδράσεις της διάστασης των ιοντικών διαλυμάτων την ονομάζουμε τώρα βαθμό διάστασης ή βαθμό ιονισμού κσι συμβολίζεται επίσης με το α
Τα ιοντικά διαλύματα αφορούν ετεροπολικούς διαλύτες όπως άλατα, οξείδια μετάλλων και υδροξείδια μετάλλων. NaCl, CaS, MnO, Al(OH)3 κ.α.
Κατά την διάστασή τους στο νερό οι ιοντικές ενώσεις διίστανται πλήρως. Άρα η απόδοση ή εδώ ο βαθμός διάστασης ή ιονισμού είναι α= 1
Β. Ιοντικά υδατικά διαλύματα ομοιοπολικών ενώσεων
Οι ομοιοπολικές ενώσεις εμφανίζουν μια ανομοιομορφία στην διαλυτότητά τους στο νερό. Υπάρχουν ενώσεις που πρακτικά 1.δεν διαλύονται καθόλου στο νερό.
2.Υπάρχουν άλλες που διαλύονται αλλά δημιουργούν μοριακά διαλύματα παραμένουν τα μόριά τους αδιάστατα. Εδώ ο βαθμός διάστασης ή ιονισμού είναι α=0 παράδειγμα το εξάνιο
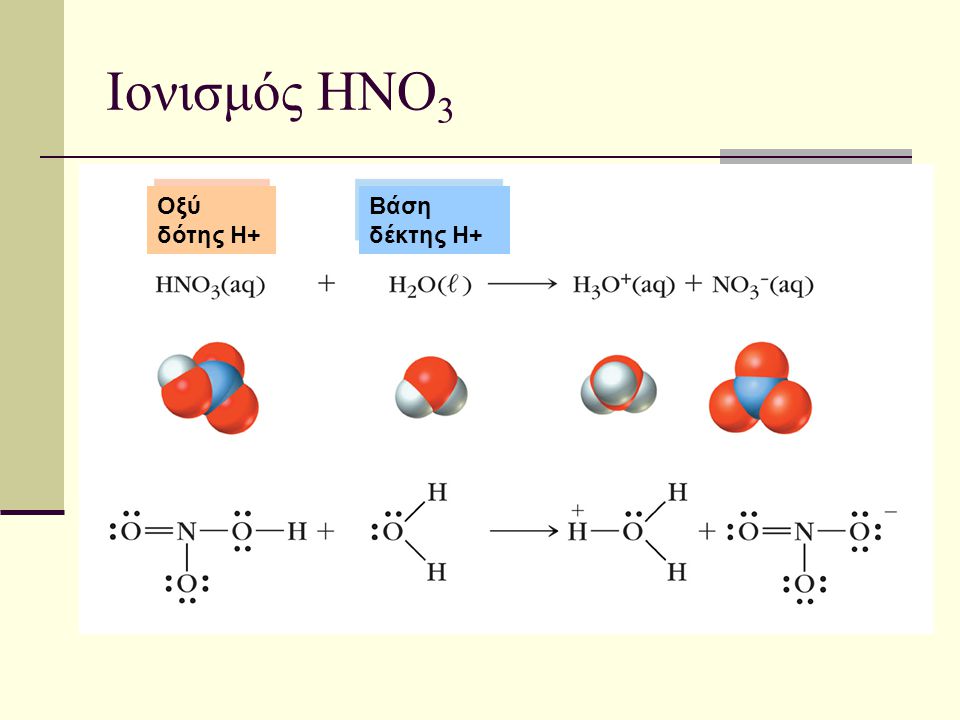
 3. Σε άλλες ομοιοπολικές ενώσεις τα μόριά τους σε υδατικά διαλύματα διίστανται σε ιόντα και δημιουργούν ιοντικά διαλύματα. Εδώ ο βαθμός διάστασης ή βαθμός ιονισμού είναι ίσο με α= 1 Χαρακτηριστικές περιπτώσεις τέτοιων υδατικών διαλυμάτων είναι ισχυρά οξέα όπως π.χ.το HCl που δίνει πρωτόνια στο νερό δημιουργώντας κατιόντα οξωνίου
3. Σε άλλες ομοιοπολικές ενώσεις τα μόριά τους σε υδατικά διαλύματα διίστανται σε ιόντα και δημιουργούν ιοντικά διαλύματα. Εδώ ο βαθμός διάστασης ή βαθμός ιονισμού είναι ίσο με α= 1 Χαρακτηριστικές περιπτώσεις τέτοιων υδατικών διαλυμάτων είναι ισχυρά οξέα όπως π.χ.το HCl που δίνει πρωτόνια στο νερό δημιουργώντας κατιόντα οξωνίου
HCl (δ) + H2O -> Η3Ο+(δ) + Cl-(δ)
4. Υπάρχουν όμως και οι ενδιάμεσες περιπτώσεις όπου υπάρχει διάσταση μόνο ενός αριθμού από τα διαλυμένα μόρια ενώ τα υπόλοιπα παραμένουν αδιαλυτα. Εδώ ο βαθμός διάστασης ή βαθμός ιονισμού είναι 0<α<1
Χαρακτηριστικές περιπτώσεις τέτοιων υδατικών διαλυμάτων ομοιοπολικών ενώσεων είναι το Θειώδες οξύ H2SO3 ή η αμμωνία NH3
ΝΗ3(δ) + Η2Ο <- > ΝΗ4+ (δ) + ΟΗ- (δ)
Έτσι Ιοντισμός μιας ομοιοπολικής ένωσης είναι η αντίδραση των μορίων της με τα μόρια του διαλύτη προς σχηματισμό ιόντων
Θεωρίες για οξέα -βάσεις (148-141)
Θεωρία του Arrhenius από την Α Λυκείου: Σύμφωνα με αυτήν τα οξέα είναι ενώσεις που περιέχουν υδρογόνο, και όταν διαλύονται στο νερό το υδρογόνο τους ελευθερώνεται σαν κατιόν (Η+). Αντίστοιχα βάσεις είναι ενώσεις που περιέχουν υδροξύλιο, και όταν διαλύονται στο νερό το υδροξύλιό τους ελευθερώνεται σαν ανιόν (ΟΗ-)
τώρα έρχονται δυο νέες θεωρίες που αποδεσμεύουν τον ορισμό των οξέων από την υπαρξη ή όχι του νερού σαν διαλύτη, αλλά ακόμα και από την ύπαρξη υδρογόνων ή υδροξύλιων στο μόριό τους αντίστοιχα
Η θεωρία Bronsted -Lowry και η θεωρία Lewis
Θεωρία Bronsted -Lowry : Σαν οξύ ορίζεται η ένωση που μπορεί να δώσει πρωτόνια (Η+) ανεξάρτητα εάν υπάρχει το νερό σαν διαλύτης)
Σαν βάση ορίζεται η ένωση που μπορεί να δεχθεί πρωτόνια (Η+) ,ανεξάρτητα εάν υπάρχει υδροξύλιο στο μόριό της και το νερό σαν διαλύτης
Έτσι όταν υπάρχει ένα οξύ (που θα ελευθερώσει τα πρωτόνια) πρέπει ταυτόχρονα να υπάρχει και μια βάση για να δεχθεί τα πρωτόνια. 
Το οξύ όταν ελευθερώσει πρωτόνιο/α, μετατρέπεται σε βάση γιατί έχει την τάση να επαναπροσλάβει πρωτόνια
Τα συζυγή ζεύγη : οξύ και συζυγή βάση του και η βάση με το συζυγές οξύ της (ΗΑ/ Α-) και (Β/ΗΒ+)
 διαφέρουν κατά ένα πρωτόνιο (το οξύ έχει ένα πρωτόνιο περισσότερο από την συζυγή του βάση)
διαφέρουν κατά ένα πρωτόνιο (το οξύ έχει ένα πρωτόνιο περισσότερο από την συζυγή του βάση)
\
Παραδείγματα αντιδράσεων
HF (οξύ 1) + Η2Ο( βάση 2) <--> Η3O+ (συζυγές οξύ2) + F-(συζυγής βάση1)
H2SO4 (οξύ 1) + Η2Ο( βάση 2) < --> Η3O+ (συζυγές οξύ2) +HSO4 -(συζυγής βάση1)
HSO4- (οξύ 1) + Η2Ο( βάση 2) <--> Η3O+ (συζυγές οξύ2) +SO4 2-(συζυγής βάση1)
HF (οξύ 1) + ΝΗ3( βάση 2) < -> ΝΗ4+(συζυγές οξύ 2) + F-(συζυγής βάση1)
ΝΗ3( βάση 1) + Η2Ο(οξύ 2) <-> ΝΗ4+(συζυγές οξύ 1) + ΟΗ-(συζυγής βάση1)
Παρατηρούμε ότι το νερό παίζει τον ρόλο του οξέος αλλά και της βάσης (στην τελευταία αντίδραση)
Τέτοιες ουσίες που δρούν άλλωτε σαν οξέα και άλλωτε σαν βάσεις ανάλογα με την αντίδραση ονομάζονται αμφιπρωτικές ή αμφολύτες
Παραδείγματα συζυγών ζευγών οξέος / βάσης
HCl /Cl- , H2S /HS -, HS -/ S 2-, Η2O /ΟΗ-, H3O +/ Η
Ιοντισμός οξέων και βάσεων (σελ 142)
Υπάρχουν ετεροπολικοί ηλεκτρολύτες που διίστανται (ιονίζονται ) 100% (ετεροπολικές ενώσεις, άλατα, οξείδια μετάλλων και υδροξείδια μετάλλων).
Υπάρχουν και οι ομοιοπολικοί ηλεκτρολύτες (Οξέα, αμμωνία) που μπορεί να διίστανται (ιονίζονται ) πλήρως ή σε μικρότερο ποσοστό. Έτσι διακρίνουμε ισχυρούς ηλεκτρολύτες όταν η διάσταση είναι πλήρης ή σε μεγάλο ποσοστό (όπως ΗF, HNO3), και ασθενείς, όταν η διάσταση γίνεται σε μικρό ποσοστό (όπως NH3, H2S, H2SO3 Κ.α.)
Επόμενο είναι φυσικό , ένα οξύ που είναι ισχυρός ηλεκτρολύτης , με μεγάλη διάθεση να διώξει το πρωτόνιό του, να έχει μια συζυγή βάση ασθενή που δεν έχει τάση να επαναπροσλάβει το πρωτόνιό του και να ανασχηματιστεί το οξύ
Αντίστοιχα όσο ισχυρότερη είναι μια βάση τόσο ασθενέστερο είναι το συζυγές οξύ της
Μέτρο της ισχύος των ηλεκτρολυτών είναι ο βαθμός διάστασής τους που λέγεται και βαθμός ιοντισμού. Είναι το ποιλίκον των moles που διίστανται προς τα αρχικά moles του διαλύματος και εκφράζει την απόδοση της διάστασης του ηλεκτρολύτη στο νερό όπως είχε διατυπωθεί στο κεφάλαιο 4.
Εξαρτάται από τη φύση του διαλύτη, την φύση του ηλεκτρολύτη, τη θερμοκρασία, τη συγκέντρωση και την παρουσία κοινών ιόντων στο διάλυμα
Τα οξέα που ιονίζονται πλήρως ονομάζονται ισχυρά. Τα HCI, HBr, HI, ΗΝO3, HCIO4 για παράδειγμα είναι ισχυρά οξέα Το α=1
. Ονομάζονται μονοπρωτικά αυτά που έχουν ένα υδρογόνο.
Άλλα μονοπρωτικά οξέα όμως δεν ιονίζονται πλήρως ονομάζονται ασθενή. Φτάνουν σε μια ισορροπία όπως : HF + Η2Ο < -> H3O + + F-
Ασθενή οξέα είναι HCN, HCIO, HCOOH, CH3COOH Το α <1
Η αντίδραση ιονισμού γράφεται έτσι : HCl + Η2O → Η3O + + Cl- ή έτσι HCl → Η + + Cl- και ο βαθμός ιοντισμού είναι περίπου ένα α=1
Υπάρχουν όμως οξέα που έχουν περισσότερα από ένα υδρογόνα (πολυπρωτικά). Αυτά διίστανταί σε περισσότερα από ένα στάδια που δεν έχουν ίδιο βαθμό διάστασης.
H2S + H2Ο < -> H3Ο+ + HS- α1
και HS- + Η2Ο <-> H3Ο+ + S-2 α2 (α1διαφορετικό από α2)
Ανάλογα υπάρχουν ασθενείς βάσεις κατά Βrosted Lowry που δεν ιονιζονται πλήρως όπως η αμμωνία και το ανιόν φθορίου : ΝΗ3 + Η2Ο <-> NH4 + +ΟΗ-
και F- + Η2Ο <-> HF + ΟΗ-
Ιοντισμός του νερού PH (σελ145)
Ένα μικρό ποσοστό από τα μόρια του νερού διασπώνται -διίστανται σε ιόντα, που βρίσκονται μεταξύ των αδιάστατων μορίων του. Η αμφίδρομη αντίδραση του νερού είναι:
Η2Ο + Η2Ο <--> Η3Ο+ + ΟΗ-
η σταθερά χημικής ισορροπίας του (σταθερά ιοντισμού ή γινόμενο ιόντων του νερού) Κw. Στην σταθερά αυτή, συμπεριλαμβάνεται και η συγκέντρωση του νερού. Εάν υποθέσουμε ότι ένα λίτρο νερού είναι περίπου 1000gr νερού και αφού το ΜΒ του είναι 18 , τα 1000gr είναι 1000/18 = 55,55mol/lt. (ρ = 1 g mL-1 (25οC)
Εξαρτάται μόνο από την θερμοκρασία , δίνεται από την σχέση
Κw= [Η3Ο+] [ΟΗ-] και στους 25οC είναι Κw= 10-14 και οι μονάδες της είναι Kw (mol2/L2) οι οποίες παραλείπονται.
Σε καθαρό νερό η συγκέντρωση του υδροξυλίου είναι ίση με την συγκέντρωση των οξονιιων όπως προκύπτει από την αντίδραση.
Έτσι έχουμε Κw= [Η3Ο+] [ΟΗ-] = 10-14 ->χ.χ = 10-14 άρα στο καθαρό νερό [Η3Ο+] = [ΟΗ-] = 10-7
Τι θα συμβεί όμως εάν στο διάλυμα προστεθούν επιπλέον [Η3Ο+] ( για παράδειγμα με την προσθήκη μιας ποσότητας οξέος) ή επιπλέον [ΟΗ-] ( για παράδειγμα με την προσθήκη μιας ποσότητας βάσης) .
Προσθήκη επιπλέον [Η3Ο+] στο καθαρό νερό
Με την προσθήκη οξέος δεν θα έχουμε πια ίσες συγκεντρώσεις [Η3Ο+] και [ΟΗ-] γιατί τα Η3Ο+ δεν θα προέρχονται μόνο από την διάσταση του νερού αλλά και από την διάσταση του οξέος και έτσι θα έχουμε μεγαλύτερη συγκέντρωση [Η3Ο+]. Όμως η σταθερά Κw πρέπει να παραμείνει 10-14. Έτσι μειώνεται η συγκέντρωση του [ΟΗ-]
[Η3Ο+] > 10-7 M > [OH-]
Προσθήκη επιπλέον [ΟΗ-] στο καθαρό νερό
Με την προσθήκη βάσης δεν θα έχουμε πια ίσες συγκεντρώσεις [Η3Ο+] και [ΟΗ-] γιατί τα [ΟΗ-] δεν θα προέρχονται μόνο από την διάσταση του νερού αλλά και από την διάσταση της βάσης και έτσι θα έχουμε μεγαλύτερη συγκέντρωση [ΟΗ-]. Όμως η σταθερά Κw πρέπει να παραμείνει 10-14. Έτσι μειώνεται η συγκέντρωση του [Η3Ο+]
[Η3Ο+] < 10-7 M < [OH-]
Όταν υπολογίζουμε το PH σε διαλύματα που υπάρχουν είτε ισχυρά οξέα, είτε ισχυρές βάσεις,τα Η3Ο+ ή τα OH- προέρχονται και από την διάσταση του νερού αλλά και του oξέος ή της βάσης και πρέπει να συνυπολογιστούν
παράδειγμα 1 (ισχυρό οξύ χαμηλής συγκέντρωσης)
Εάν όμως πρόκειται για υδροχλωρικό οξύ 0,0000001Μ ή 10-7Μ τότε στην συγκέντρωση [Η3Ο+] πρέπει να συνυπολογίσουμε και τα Η3Ο+ που προέρχονται και από το νερό:
HCl + Η2O → Η3O + + Cl-
από cmol/lt HCL παράγονται c [Η3Ο+] c [OH-]
H2 O + H2 O -> H3 O+ + OH-
αν ιονίζονται χmol/lt νερό παράγονται χ[Η3Ο+] και x [OH-]
H συνολική συγκέντρωση [Η3Ο+] είναι 10-7+x και ισχύει [Η3Ο+] [ΟΗ-] = 10-14
αρα (10-7+x) x = 10-14 επιλύουμε και χ=0,62 άρα [Η3Ο+]=1,62 και [OH-] =0,62
Εάν όμως η συγκέντρωση του οξέος ή της βάσης είναι αρκετά υψηλή (συνήθως μεγαλύτερη του 10-4) τότε η συγκέντρωση Η3Ο+ ή OH- που προέρχονται από την διάσταση του νερού παραλείπεται και το PH υπολογίζεται μόνο από την συγκέντρωση και την πλήρη διάσταση του οξέος ή της βάσης ανάλογα.
παράδειγμα 2 (ισχυρό οξύ υψηλής συγκέντρωσης)
Για παράδειγμα εάν πρόκειται για υδροχλωρικό οξύ 0,01Μ ή 10-2Μ Τότε η [Η3Ο+] =10-2 και το PH=2 και το PΟH =14-2=12.
Ανάλογα υπολογίζονται οι περιεκτικότητες [ΟΗ-] σε διαλύματα ισχυρών βάσεων
Διαλύματα ασθενών οξέων - ασθενών βάσεων (σελ150)
Τα οξέα στο νερό διίστανται και ελευθερώνουν πρωτόνια. Δεν είναι όμως ίδια η ικανότητα όλων των οξέων να ελευθερώνουν πρωτόνια. Υπάρχουν οξέα που διίστανται σχεδόν εξ ολοκλήρου και άλλα μερικώς και άλλα πολύ λίγο. Λέμε τότε πως τα οξέα διαφέρουν κατά την ισχύ τους και έχουμε ισχυρά οξέα και ασθενή οξέα.
Σε ένα αραιό διάλυμα ένα μονοπρωτικό οξύ διίσταται ως εξής :
HA + H2O <- > H3O+ + A-
Και καταλήγει σε κατάσταση χημικής ισορροπίας όπου ισχύει η σταθερά χημικής ισορροπίας για την αντίδραση ιονισμού του
Κ= [H3O+ ] [ A-]
[HA ] [ H2O ]
Σε αραιά διαλύματα οξέων μπορούμε να υπολογίσουμε την συγκέντρωση του νερού (στον παρονομαστή) γιατί είναι σχεδόν σταθερή
Εάν υποθέσουμε ότι ένα λίτρο νερού είναι περίπου 1000gr νερού και αφού το ΜΒ του είναι 18 , τα 1000gr είναι 1000/18 = 55,55mol/lt. Εφ όσον λοιπόν είναι σταθερή, μπορούμε να ενσωματώσουμε την συγκέντρωση του νερού στην σταθερά χημικής ισορροπίας
Κ[ H2O ] = [H3O+. ][ A-] / [ΗΑ] Η Κ[ H2O ]= [H3O+. ][ A-] / [ΗΑ] =Κ . 55,55 =Κa
Η Κα ονομάζεται σταθερά ιοντισμού ασθενούς οξέος και εξαρτάται μόνο από την θερμοκρασία μόνο
(σε αντίθεση με τον βαθμό ιοντισμού α που εξαρτάται από την θερμοκρασία και την συγκέντρωση)
Με την ίδια λογική ασθενείς βάσεις όταν διαλύονται στο νερό δίνουν ανιόντα υδροξυλίου
Β + Η2Ο <-> ΒΗ + ΟΗ- Στην σταθερά Κ χημικής ισορροπίας του ιονισμού της Βάσης, ενσωματώνεται η συγκέντρωση του νερού. ¨Ετσι έχουμε αντίστοιχα
Κb = K. [ H2O ] = [HB+] .[OH-] /[B] ονομάζεται σταθερά ιοντισμού ασθενούς βάσης και εξαρτάται μόνο από την θερμοκρασία μόνο
Στα ισχυρά οξέα και βάσεις οι Κα και Κβ έχουν μεγάλες τιμές (102 - 109) στα ασθενή μικρές (10-4 - 10-15).
Στις ασκήσεις με ασθενή μονοπρωτικά οξέα (ή μονόξινες βάσεις) συναντάμε την σταθερά ιονισμού Kα (ή Κβ) την συγκέντρωση του ασθενούς οξέος - βάσης c και τον βαθμό διάστασης α. Aν έχουμε ασθενές οξύ με αρχική συγκέντρωση c και βαθμό διάστασης α
HA + H2O <- > H3O+ + A-
αρχικά C
παράγονται αc αc
τελικά c - αc αc αc
Κα= αc .αc / c - αc = α2c/1-α
Εάν όμως α<<1 (ο βαθμός διάστασης είναι πολύ μικρότερος από την μονάδα), το 1-α είναι περίπου ίσο με 1και έχουμε
Κα= α2c
Παραδείγματα υπάρχουν στο άρθρο με τις περιπτώσεις ασκήσεων κεφ 5
Νόμος αραιώσεως του Ostwarld (σελ 152)
Ο νόμος του Ostwarld βασίζεται στους τύπους για την διάσταση μονοπρωτικού οξέος που συσχετίζει την συγκέντρωση του οξέος, την σταθερά της ιοντικής ισορροπίας, και τον βαθμό διάστασης.
Σε ασθενή οξέα , ο βαθμός διάστασης ελαττώνεται όσο αυξάνεται η συγκέντρωση του διαλύματος του οξέος. Αυτά αποδεικνύεται και μαθηματικά
Ka = α2c/(1 - α) και Kb = α2c /(1 - α) ή απλουστευμένα για α< 0,1 ή Ka/c < 0,01 τότε 1 - α ~ 1 και
Ka = α2c και Kb = α2c
αν οι υπολογισμοί δεν συμπεριλαμβάνουν το α μπορούμε να εκφράσουμε τα moles που διίστανται με χ αντί για αc.
Τότε Ka = χ2/c - x) αν πρόκειται για μονοπρωτικό οξύ και Kβ = χ2/c - x) αν πρόκειται για μονοξινη βάση
με Ka /c < 0,01 τότε Ka = χ2/c για μονοπρωτικό οξύ και Kβ = χ2/c αν πρόκειται για μονοξινη βάση
Σχέση Κα και Κβ . Πρόβλεψη της κατεύθυνσης που θα έχει μια αντίδραση οξέος βάσης κατά Bronsted Lowry(σελ 153)
Μπορούμε να βρούμε την σχέση για την Κα και Κβ χρησιμοποιώντας την διάσταση ενός ζεύγους συζυγές οξύ/ συζυγής βάση. Παράδειγμα ΗΑ/Α-
ΗΑ + Η2Ο -> Η3O + + A- τότε Κα = [Η3O +] [ A- ] (1)
[ΗΑ]
Α- + Η2O <--> ΗΑ + ΟΗ- Κβ = [ΗO- ] [ ΗA ] (2)
[Α-]
Αν πολλαπλάσιάσουμε την ισότητα (1) επί την ισότητα (2) έχουμε
Κα.Κβ = [Η3Ο+] [ΟΗ-] = Κw =10 -14 (από διάσταση νερού)
Επίσης αν θεωρήσουμε μια αντίδραση οξέος και βάσης κατά Bronsted Lowry μπορούμε να προβλέψουμε την κατεύθυνση που θα έχει με βάση τις σταθερές ιοντισμού Ka / Kb
- Η ισορροπία μετατοπίζεται προς το ασθενέστερο οξύ και την ασθενέστερη βάση. Με άλλα λόγια ευνοείται η μεταφορά πρωτονίων από το ισχυρό οξύ στην ισχυρή βάση.
- Επίσης θυμόμαστε πως όσο ισχυρότερο είναι το οξύ τόσο ασθενέστερη είναι η συζυγής του βάση
H 2SO4(aq)(οξύ) + NH 3(aq) (βάση) < -> NH 4 +(aq)(συζυγές οξύ) + HSO 4 –(aq)(συζυγής βάση)
Παίρνουμε τις Κα και Κβ από τον πίνακα του σχολικού για να συγκρίνουμε
Για τα οξέα στο 1ο και 2ο μέλος το θειικό στο πρώτο μέλος είναι ισχυρότερο η Κα Κα H 2SO4 =1 0 3 > Κα ΝΗ4+= 5,6.10-10
Για τις βάσεις στο 1ο και 2ο μέλος η ΝΗ3 στο πρώτο μέλος είναι ισχυρότερη η Κβ ΝΗ3 =1,8 10-5 > Κβ HSO 4 – =1,1.10-2
Και οι δυο συγκρίσεις δίνουν μετατόπιση προς το 2ο μέλος
ΠΗΓΕΣ
Χημεία Γ Λυκείου Προσανατολισμου
https://www.konal.gr/ergasies/oxea/2/2.htm
Ορισμός των οξέων και των βάσεων από τους Brønsted-Lowry Σύμφωνα ...
