Δήμητρα Σπανού, χημικός, μόνιμη καθηγήτια Δ/θμιας Εκπ/σης στο 1ο Γυμνάσιο Δάφνης (μετά το 2010)
ΤΑ ΥΓΡΑ: ΔΟΜΗ ΚΑΙ ΕΠΙΦΑΝEΙΑΚΗ ΔΡΑΣΤΗΡΙΟΤΗΤΑ
Τα υγρά δεν σχηματίζονται μόνο από την συσσωμάτωση μορίων και ατόμων, αλλά αποτελούν και μια θερμοδυναμική φάση που τα όριά της εξαρτώνται από την Πίεση
Τα μόρια των υγρών έλκονται μεταξύ τους αρκετά ώστε να μένουν κοντά, και εδώ ισχύουν οι διαμοριακές δυνάμεις Van der Waals μεταξύ των σωματιδίων τους.
Οι αποστάσεις των μορίων στα υγρά είναι σταθερές, αλλά τα μόρια κινούνται το ένα σε σχέση με το άλλο ώστε, δεν παραμένει σταθερή η θέση τους
Έτσι, ο Όγκος των Υγρών παραμένει σταθερός όχι όμως το σχήμα τους. Πρέπει να ασκήσουμε πολύ μεγάλες δυνάμεις για να αλλάξουμε τον όγκο τους, έχουν όπως λέγεται ελαστικότητα όγκου.
Τα υγρά είναι ισότροπα στις ιδιότητές τους , σε αντίθεση με τα κρυσταλλικά στερεά, που εμφανίζουν ανισοτροπία, πλην αυτών που ως στερεά, κρυσταλλώνονται στο κυβικό σύστημα.
ΣΥΜΠΕΡΙΦΟΡΑ ΩΣ ΠΡΟΣ ΤΟ ΦΩΣ. ΥΓΡΟΙ ΚΡΥΣΤΑΛΛΟΙ
Τα διαφανή υγρά είναι γενικά, ισότροπα ως προς το φως , δηλαδή, οι ιδιότητές τους είναι ίδιεςκατά διαφόρους διευθύνσεις, εντός της μάζας τους
Ακόμα τα υγρά δεν εμφανίζουν ορισμένα οπτικά φαινόμενα όπως η περίθλαση, (τα οποία εμφανίζουν τα στερεά) και
Κάποιοι δακτύλιοι περίθλασης που παρατηρούνται σε αυτά είναι ασαφείς
Ο λόγος είναι , οι θέσεις των μορίων στα υγρά δεν είναι σταθερές, (παρ΄ότι παραμένει σταθερή η απόστασή τους) κι έτσι δεν δίνουν φάσματα όπως τα στερεά, όταν ακτινοβοληθούν με ακτινοβολία. (πλην κάποιων ειδικών περιπτώσεων μεγάλων οργανικών μορίων, όπου τα μόριά τους εμφανίζουν κάποια τάξη).
Δηλαδή, ορισμένα οργανικά υγρά όπως υγροί υδρογονάνθρακες από C5H12 έως C15H32 και οξέα που η διάταξη και οι αποστάσεις των μορίων τους στην υγρή κατάσταση δεν διαφέρει πολύ από την στερεά τους κατάσταση δίνουν συμπεριφορά ως προς το φως ανάλογη με αυτήν της στερεής τους κατάστασης
 Μια ειδική περίπτωση αυτού είναι οι Υγροί Κρύσταλλοι
Μια ειδική περίπτωση αυτού είναι οι Υγροί Κρύσταλλοι
Ορισμένες Οργανικές ενώσεις μακράς αλύσου όπως με ακραίες ομάδες όπως -OR, -COOR, και ενδιάμεσες ομάδες τις -C=C- , -C=N- , -N=N- σε υγρή κατάσταση, εμφανίζουν ανισοτροπία στην συμπεριφορά τους ανάλογη με αυτήν των κρυστάλλων. Ονομάζονται γι αυτό ΥΓΡΟΙ ΚΡΥΣΤΑΛΛΟΙ και έχουν πολλές εφαρμογές
Η ΕΙΔΙΚΗ ΣΥΜΠΕΡΙΦΟΡΑ ΠΟΥ ΕΜΦΑΝΙΖΕΙ Η ΕΠΙΦΑΝΕΙΑ ΤΩΝ ΥΓΡΩΝ
Για μικρές μάζες, τα υγρά τείνουν να παίρνουν σχήμα σφαιρικό, και η επιφάνειά τους εμφανίζει συμπεριφορά ανάλογη με ελαστικής μεμβράνης, ώστε τείνει να δώσει την ελάχιστη δυνατή επιφάνεια (για τον συγκεκριμένο όγκο)
Στα υγρά ισχύουν οι δυνάμεις Van der Waals μεταξύ των σωματιδίων τους.
Στο εσωτερικό των υγρών οι δυνάμεις αυτές ασκούνται από και προς όλες τις κατευθύνσεις και έτσι δεν δίνουν συνολικό σημαντικό αποτέλεσμα. Αντίθετα, στα μόρια της επιφάνειας των υγρών ασκούνται δυνάμεις μόνο από το εσωτερικό. Έτσι υπάρχει μια συνισταμένη δύναμη όλων αυτών των δυνάμεων που έχει συγκεκριμένη τιμή και είναι κάθετη στην επιφάνεια.
Σε μεγάλες ποσότητες η βαρύτητα εμποδίζει την δημιουργία σφαιρών.
Μπορούμε να μελετήσουμε πιο γενικευμένα το φαινόμενο με την Επιφανειακή Τάση Ρευστών
.jpg) Η ΕΠΙΦΑΝΕΙΑΚΗ ΤΑΣΗ ΣΤΑ ΥΓΡΑ
Η ΕΠΙΦΑΝΕΙΑΚΗ ΤΑΣΗ ΣΤΑ ΥΓΡΑ
Από τα παραπάνω συμπεραίνουμε ότι δημιουργείται στην επιφάνεια των υγρών μια ανισορροπία δυνάμεων και εφόσον υπάρχει ο γενικός όρος της φύσης που λέει ότι "Κάθε Σύστημα, τείνει αυθόρμητα να εκλείψει τις ανισορροπίες, όπου υπάρχουν σ' αυτό και να αποκτήσει την χαμηλότερη δυνατή στάθμη ενέργειας.
Στην επιφάνεια υγρών έχουμε διαφορετική συμπεριφορά από το εσωτερικό του, όσον αφορά τις δυνάμεις μεταξύ των μορίων, εφόσον οι δυνάμεις van der Walls δεν ασκούνται ισόρροπα στην επιφάνεια του υγρού όπως στο εσωτερικό του. Αποτέλεσμα είναι στην επιφάνεια η τελική συνισταμένη δύναμη να είναι διάφορη από το μηδέν .
Επιφανειακή τάση ονομάζεται η δύναμη που ασκείται ανά μονάδα μήκους στην γραμμή που οριοθετεί την επιφάνεια του υγρού (περίγραμμα) και κάθετα σε αυτό.
. Έχει διπλή φυσική σημασία,
α. ενεργειακή (θερμοδυναμική) και δυναμική (μηχανική)
α. Ενεργειακή ερμηνεία: Εφόσον στην επιφάνεια των υγρών ασκείται δύναμη αυξάνεται η δυναμική ενέργεια στην επιφάνεια. Έτσι, τα μόρια του υγρού, για να μειώσουν αυτήν την επιπλέον ενέργεια, τείνουν να αυξήσουν την έκταση της επιφάνειας του υγρού, ώστε το παραγόμενο έργο να την απορροφήσει και το σώμα να φτάσει σε χαμηλότερο ενεργειακό επίπεδο για μεγαλύτερη σταθερότητα.
Γενικότερα, η δημιουργία επιφάνειας σε ένα υγρό, απαιτεί την καταβολή έργου και παραπέρα έκταση της επιφάνειας αυτής, απαιτεί πρόσθετο έργο.
Η επιφανειακή τάση είναι το συγκεκριμένο έργο της αύξησης της επιφάνειας .
Δυναμική (μηχανική) σημασία:
Τα μόρια στην επιφάνεια ενός ρευστού δέχονται ανισόρροπα δυνάμεις από τις διαμοριακές συνδέσεις στην επιφάνεια από ότι στο εσωτερικό
Η επιφάνειά τους δέχεται ακόμα την πίεση της ατμόσφαιρας, και η συνολική δύναμη από τις διαμοριακές συνδέσεις στην επιφάνεια δεν είναι ικανή να εξισορροπήσει την ατμοσφαιρική πίεση, (που οφείλεται δύναμη από το βάρος των υπερκείμενων στρωμάτων της ατμόσφαιρας). Η ατμοσφαιρική Πίεση ασκείται κάθετα στην επιφάνεια του υγρού, ανά μονάδα στοιχειώδους επιφάνειας του υγρού dSi και φυσιολογικά δεν εξισορροπείται για τους λόγους που αναφέρθηκαν.
Εάν όμως, επιφάνεια του υγρού καμπυλωθεί οι δυνάμεις αυτές από την πίεση δεν προσπίπτουν πλέον κάθετα αλλά σε κάθε μια από αυτές προσμετράται η συνιστώσα στο καμπυλωμένο επίπεδο! Η συνιστώσα αυτή είναι μειωμένη ανάλωγα με την γωνία πρόσπτωσης. Η συνολική δύναμη που δέχεται η επιφάνεια γίνεται μικρότερη κι έτσι η πίεση εξισορροπείται.
Σύμφωνα με αυτήν ο υπολογίζεται η επιφανειακή τάση ορισμός της επιφανειακής τάσης είναι: Επιφανειακή τάση επιφάνειας υγρού είναι η δύναμη που ασκείται ανά μονάδα μήκους μιας γραμμής που οριοθετεί την επιφάνεια ενός ρευστού
Οι δυνάμεις αυτές που αναπτύσσονται πάνω στην επιφάνεια ονομάζονται Επιφανειακή Τάση
ΤΟ ΙΞΩΔΕΣ ΚΑΙ Η ΡΕΥΣΤΟΤΗΤΑ
Αυτή η διαφορά της δομής στην επιφάνεια και στο εσωτερικό έχει επίσης σαν αποτέλεσμα την ανεξάτητη ροή υγρού κάτω από μια σταθερή επιφάνεια, υπό ορισμένες συνθήκες, γιατί αυτό στην γενίκευση δίνει μια διαφορά στην ταχύτητα κίνησης μεταξύ διαφόρων στρωμάτων ενός υγρού, λόγω της διαφοράς των δυνάμεων που ασκούνται σε κάθε στρώμα.
Η συνολική μελέτη της ροής ενός υγρού είναι ενα θέμα πολυπλοκότερο.
(νόμος της Ιξώδους ροής)
ΙΣΟΡΡΟΠΙΑ ΥΓΡΟΥ - ΑΤΜΩΝ. ΕΞΑΕΡΩΣΗ -ΤΑΣΗ ΑΤΜΩΝ
Όταν υπάρχει ένα υγρό, παρατηρείται η ταυτόχρονη ύπαρξη και του ατμού του. Αυτό συμβαίνει γιατί μια ποσότητα από το υγρό περνά στην αέρια κατάσταη και αντίστροφα μια ποσότητα ατμού συμπυκνώνεται. Η ποσότητα και η ταχύτητα που συμβαίνουν οι δύο αυτές αντίστροφες κινήσεις εξαρτώνται από τις περιβαλλοντικές συνθήκες (Πίεση και θερμοκρασία) και λέμε ότι βρίσκονται σε Θερμοδυναμική Ισορροπία όταν εξισώνονται οι δύο αυτές ταχύτητες.
Όταν επικρατεί η διαφυγή μορίων υγρού στην αέρια κατάσταση τότε συμβαίνει ποσοτικά, Εξαέρωση του Υγρού. Όταν επικρατεί το αντίστροφο τότε έχουμε Υγροποίηση Ατμού
Εξαέρωση λέμε την μετάβαση του σώματος από την Υγρή στην Αέρια κατάσταση που γίνεται με την Εξάτμιση και τον βρασμό
Οι ατμοί πάνω από το υγρό (κορεσμένων) ασκούν μια επιπλέον πίεση που λέγεται Τάση Ατμών και εξαρτάται από την θερμοκρασία.
Αν η Τάση Ατμών αυξηθεί πάνω από το όριο της Ατμοσφαιρικής Πίεσης, τότε το Υγρό μετατρέπεται μαζικά σε Ατμό και αυτη η θερμοκρασία είναι το Σημείο Ζέσεως και το φαινόμενο λέγεται Ζέση ή Βρασμός
Έτσι, η επιφάνεια υγρών δίνει ενδείξεις που σε ορισμένα θυμίζουν την στερεά κατάσταση
Η μελέτη της επιφάνειας στον Υδράργυρο (το μοναδικό μέταλλο σε υγρή κατάσταση σε θερμοκρασία περιβάλλοντος) δείχνει ότι τα άτομα , λόγω των μεγάλων δυνάμεων που ασκούνται από το εσωτερικό, έχει την ίδια διάταξη - γεωμετρικό σχήμα, όπως στην στερεά κατάσταση και αυτό είναι το κυβικό σύστημα κρυστάλλωσης που κατ' εξαίρεση εμφανίζει ισοτροπία εμφανίζει ισοτρροπία
ΠΗΓΕΣ
ΦΥΣΙΚΗ ΧΗΜΕΙΑ ΚΑΤΑΣΤΑΣΕΩΝ ΤΗΣ ΥΛΗΣ ΚΑΙ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Δ Α ΓΙΑΝΝΑΚΟΥΔΑΚΗ
ΓΕΝΙΚΗ ΧΗΜΕΙΑ ΠΑΥΛΟΥ ΣΑΚΕΛΛΑΡΙΔΗ
Силы Ван-дер-Ваальса - Wikiwand
Τι είναι οι δυνάμεις van der Waals; (greelane.com)
Κατάσταση συνάθροισης - Βικιπαίδεια (wikipedia.org)Κατάσταση συνάθροισης - Βικιπαίδεια (wikipedia.org)
Водомерка и особенности её движения - презентация к уроку Окружающий мир (ppt4web.ru)
배경 화면 : 2730x1536 px, 비, 물방울, 수채화 2730x1536 - CoolWallpapers - 1348913 - 배경 화면 - WallHere
https://nature-health.ru/about/poleznaya-informaciya/propolis/
ΔΙΑΛΥΤΙΚΗ ΙΚΑΝΟΤΗΤΑ

 Η έντονη πολικότητα του νερού δεν κάνει μόνο την συνδεση των πολικών μορίων του μεταξύ τους με μοριακούς δεσμούς υδρογόνου αλλά την δημιουργία αντίστοιχων δεσμών υδρογόνου με μόρια που διαθέτουν άτομα που επίσης δημιουργούν δεσμούς υδρογόνου όπως το Οξυγόνο, το Αζωτο και το Φθόριο.
Η έντονη πολικότητα του νερού δεν κάνει μόνο την συνδεση των πολικών μορίων του μεταξύ τους με μοριακούς δεσμούς υδρογόνου αλλά την δημιουργία αντίστοιχων δεσμών υδρογόνου με μόρια που διαθέτουν άτομα που επίσης δημιουργούν δεσμούς υδρογόνου όπως το Οξυγόνο, το Αζωτο και το Φθόριο.
Ακόμα το νερό κάνει σύνδεση με άλλα πολικά μόρια (όπως αμμωνία, αλκοόλες,οξέα κ.α.) και ιόντα (NaCl) . Για αυτόν τον λόγο αποτελεί έναν εξαιρετικό διαλύτη κυρίως ανοργάνων αλλά και οργανικών ουσιών.

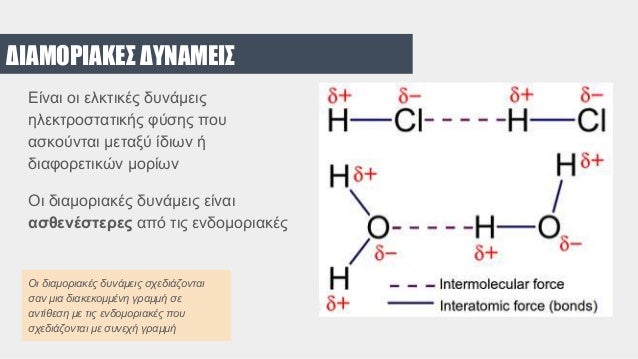
Σε ανάμειξη του νερού με άλλα πολικά μόρια, τα θέτικά τμήματα των μορίων αυτών προσελκύουν άτομα οξυγ

.jpg)
