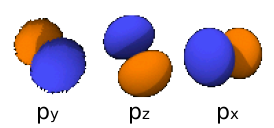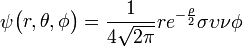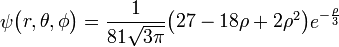Δήμητρα Σπανού, χημικός, μόνιμη καθηγήτρια στο 1ο Γυμνάσιο Δάφνης από το 2010
Οι θεωρία της κυματοειδούς φύσης των ηλεκτρονίων του Schrodinger που δίνουν την χωρική κατανομή του φορτίου του ηλεκτρονίου που θεωρείται σαν ηλεκτρικό κύμα, αλλά και η στατιστκή ερμηνεία του Max Born που δίνει την πιθανότητα να βρίσκεται το ηλεκτρόνιο - σωματίδιο σε διάφορα σημεία του χώρου στον οποίο κινείται, δίνουν μια νέα εικόνα για την δομή του ατόμου αυτήν των ατομικών τροχιακών
Η θεωρία των ατομικών και μοριακών τροχιακών πρότεινε Robert Sanderson Mulliken, το 1932
Η λύση της εξίσωσης Σρέντινγκερ δίνει ένα σύνολο κυματοσυναρτήσεων καθεμιά από τις οποίες αντιστοιχεί σε συγκεκριμένη τιμή ενέργειας του ηλεκτρονίου και αποτελεί το τροχιακό
Όταν ορίσουμε την ενέργεια του ηλεκτρονίου Εn, η επίλυση της εξίσωσης Schrödinger οδηγεί στις κυματοσυναρτήσεις ψ που περιγράφουν την κατάσταση του ατομικού τροχιακού.
Για να γίνει αυτό λαμβάνουμε υπ' όψην μας ότι κάθε ένα από τα ηλεκτρόνια του ατόμου είναι διαφορετικά ορισμένο από τους 4 κβαντικούς αριθμούς και τοποθετείται σε συγκεκριμένης απόσταση από τον πυρήνα που καθορίζεται από την ενέργειά τους και περιγράφεται με αυτούς τους κβαντικούς αριθμούς
Κύριος κβαντικός αριθμός n (1,2,3,4,5,6,7) που προσδιορίζει απόσταση από τον πυρήνα απόσταση από τον πυρήνα του ηλεκτρονίου και ταυτόχρονα της ενέργειας σε ακίνητη κατάσταση Είναι (K/n=1, L/n=2, M/n=3, N/n=4, O/n=5, Q/n=6,
Τον Δευτερεύοντα κβαντικό αριθμο l που προσδιορίζει τις υποστοιβάδες που περιλαμβάνει υποομάδες ηλεκτρονίων (υποστοιβάδες) της κάθε στοιβάδας ανάλογα με τον χώρο κατανομής τους . Δίνει το σχήμα του ηλεκτρονιακού νέφους
Παίρνει τιμές l= 0, 1, 2 ,3, 4, (n-1) . Οι υποστοιβάδες είναι οι s, p, d, f, g,h,i
Ηλεκτρόνια με ίδιο n και l βρίσκονται στην ίδια υποστοιβάδα
Ο μαγνητικός κβαντικός αριθμός ml καθορίζει τον προσανατολισμό του ηλεκτρονιακού νέφους σε σχέση με τους άξονες x, y, z,
δηλαδή, τα επίπεδα που θα κινηθεί το κάθε περιστρεφόμενο ηλεκτρόνιο
Σε κάθε υποστοιβάδα που εμφανίζει λόγω αυτής της περιστροφής του μαγνητική ροπή και μηχανική ροπή λόγω αυτής, που καθορίζεται από τον μαγνητικό αριθμό ml .
Τιμές του μαγνητικού κβαντικού αριθμού αντιστοιχεί στο τροχιακά l. και είναι: -l, ...0...+l
Ο κβαντικός αριθμός ms καθορίζεται από το άθροισμα των διανυσμάτων l και s δηλαδή περιλαμβάνει
την γωνιακή ορμή του ηλεκτρονίου που προκαλείται από την ιδιοπεριστροφή του (ορμή spin). Παίρνει τιμές 1/2 για στροφορμή παράλληλη με το Β του πεδίο και -1/2 για στροφορμή αντιπαράλληλη με το Β του πεδίου
Ηλεκτρόνια με ίδιο n, l, ml βρίσκονται στο ίδιο τροχιακό
τα στοιχεία αυτά εισάγονται στην εξίσωση Schrodinger
μεταφέρω από
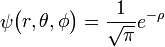 , όπου
, όπου  , με
, με  « ακτίνα Bohr ».
« ακτίνα Bohr ».
-
3px: n=3,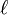 =1:
=1: 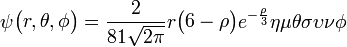 .
. -
3py: n=3,
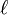 =1:
=1:  .
. -
3pz: n=3,
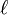 =1:
=1: 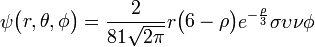
- Αυτά είναι λοιπόν τα ατομικά τροχιακά ή αλλιώς οι τροχαιές όπως τις συνέλαβε αρχικά ο Bohr που δεν είναι βέβαια κυκλικές όμως είναι κοντά στην ιδέα που είχαν τότε. Βέβαια εφ όσον τα τροχιακά προκύπτουν από πιο πολύπλοκες εξισώσεις, δεν έχουν το σχήμα που πρότειναν τότε το 1913, όμως η ιδέα τους ήταν γενικά σωστή ώστε τελειοποιήθηκε αργότερα
υπό κατασκευή
ковалентная геометрия водных связей
- Κάθε ηλεκτρόνιο του ατόμου είναι εντελώς καθορισμένο
και πρέπει ένας τουλάχιστον από τους 4 κβαντικούς αριθμούς του να είναι διαφορετικός
- Ο αριθμός των ηλεκτρονίων στους φλοιούς (στοιβάδες) πρέπει να είναι από ένα έως 2n2.
- Αν σε έναν εξωτερικό φλοιό (κέλυφος) ο αριθμός των ηλεκτρονίων φτάσει την οριακή τιμή το κέλυφος γεμίζει και αρχίζει να σχηματίζεται ένα νέο κέλυφος.
- Κάθε ένα από τα ατομικά τροχιακά της κάθε στοιβάδων συμπληρώνεται ανάλογα: με 2 ηλεκτρόνια(s υποστοιβάδα) 6 ηλεκτρόνια(p υποστοιβάδα), 10 ηλεκτρόνια(d υποστοιβάδα), κ.λ.π Τα ατομικά τροχιακά μιας υποστοιβάδας έχουν ίδιο κύριο και δευτερεύοντα κβαντικό αριθμό
 Η υποστοιβάδα s διαθέτει ένα μόνο επίπεδο περιστροφής και συμπληρώνεται με δύο ηλεκτρόνια.
Η υποστοιβάδα s διαθέτει ένα μόνο επίπεδο περιστροφής και συμπληρώνεται με δύο ηλεκτρόνια.
Η υποστοιβάδα p διαθέτει τρία επίπεδα περιστροφής τα x, y, z και συμπληρώνεται με 2x3=6 ηλεκτρόνια.
Η υποστοιβάδα d διαθέτει πέντε επίπεδα περιστροφής και συμπληρώνεται με 2x5=10 ηλεκτρόνια.
ΠΗΓΕΣ
https://infotables.ru/khimiya/825-elektronnye-formuly-atomov-khimicheskikh-elementov
Ατομικά τροχιακά και κβαντικοί αριθμοί – Η ηλεκτρονική τάξη Χημείας (sch.gr)
6.1 Τροχιακό-κβαντικοί αριθμοί (ebooks.edu.gr)
https://infotables.ru/khimiya/825-elektronnye-formuly-atomov-khimicheskikh-elementov
Ηλεκτρονική δομή - Βικιπαίδεια (wikipedia.org)
ακατέργαστο
https://www.tovima.gr/2014/02/28/science/biryllio-elafry-glyko-kai-epikindyno/
Τα εργαλεία από βηρύλλιο παρουσιάζουν πλεονέκτημα σε εγκαταστάσεις με ισχυρά μαγνητικά πεδία γιατί μαγνητίζονται δύσκολα
Be μαγνητική ροπή -1,174
κάτι που το καθιστά το μακροβιότερο σήμερα ραδιο-ισότοπο.
Επειδή μια από τις ιδιότητές του είναι το να μην απορροφά νετρόνια χρησιμοποιείται σε ερευνητικούς πυρηνικούς αντιδραστήρες αλλά και σε πυρηνικές κεφαλές. Στα πυρηνικά όπλα κλείνουν την όλη διάταξη σε ένα περίβλημα από βηρύλλιο και εξασφαλίζουν το να μη διαρρέουν τα νετρόνια και μειώνεται η ισχύς της πυρηνικής κεφαλής.
ήλιον μαγνητική ροπή -2,12
Το ήλιο χρησιμοποιείται στην κρυογενική (είναι η μεγαλύτερη χρήση του, που καταναλώνει περίπου το ¼ της παραγωγής του) και στην ψύξη μαγνητών υπεραγωγιμότητας, με ειδικότερη εμπορική εφαρμογή τούς σαρωτές MRI.
Τα ηλεκτρόνια στο άτομο τοποθετούνται σε τροχαιές βάσει της ενέργειάς τους με σειρά από τις τροχαιές μικρότερης ενέργειας προς τις τροχαιές μεγαλύτερης ενέργειας.
Δεδομένου ότι, κάθε τροχαιά του ατόμου συμπληρώνεται με δύο ηλεκτρόνια που κινούνται σε αντίθετες κατευθύνσεις, εάν η τροχαιά είναι συμπληρωμένη, το αλγευρικό άθροισμα των ροπών των δύο ηλεκτρονίων είναι μηδέν
Προφανώς, μια συμπληρωμένη τροχαιά δεν συνεισφέρει στην ολική ροπή του ατόμου (πράγμα επιθυμητό για την συνολική του ευστάθεια)
-
3px: n=3,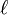 =1:
=1: 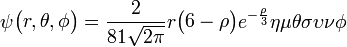 .
. -
3py: n=3,
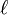 =1:
=1:  .
. -
3pz: n=3,
 =1:
=1: 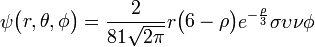
- Αυτά είναι λοιπόν τα ατομικά τροχιακά ή αλλιώς οι τροχαιές όπως τις συνέλαβε αρχικά ο Bohr που δεν είναι βέβαια κυκλικές όμως είναι κοντά στην ιδέα που είχαν τότε. Βέβαια εφ όσον τα τροχιακά προκύπτουν από πιο πολύπλοκες εξισώσεις, δεν έχουν το σχήμα που πρότειναν τότε το 1913, όμως η ιδέα τους ήταν γενικά σωστή ώστε τελειοποιήθηκε αργότερα



 .
. 
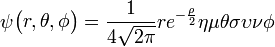 .
.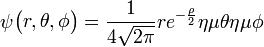 .
.