Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
Η ΑΠΟΣΤΑΣΗ ΤΩΝ ΗΛΕΚΤΡΟΝΙΩΝ ΑΠΟ ΤΟΝ ΠΥΡΗΝΑ ΚΑΙ Ο ΑΤΟΜΙΚΟΣ ΑΡΙΘΜΟΣ
ΔΙΑΜΟΡΦΩΝΟΥΝ ΤΙΣ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ
Οι ιδιότητες των Χημικών στοιχείων, εξαρτώνται από πολλούς παράγοντες: την απόσταση από τον πυρήνα, τον ατομικο αριθμό , την ατομική ακτίνα, την περιόδο που ανήκουν, και την ομάδα που εντάσσονται

Τα αρνητικά ηλεκτρόνια τού ατόμου έλκονται από τον θετικό πυρήνα με δυνάμεις ηλεκτροστατικής φύσεως που αυξάνουν με την αύξηση του ατομικού αριθμού Ζ αλλά και στην περίπτωση ηλεκτρονίων για την ίδια στοιβάδα, με την προσθήκη επι πλέον ηλεκτρονίων στην στοιβάδα εμφανίζονται απωστικές δυνάμεις μεταξύ των ομόνυμα φορτισμένων ηλεκτρονίων- ( ηλεκτραρνητικότητα). Επίσης με την αύξηση της ελκτικής δύναμης του πυρήνα μειώνεται η απόστασης των ηλεκτρονίων από τον πυρήνα γιατί με την αύξηση αριθμού της περιόδου, εχουμε αύξηση της ατομικής ακτίνα - εξωτερικής στοιβάδας
Η Ηλεκτρική Δυναμική ενέργεια μεταξύ πυρήνα και ηλεκτρονίου είναι αρνητική ώστε, για να απομακρύνουμε ηλεκτρόνιο από την επίδραση του πυρήνα πρέπει να δώσουμε ενέργεια
Ο ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ

| Τακτικός αριθμός | Σύμβολο | Όνομα | Κατηγορία στοιχείου | Κατάσταση της ύλης | Διαμόρφωση ηλεκτρονίων |
|---|---|---|---|---|---|
| 19 | K | Κάλιο | Αλκαλικά μέταλλα | σταθερός | [Ar] 4Σ1 |
| 20 | Γα | Ασβέστιο | Μέταλλα αλκαλικών γαιών | σταθερός | [Ar] 4s2 |
| 21 | Sc | Σκάνδιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ1 4s2 |
| 22 | Τι | Τιτάνιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ 2 4s2 |
| 23 | V | Βανάδιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ3 4s2 |
| 24 | Cr | Χρώμιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d5 4s1 |
| 25 | Μν | Μαγγάνιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ5 4s2 |
| 26 | Φε | Σίδηρος | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d6 4s2 |
| 27 | Σία | Κοβάλτιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d7 4s2 |
| 28 | Νι | Νικέλιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d8 4s2 |
| 29 | Cu | Χαλκός | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d10 4s1 |
| 30 | Zn | Ψευδάργυρος | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d10 4s2 |
| 31 | Γα | Γάλλιο | Διάφορα μέταλλα | σταθερός | [Ar] 3d10 4s2 4p1 |
| 32 | Γε | Γερμάνιο | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s 2 4p2 |
| 33 | Άσσος | Αρσενικό | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s2 4p3 |
| 34 | Να | Σελήνιο | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s2 4p4 |
| 35 | ΜΒ | Βρώμιο | Αλόγονα | υγρό | [Ar] 3d10 4s2 4p5 |
| 36 | Κρ | Κρυπτό | Ευγενή αέρια | αεριώδης | [Ar] 3d10 4s2 4p6 |
ΟΙ ΟΜΑΔΕΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΥ ΠΙΝΑΚΑ
Οι κάθετες στήλες στον περιοδικό πίνακα ονομάζονται Ομάδες και περιλαμβάνουν στοιχεία με ιδιο αριθμό ηλεκτρονίων σθένους. Οι υποομάδες χωρίζονται σε 8 υποομάδες Α (1η, 2η, 13η έως 18η) και 10 υποομάδες Β που περιέχουν στοιχεία που διαθέτουν ηλεκτρόνια στην d υποστοιβάδα
Ομάδα 1 (ΙΑ) Ομάδα των Αλκαλίων (μέταλλα)
Ομάδα 2 (ΙΙΑ) Ομάδα των Αλκαλικών γαιών (μέταλλα)
Ομάδα 3 (ΙΙΙΒ, ΙΙΙΑ) Υποομάδα του Σκάνδιου
Ομάδα 4 (ΙVΒ, IVΑ) Υποομάδα του Τιτάνιου (Ζιρκόνιο, Άφνιο Ρουδερφόρδιο)
Ομάδα 5 (VΒ, VΑ) Υποομάδα του Βανάδιου (Βανάδιο V, Νιόβιο Nb. Ταντάλιο Ta)
Ομάδα 6 (VIΒ, VIΑ) Υποομάδα του Χρώμιου (Μολυβδαίνιο Mo, Βολφράμιο W , Σιμπόργκιο Sg)
Ομάδα 7 (VIIB, VIIA) Yποομάδα του Μαγγάνιου ( Μn Τεχνήτιο Tc, Ρήνιο Re)
Ομάδα 8 (VIIIB, VIIIA) Yποομάδα του Σίδηρου (Ρουθήνιο Ru, Οσμιο Os)
Ομάδα 9 (VIIIc, VIIIA) Υποομάδα του Κοβάλτιου (Rόδιο Rh, Ιρίδιο Ir)
Ομάδα 10 (VIIIB, VIIIA) Υποομάδα του Νικέλιου
Ομάδα 11 (IB, IB) Υποομάδα του Χαλκού
Ομάδα 12 (IIB, IIB) Yποομάδα του Ψευδάργυρου (Κάδμιο Cd Υδράργυρο Hg)
Oμάδας 13 ( ΙΙΙΑ IIIB) Υποομάδα του Βόριου (Αλλουμίνιουμ Al, Γάλλιο Ga, Ίνδιο In, Θάλλιο Tl, Νιχόνιο Νh)
Ομάδα 14 (IVA, IVB) Υποομάδα του Άνθρακα ( Πυρίτιο Si, Γερμάνιο Ge, Κασσίτερος Sn, Μόλυβδος Mo, Φλερόβιο Fl )
Ομάδα 15 (VΑ, VΒ) Υποομάδα του Αζώτου
Ομάδα 16 (VΙΑ, VΙΒ) Υποομάδα του Οξυγόνου
Ομάδα 17 (VΙΙΑ, VΙΙΒ) Αλογόνα
Ομάδα 18 (VΙΙΙΑ, VΙΙΙΒ) Ευγενή Αέρια
ΜΕΤΑΒΟΛΕΣ ΣΤΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ .
ΜΙΑΣ ΟΜΑΔΑΣ ΑΠΟ ΠΑΝΩ ΠΡΟΣ ΤΑ ΚΑΤΩ
Στις ίδιες ομάδες ενώ εξωτερική στοιβάδα παραμένουν τα ίδια ηλεκτρόνια σθένους, όμως προχωρόντας προς τα κάτω αυξάνεται ο αριθμός των ηλεκτρονικών στοιβάδων και επομένως και η ακτίνα τους αυξάνεται και η ηλεκτραρνητικότητα μειώνεται οπότε, οι μεταλλικές τους ιδιότητες φαίνονται αυξημένες αφού τα εξωτερικά ηλεκτρόνια απομακρύνονται ευκολότερα
Σε μια ομάδα Χημικών Στοιχείων του Περιοδικού Πίνακα, ο αριθμός των κελυφών (ηλεκτρονιακών στοιβάδων) αυξάνεται από πάνω προς τα κάτω, ενώ, ο αριθμός ηλεκτρονίων σθένους είναι ίδιος.
Όσο τα κελύφη αυξάνονται η απόσταση των ηλεκτρονίων σθένους από τον πυρήνα (ατομική ακτίνα) μεγαλώνει

και συνεπώς,
η ελκτική δύναμη του πυρήνα μειώνεται. Ένας επιπλέον λόγος για τη μείωση της ελκτικής δύναμης του πυρήνα είναι, η επίδραση των ηλεκτρονίων των εσωτερικών στοιβάδων στα ηλεκτρόνια σθένους.
η ενέργεια ιοντισμού σε μια ομάδα, μειώνεται από πάνω προς τα κάτω λόγω της μείωσης της έλξης του πυρήνα
η ηλεκτραρνητικότητα που αυξάνει με το πυρηνικό φορτίου και ελαττώνεται με την απόσταση των ηλεκτρονίων σθένους από τον πυρήνα (ατομική ακτίνα) ελαττώνεται συνολικά στις ομάδες από πάνω προς τα κάτω.
ΟΙ ΤΟΜΕΙΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ

Σε κάθε τομέα του περιοδικού πίνακα τα χημικά στοιχέια που περιέχει έχουν τα τελευταία τους ηλεκτρόνια στον ίδιο τύπο υποστοιβάδας s, p, d, f
Οι τομείς που υπάρχουν είναι:
Τομέας s: Περιλαμβάνει τις δύο πρώτες ομάδες 1 και 2 ή ΙΑ και ΙΙΑ δηλαδή των Αλκαλίων ( Li, Na, K, ...) και των Αλκαλικών Γαιών (Ca, Mg, ...) με 1 ή 2 ηλεκτρόνια

Τομέας p: Περιλαμβάνει τις 6 κύριες ομάδες του περιοδικού πίνακα δηλαδή την 13 ή ΙΙΙΑ, την 14 ή IVΑ, 15 ή VΑ, 16 ή VIΑ, 17 ή VIIΑ, 18 ή VIIIΑ με 1, 2, 3, 4, 5, 6 ηλεκτρόνια
Τομέας d: Περιλαμβάνει στοιχεία που το τελευταίο ηλεκτρόνιό τους τοποθετείται στην υποστοιβάδα p . Περιλαμβάνει τα στοιχεία μετάπτωσης των ομάδων 3 ή IIIB 4 ή IVB, 5 ή VB, 6 ήVIB, 7 ή VIIB, 8, 9, 10 ή VIIIB, 11 ή IB, 12 ή IIB . Η υποστοιβάδα χωράει 10 ηλεκτρόνια και έτσι ο τομέας περιλαμβάνει 10 ομάδες που είναι τα στοιχεία μεταπτώσεως
Τομέας f : Περιλαμβάνει στοιχεία που το τελευταίο ηλεκτρόνιό τους τοποθετείται στην υποστοιβάδα f. Η υποστοιβάδα χωράει 14 ηλεκτρόνια και έτσι ο τομέας περιλαμβάνει 14 ομάδες που είναι οι λανθανίδες που ανήκουν στην 6η περίοδο με ηλεκτρόνια 6s2 και με 14 στοιχεία με ατομικούς αριθμους 58-71 που τοποθετουνται διαδοχικά στην υποστοιβάδα 4f και οι ακτινίδες με με ηλεκτρόνια 6s2 και με 14 στοιχεία με ατομικούς αριθμους 90-103 που τοποθετουνται διαδοχικά στην υποστοιβάδα 5f
ΣΕΙΡΑ ΣΥΜΠΛΗΡΩΣΗΣ ΤΡΟΧΙΑΚΩΝ

Χημικά στοιχεία της τέταρτης περιόδου - Βικιπαίδεια (wikipedia.org)
ΠΗΓΕΣ
6.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης (ebooks.edu.gr)
Rastafari: Μάρτιος 2013 (commander-ikarus.blogspot.com)
6.3 Δομή περιοδικού πίνακα (τομείς s, p, d, f) - στοιχεία μετάπτωσης (ebooks.edu.gr)
| Τακτικός αριθμός | Σύμβολο | Όνομα | Κατηγορία στοιχείου | Κατάσταση της ύλης | Διαμόρφωση ηλεκτρονίων |
|---|---|---|---|---|---|
| 19 | K | Κάλιο | Αλκαλικά μέταλλα | σταθερός | [Ar] 4Σ1 |
| 20 | Γα | Ασβέστιο | Μέταλλα αλκαλικών γαιών | σταθερός | [Ar] 4s2 |
| 21 | Sc | Σκάνδιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ1 4s2 |
| 22 | Τι | Τιτάνιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ 2 4s2 |
| 23 | V | Βανάδιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ3 4s2 |
| 24 | Cr | Χρώμιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d5 4s1 |
| 25 | Μν | Μαγγάνιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3δ5 4s2 |
| 26 | Φε | Σίδηρος | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d6 4s2 |
| 27 | Σία | Κοβάλτιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d7 4s2 |
| 28 | Νι | Νικέλιο | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d8 4s2 |
| 29 | Cu | Χαλκός | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d10 4s1 |
| 30 | Zn | Ψευδάργυρος | Μεταβατικά μέταλλα | σταθερός | [Ar] 3d10 4s2 |
| 31 | Γα | Γάλλιο | Διάφορα μέταλλα | σταθερός | [Ar] 3d10 4s2 4p1 |
| 32 | Γε | Γερμάνιο | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s 2 4p2 |
| 33 | Άσσος | Αρσενικό | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s2 4p3 |
| 34 | Να | Σελήνιο | Ημιμέταλλα | σταθερός | [Ar] 3d10 4s2 4p4 |
| 35 | ΜΒ | Βρώμιο | Αλόγονα | υγρό | [Ar] 3d10 4s2 4p5 |
| 36 | Κρ | Κρυπτό | Ευγενή αέρια | αεριώδης | [Ar] 3d10 4s2 4p6 |

 α. μείωση της ατομικής ακτίνας .
α. μείωση της ατομικής ακτίνας ..gif) έλξη από τον πυρήνα.
έλξη από τον πυρήνα..png) ενέργειας που απαιτείται για την απομάκρυνση ηλεκτρονίου από το άτομο ( για τον ίδιο λόγο, η έλξη από τον πυρήνα είναι αυξημένη)
ενέργειας που απαιτείται για την απομάκρυνση ηλεκτρονίου από το άτομο ( για τον ίδιο λόγο, η έλξη από τον πυρήνα είναι αυξημένη)
 Στην ομάδα των αλκαλίων και αλκαλικών γαιών η ηλεκτρική Δυναμική ενέργεια των
Στην ομάδα των αλκαλίων και αλκαλικών γαιών η ηλεκτρική Δυναμική ενέργεια των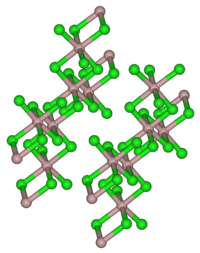
 ομοιοπολικός χαρακτήρας και σχηματίζει διμερή που είναι ομοιοπολικής δομής . Επίσης για τον ίδιο λόγο δεν εμφανίζει αγωγιμότητα στον ηλεκτρισμό.
ομοιοπολικός χαρακτήρας και σχηματίζει διμερή που είναι ομοιοπολικής δομής . Επίσης για τον ίδιο λόγο δεν εμφανίζει αγωγιμότητα στον ηλεκτρισμό.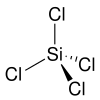


.jpg)