Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ

Μεταβατικά μέταλλα τομέα d ή Στοιχεία μεταπτώσεως
Είναι τα χημικά στοιχεία μεταξύ των κύριων ομάδων ΙΙΑ και ΙΙΙΑ τα οποία διαθέτουν ηλεκτρόνια σε περισσότερες από μία ενεργειακές στοιβάδες
Πρόκειται για 24 μεταλλικά στοιχεία α είναι του τομέα d, 4ης περιόδου ατομικών αριθμών 21-30 , 5ης περιόδου ατομικοών αριθμών 39-48, 6ης περιόδου ατομικοών αριθμών 57-80, 7ης περιόδου ατομικών αριθμών 89-112
Ο τομέας d περιλαμβάνει τις υποομάδες 3 ή IIIB 4 ή IVB, 5 ή VB, 6 ήVIB, 7 ή VIIB, 8, 9, 10 ή VIIIB, 11 ή IB, 12 ή IIB
 Τα στοιχεία αυτά βρίσκονται σε δευτερεύουσες ομάδες του περιοδικού πίνακα γιατί ενώ συμπληρώνουν τις στοιβάδες ηλεκτρονίων έως την s (με 1 ή 2 ηλεκτρόνια) τοποθετούν τα επόμενα ηλεκτρόνια τους στην d υποστοιβάδα της προηγούμενης στοιβάδας τους.
Τα στοιχεία αυτά βρίσκονται σε δευτερεύουσες ομάδες του περιοδικού πίνακα γιατί ενώ συμπληρώνουν τις στοιβάδες ηλεκτρονίων έως την s (με 1 ή 2 ηλεκτρόνια) τοποθετούν τα επόμενα ηλεκτρόνια τους στην d υποστοιβάδα της προηγούμενης στοιβάδας τους.
γιατί, τα s τροχιακά στα στοιχεία του d τομέα, βρίσκονται σε χαμηλότερη ενεργειακή κατάσταση από τα ηλεκτρόνια της d υποστοιβάδας της προηγούμενης ηλεκτρονικής στοιβάδας.
Οξειδωτική συμπεριφορά
Επομένως στην στοιβάδα σθένους τα μεταβατικά μέταλλα έχουν ηλεκτρόνια της υποστοιβάδας s και της προηγούμενης υποστοιβάδας d. Na σημειώσουμε πως, τα ηλεκτρόνια της εξωτερικής στοιβάδας μπορούν να συζευχθούν ή να αποσυζευχθούν. Αυτό έχει σαν συνέπεια τα στοιχεία μεταπτώσεως να μπορούν να δίνουν πολλούς βαθμούς οξείδωσης
- Τα στοιχεία μετάπτωσης μπορούν να δώσουν έως οκτώ ηλεκτρόνια και μπορούν να έχουν πολλούς αριθμούς οξείδωσης

- Έχουν μεταβλητούς αριθμούς οξείδωσης . Σε χαμηλές βαθμούς οξείδωσης, εμφανίζονται ως ιόντα και είναι αναγωγικοί παράγοντες για παράδειγμα τα +2 ιόντα.
 Σε ενδιάμεσους βαθμούς οξείδωσης π.χ. +3 γίνονται πιο σταθερά και όταν εμφανίζονται με υψηλούς βαθμούς οξείδωσης συνηθως συνδέονται ομοιοπολικά και είναι καλοί οξειδωτικοί παράγοντες
Σε ενδιάμεσους βαθμούς οξείδωσης π.χ. +3 γίνονται πιο σταθερά και όταν εμφανίζονται με υψηλούς βαθμούς οξείδωσης συνηθως συνδέονται ομοιοπολικά και είναι καλοί οξειδωτικοί παράγοντες
Έτσι τα στοιχεία μεταπτώσεως έχουν μικρές τιμές ηλεκτραρνητικότητας και κατατάσσονται στα μέταλλα.
Τα στοιχεία μεταπτώσεως έχουν γραμμικά αυξανόμενες ενέργειες ιονισμού μεταξύ των s εξωτερικης υποστοιβάδας και της προηγούμενης d υποστοιβάδας. Έτσι μπορούν να εμφανίζουν υψηλούς βαθμούς οξείδωσης
Ο αριθμός των καταστάσεων οξείδωσης αυξάνει έως περίπου τα στοιχεία που βρίσκονται στο κέντρο του τομέα 7ης (VIIB) και 8ης ομάδας δηλαδή Mn, Ru, Οs και στην συνέχεια μειώνεται λόγω αυξημένης έλξης από τον πυρήνα.
Μεταλλική συμπεριφορά
- Τα στοιχεία μετάπτωσης έχουν ενισχυμένες μεταλλικές ιδιότητες όπως πυκνότητα, σημεία τήξης, βρασμού, ικανότητα εφελκυσμου κ.λ.π. Αυτο οφείλεται στο ότι ηλεκτρόνια της d υποστοιβάδας, πάντα της προηγούμενης στοιβάδας, μετατοπίζονται άμεσα στο μεταλλικό πλέγμα και ενισχύουν έτσι τις μεταλλικές ιδιότητες.
Λόγω της μερικής συμπήρωσης της εσωτερικής υποστοιβάδας d μπορούν να συμβούν μη συζευγμένα σπιν ηλεκτρονίων με αποτέλεσμα τα στοιχεία μετάπτωσης να εμφανίζουν παραμαγνητικές, σιδηρομαγνητικές ή αντισιδηρομαγνητικές συμπεριφορές
Εμφάνιση εγχρώμων ιόντων και σύμπλοκων
- Σχηματίζουν πολλά διαφορετικά χρωματιστά ιοντα και σύμπλοκα , να δίνουν έγχρωμες χημικές ενώσεις,
Τα χρώματα διαφέρουν ακόμα και στο ίδιο στοιχείο ανάλογα με τον βαθμό οξείδωσής του π.χ. K2Cr2O7 είναι πορτοκαλί ενώ K2CrO4 είναι κίτρινο
ΠΟΥ ΟΦΕΙΛΟΝΤΑΙ ΤΑ ΧΡΩΜΑΤΑ ΣΕ ΙΟΝΤΑ ΚΑΙ ΣΥΜΠΛΟΚΑ
Τα στοιχεία μεταπτώσεως έχουν πολλούς αριθμούς οξείδωσης που οφείλονται πάντα στην συμμετοχή κάποιου διαφορετικού αριθμού ηλεκτρονίων στη οξειδωτική ικανότητα του στοιχείου.

Αριθμός ηλεκτρονίων των στοιβάδων d των ατόμων των μεταβατικών στοιχείων, συζευγνυνται και αποσυζευγνυνται και έτσι συμμετέχουν σε κάποιες βαθμίδες οξείδωσης πολλές φορές διαφορετικές.
Αν απορροφήσουν ακτινοβολία ανεβαίνουν σε καταστάσεις αυξημένης οξείδωσης Π.χ. Mn+2 <-> Mn+3
Αν όμως αυτές δεν είναι οι σταθερές καταστάσεις στις συγκεκριμένες συνθήκες, και σύμφωνα με τους φυσικούς νόμους τα μόρια προσπαθούν να επανέλθουν με κάποιους τρόπους στην αρχική τους ηρεμία ή τέλος πάντων σε κάποια άλλου τύπου κατάσταση ηρεμίας ώστε η ύλη να είναι όσο γίνεται σταθερότερη, αποβάλλοντας την επιπλέον ενέργεια με τη μορφή ηλεκτρομαγνητικής ακτινοβολίας.
Οι διαφορετικές βαθμίδες οξείδωσης έχουν συνήθως τέτοια ενεργειακή διαφορά μεταξύ τους ώστε
Η συχνότητα αυτής της ακτινοβολίας βρίσκεται συνήθως στο φάσμα του ορατού φωτός.
Ας δούμε κάποια παραδείγματα έγχρωμων συμπλόκων:
Το κυανούν του Βερολίνου Fe3[Fe(CN)6]2 (CN)6.svg/200px-Fe(II)(CN)6.svg.png)
 -που είναι μια από τις πρώτες συνθετικές βαφές και παρασκευάστηκε για πρώτη φορά το 1709.
-που είναι μια από τις πρώτες συνθετικές βαφές και παρασκευάστηκε για πρώτη φορά το 1709.
και το Fe4[Fe(CN)6]3 9 "κυανούν του Turnbull" 
η ισορροπία σιδηροκυανιούχα 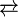 σιδηρικυανιούχα : [Fe(CN)6]4−
σιδηρικυανιούχα : [Fe(CN)6]4− 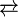 [Fe(CN)6]3− + e−
[Fe(CN)6]3− + e−
Ένυδρο K4[Fe(CN)6]•3H2O. κίτρινο
Οι πιο πολλές ακτινοβολίες δεν είναι ορατες . Υπάρχουν τώρα κάποιες ουσίες που με ιδιαίτερες μοριακές δομές που, για να είναι πιο σταθερές δημιουργούν με κατάλληλη διευθέτηση των ηλεκτρονίων τους, νέες στάθμες Ενέργειας των μορίων τους. Αυτές οι στάθμες που βρίσκονται ανάμεσα στις βασικές στάθμες και οι ενεργειακές καταστάσες λέγονται καταστάσεις μεσομέρειας.
Έτσι όταν διεγείρονται υπάρχει μια ενδιάμεση ενεργειακή στάθμη, με λιγότερη διαφορά ενέργειας από την αμέσως επόμενη.
Ώστε όταν μεταπηδούν στην επόμενη στάθμη, η ενέργεια που απορροφούν αλλά και η ίδια που εκπέμπουν είναι λιγότερη. Δηλαδή ελαττώνεται η διαφορά ενέργειας μεταξύ των δυο ενεργειακών στοιβάδων ορισμένων ηλεκτρονίων .
Κι επειδή η συχνότητα μιας ακτινοβολίας είναι ανάλογη με την ενέργειά της οι συχνότητες είναι μικρότερες κια πολλές φορές "πέφτουν " μέσα στο φάσμα του ορατού φωτός κοντά στο μπλε ή το κόκκινο ή το κίτρινο ή το πράσινο κι έτσι εμείς που το μάτι μας δέχεται αυτές τις συχνότητες τις κατάλληλες που θα διεγείρουν την ροδοψίνη (γιατί αυτό σημαίνει ορατό φως, αυτό κάνει το ορατό φως, μπορεί να απορροφηθεί από την ροδοψίνη και να της αλλάξει σχήμα Κ.λ.π.
Ιδιαιτερότητες και εξαιρέσεις
Υποομάδα ΙΒ (χαλκού): Στοιχείων που έχουν στην τελική s, 1 ηλεκτρόνιο
Τα στοιχεία της ΙΒ που δεν έχουν συμπληρωμένη την s υποστοιβάδα. Αυτό φαίνεται γιατί ένα ηλεκτρόνιο από τα 2 της τελικής s υποστοιβάδας έχει μεταπηδήσει στην προηγούμενη d. (άλμα ηλεκτρονίου). Αυτο δίνει στην ΙΒ μεγαλη σταθερότητα
Χαλκός Αριθμοί οξείδωσης: 0, +1, +2 [Ar] 3d10 4s1
Άργυρος Αριθμοί οξείδωσης: 0, +1, +3 [Kr] 4d10 5s1
Χρυσός. Αριθμοί οξείδωσης: 0, +1, +3, +5 [Xe] 4f14 5d10 6s1
Σύμφωνα με τον ορισμό JUPAK τα μέταλλα μετάβασης είναι στοιχεία που δεν έχουν την υποστοιβάδα d ή με μορφή ιόντων
που δεν έχουν συμπληρωμένη την υποστοιβάδα d .
Εξαιρέσεις από τα μέταλα μεταπτώσεως
Από τα στοιχεία του τομέα d εξαιρούνται και δεν περιλαμβάνονται στα μέταλλα μετάπτωσης
Υποομάδα ΙΙΙΒ (ομάδα Σκάνδιου) Στοιχεία με 1 ηλεκτρόνιο στην μέσα υποστοιβάδα d .
Ιόντα +3 χωρίς ηλεκτρόνια στην μέσα d

Τα στοιχεία της υποστοιβάδας ΙΙΙΒ που, ενώ έχουν συμπληρώσει με 2 ηλεκτρόνια την εξωτερική s υποστοιβάδα και έχουν 1 ηλεκτρόνιο στην μέσα d , οι βαθμοί οξείδωσής τους στις χημικές ενώσεις που είναι το 0, +3
4η περίοδος Σκάνδιο αριθμός οξείδωσης 0, +3 ηλεκτρονιακή διαμόρφωση: [3d1 4s2 ]
5η περίοδος Υπτιο: αριθμός οξείδωσης 0, +3 ηλεκτρονιακή διαμόρφωση: [Kr] 4d15s2
6η περίοδος: Λανθάνιο: αριθμός οξείδωσης 0, +3 ηλεκτρονιακή διαμόρφωση: [ Xe ] 5d1 6s2
Έτσι τα ιόντα Sc+3 , Y+3, La+3, δεν έχουν ηλεκτρόνια στην d υποστοιβάδα άρα δεν ορίζονται σαν στοιχεία μεταπτώσεως σύμφωνα με JUPAK
Τα στοιχεία αυτά ακολουθούν τις ιδιότητες των ακτινίδων
Υποομάδα ΙΙΒ (ομάδα ψευδάργυρου)
Στοιχεία με 10 ηλεκτρόνιο στην μέσα υποστοιβάδα d . (συμπληρωμένη). 1 αριθμός οξείδωσης
Τα στοιχεία της υποστοιβάδα 12 ή ΙΙΒ που έχει συμπληρώσει την υποστοιβάδα d με 10 ηλεκτρόνια και έχουν μόνο έναν αριθμό οξείδωσης το +2.
4η περίοδος :Ψευδάργυρος [ Ar ] 3d10 4s2
5η περίοδος: Κάδμιο [Kr] 5s2 4d10
6η περίοδος:Υδράργυρος [Xe] 4f14 5d10 6s2
δεν συμπεριλαμβάνονται πρακτικά στα στοιχεία μεταπτώσεως
Η μεγάλη συμετοχή τους σε βιολογικά συστήματα
Ο Σίδηρος είναι η βασική ουσία της αιμοσφαιρίνης για την μεταφορά του οξυγόνου στα κύτταρα.
Ο Ψευδάργυρος εμπλέκεται στην παραγωγή ινσουλίνης
Το Κοβάλτιο είναι το κέντρο της βιταμίνης Β12
Ο Χαλκός, το Μαγγάνιο και το Μολυβδένιο αποτελούν μέρος των ενζύμων
Ακόμα αν ηλεκτρόνια σθένους είναι στην f υποστοιβάδα (για λανθανίδες και ακτινίδες) μαζύ είναι και αυτά της μεθεπόμενη s ενεργειακής στοιβάδας, δηλαδή έχουν ηλεκτρόνια σθένους σε περισσότερες από μια ενεργειακές στοιβάδες.
Εδώ ακόμα εξετάζονται και τα τεχνητά υπερουράνια στοιχεία
Τα στοιχεία μεταπτώσεως έχουν μεταβλητούς αριθμούς οξείδωσης
Τιτάνιο κυριότεροι αριθμοί οξείδωσης +4, +3 [Ar] 3d2 4s2
Πρόκειται για 24 στοιχεία μεταπτώσεως ομάδας d που έχουν εξωτερική s υποστοιβάδα συμπληρωμένη με 2 ηλεκρτόνια
PHGES
Γερμάνιο στους Μολάους, Γάλλιο, Σκάνδιο από Mytilineos… ΘΗΣΑΥΡΟΣ | Defence-point.gr
Μεταβατικά μέταλλα - Βικιπαίδεια (wikipedia.org)
Μεταβατικά μέταλλα - Βικιπαίδεια (wikipedia.org)
Διαμόρφωση ηλεκτρονίων ατόμων και ιόντων (testirovaniem.ru)
Τα στοιχεία μεταπτώσεως έχουν μεταβλητούς αριθμούς οξείδωσης
Τιτάνιο κυριότεροι αριθμοί οξείδωσης +4, +3 [Ar] 3d2 4s2
Πρόκειται για 24 στοιχεία μεταπτώσεως ομάδας d που έχουν εξωτερική s υποστοιβάδα συμπληρωμένη με 2 ηλεκρτόνια

