Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
Τι είναι βάσεις
ΒΑΣΕΙΣ είναι οι χημικές ενώσεις που είναι ικανές να σχηματίσουν δεσμό με πρωτόνιο Η+
Σύμφωνα με θεωρίες που διατυπώθηκαν κατά διαστήμαται:
Σύμφωνα με την Θεωρία Οξέων - βάσεων κατά τον Arrhenius
Βάσεις είναι ουσίες που αυξάνουν την περιεκτικότητα των ιόντων υδροξυλίων σε ένα υδατικό διάλυμα
- πρόκειται για τα Υδροξείδια των Αλκαλίων και των Αλκαλικών Γαιών που διαλύονται στο νερό και παρέχουν ανιόντα υδροξειδίου ΟΗ- (βάσεις κατά Arhhenius)
NaOH -> Na+ + OH-
(εκτός από το Βηρύλλιο και το Μαγνησιο), το Υδροξείδιο του ΘαλίουΙ (Το Tl είναι στοιχείο της 13ης ομάδας και 6ης περιοδου)
Σύμφωνα με την Θεωρία Οξέων - βάσεων κατά τον Bronsted Lowry (1923)
Βάσεις είναι οι χημικές ενώσεις που μπορούν να γίνουν αποδέκτες πρωτονίων που αποσπούν από ένα οξύ (και σχηματίσουν ομοιοιπολικό δεσμό με το πρωτόνιο). Σύμφωνα με την ίδια θεωρία, το οξύ θεωρείται η ουσία ππου είναι ο δότης των πρωτονίων
. Όταν η βάση αποσπάσει το πρωτόνιο από το οξύ τότε μετατρέπεται η ίδια σε "συζυγές οξύ' και το οξυ σε "συζυγή βάση"
B (βάση) + HA (οξύ) --> BH (συζυγές οξύ) + H- (συζυγης βάση)
και υπ΄αυτήν την έννοια οξύ μπορεί να θεωρειθεί και το νερό
Θεωρία Οξέων - βάσεων κατά τον Lewis (1923)
Βάσεις είναι οι χημικές ουσίες που μπορούν να συνδεθούν με κενό τροχιακό μιας άλλης ένωσης. Αυτό γίνεται με την προσφορά ενός ζεύγους ηλεκτρονίων

- Δηλαδή, εκτός από το πρωτόνιο δεσμεύουν και οποιοδήποτε άτομο που έχει κενό τροχιακό άλλης χημικής ένωσης (βάσεις Lewis)
Αυτή είναι και η διαφορά του ορισμού των βάσεων κατά Bronsted Lowry, ότι δηλαδή τώρα δεσμεύονται οποιαδήποτε άτομα έχουν κενό τροχιακό και όχι μόνο το κατιόν υδρογόνου.
Έτσι στην κατηγορία των βάσων συμπεριλαμβάνονται στις οποίες συμπεριλαμβάνονται και άλλες ουσίες όπως: αμίνες ( RNH2), αλκοόλες (ROH), αιθέρες (ROR), θειόλες (RSH), θειοεστέρες (RSR), ανιόντα και ενώσεις δεσμού π
Παραδείγματα Το Βόριο 1s2 2s2 2p1 με 3 ηλεκτρόνια στην εξωτερική στοιβάδα κάνει 3 ομοιοπολικούς δεσμούς με 3 άτομα φθορίου και μένει με κενό τροχιακό στην τέτατρη θέση. Το άζωτο στο τριφθοριούχο άζωτο κάνει 3 οποιοπολικούς sp3 δεσμούς και έχει ένα ελεύθερο ζεύγος ηλεκτρονίων το οποιο προσφέρει στο φθοριούχο βόριο. Το NH3 είναι βάση κατά Lewis.

Παρόμοια στον αιθυλαιθέρα, το οξυγόνο 1s2 2s2 2p4 κάνει 2 ομοιοπολικούς δεσμούς με αλκύλια και παραμένει με δύο επιπλέον ελεύθερα ζεύγη ηλεκτρονίων. Ένα εξ αυτών διαθέτει στο BF3 . O αιθυλαιθέρας αποτελεί βάση κατά Lewis
Βασικότητα των αμινών
Οι αμίνες είναι παράγωγα της αμμωνίας, έχουν παρόμοια δομή με αυτήν και παρουσιάζουν τις ίδιες ιδιότητες.
Είναι βασικές και πυρηνόφιλες και οφείλουν τις ιδιότητές τους στο ελεύθερο ζεύγος ηλεκτρονίων του αζώτου.
Η αμινομάδα έχει πυραμιδική δομή. Το άτομο του αζώτου είναι sp3 υβριδοποιημένο και οι τρεις υποκαταστάτες κατευθύνονται στις τρεις γωνίες ενός τετραέδρου ενώ το μονήρες ζεύγος των ηλεκτρονίων κατευθύνεται στην τέταρτη γωνία του τετραέδρου.
Είναι ισχυρότερες βάσεις από τις αλκοόλες, τους αιθέρες και το νερό. Αυτό εξετάζεται από την σταθερά βασικότητας όπως
RNH2 + H2O -> RNH3+ + OH-
Kb =( RNH3+ + OH-) / RNH2 ,
Η βασικότητα των αμινών εξετάζεται επίσης από την σταθερότητα του αμμωνιακού άλατος που προκύπτει ή την σταθερότητα του αμμωνιακού ιόντος RNH3+ το οποίο αντιστοιχεί και στο συζυγές οξύ (κατά Bronsted Lowry) Η βάση είναι ισχυρή εάν το συζυγές οξύ είναι ασθενές.
Οι αμίνες διακρίνονται σε πρωτοταγείς, δευτεροταγείς και τριτοταγείς.
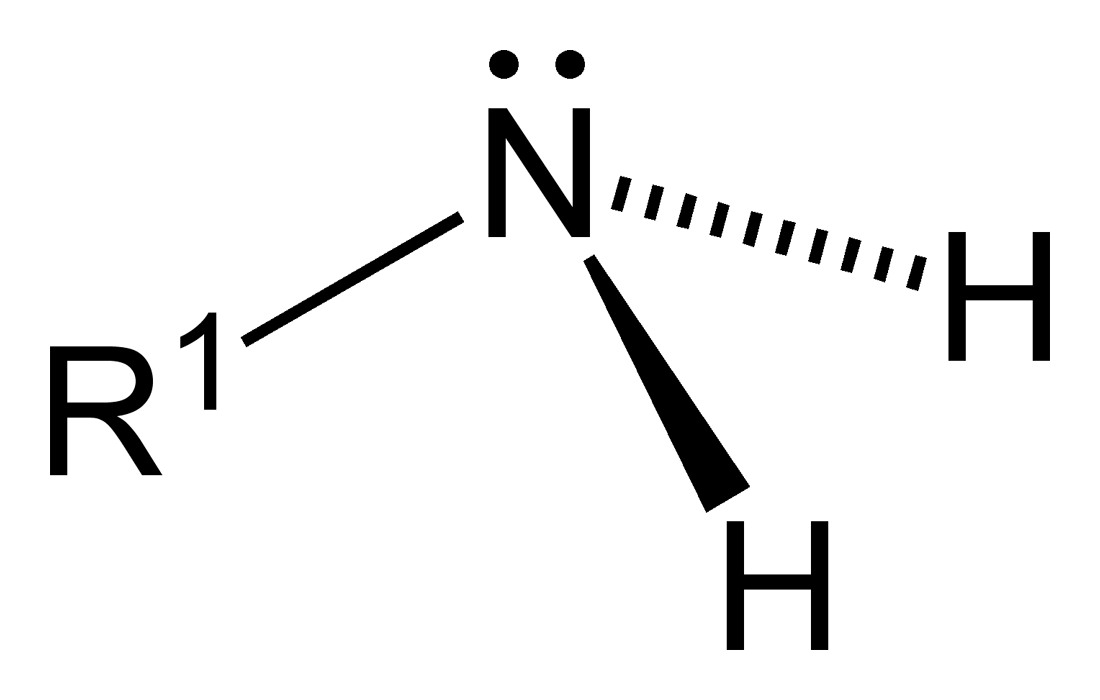


Οι αμίνες είναι ισχυρότερες βάσεις από την αμμωνία, λόγω της επίδρασης των αλκυλικών ομάδων που είναι δότες ηλεκτρονίων. και ενισχύουν τις βασικές ιδιότητες. Για των ίδιο λόγο οι δευτεροταγείς είναι ισχυρότερες από τις πρωτοταγείς αμίνες αφού η δράση του ελεύθερου ζεύγους ηλεκτρονίων του αζώτου ενισχύεται από δύο αλκυλικές ομάδες. Όμως δεν ισχύει ανάλογα για τα υδατικά διαλύματα τριτοταγών αμινών, γιατί, λόγω του τρίτου υποκαταστάτη, υπάρχουν εμπόδια χώρου στην μεταφορά του πρωτονίου, το δε κατιόν αμμωνίου που σχηματίζεται διαλύεται. Στην αέρια φάση αυτό δεν ισχύει και οι τριτοταγείς εμφανίζουν την μεγαλύτερη βασική ικανότητα.
Επίσης διακρίνουμε τις αλειφατικές αμίνες και τις αρωματικές αμίνες (ανιλίνες)
Οι αρωματικές αμίνες ή αρυλαμίνες, είναι ασθενέστερες βάσεις γιατί το ελεύθερο ζεύγος ηλεκτρονίων του αζώτου συμμετέχει στο φαινόμενο του συντονισμό των διπλών δεσμών του βενζοϊκού δακτυλίου
 Όσο μεγαλύτερη είναι η τιμή της Kb τόσο ισχυρότερη είναι η βάση.
Όσο μεγαλύτερη είναι η τιμή της Kb τόσο ισχυρότερη είναι η βάση.
To Pkb = -logKb.
Η αμμωνία έχει PKb= 4,79, η πρωτοταγής αμίνη μεθυλαμίνη έχει PKb=3,76, η δευτεροταγής αμίνη διμεθυλαμίνη PKb= 3,27 , η τριτοταγής τριμεθυλαμίνη PKb= 4,19 και η αρυλαμίνη ανιλίνη PKb=9,38
Αντίστροφα είναι οι τιμές για τα PKa των αμμωνιακών αλάτων
Η πρώτη αρυλαμίνη είναι η ανιλίνη . Υποκατάσταση με -CH3 , -NH2 , -OCH3 αυξάνουν την βασικότητα των αρυλαμινων γιατί ενισχύουν την δραστικότητα του αρωματικού δακτυλόυ ως προς την ηλεκτρονιόφιλη υποκατάσταση, ενώ υποκατάσταση με -Cl, -NO2, -CN, ελαττώνουν την δραστικότητα των αρυλαμινών.
Ανιλίνη PKb=9,38
Στην ένωση μεθυλοανιλίνη οι βασικότητα είναι αυξημένη λόγω της υποκατάστασης με μεθύλιο και το PKb= 8,9
Στην ένωση 4-χλωροανιλίνη οι βασικότητα είναι μικρότερη λόγω της υποκατάστασης με χλώριο που είναι ηλεκτρονιόφιλο και το PKb= 10,02
Οξύτητα και Βασικότητα των αλκοολών και φαινολών
Οι αλκοόλες είναι ενώσεις που περιέχουν ομάδες ΟΗ- συνδεδεμένες με κορεσμένα άτομα άνθρακα υβριδισμού sp3.
Οι αλκοόλες εμφανίζουν και βασικές και όξινες ιδιότητες.
Με ισχυρότερα οξέα οι αλκοόλες λειτουργούν σαν βάσεις και πρωτονιώνονται σχηματίζοντας οξωνιακά άλατα ROH2+
R-O-H + HΧ --> R-O-H2 + + Χ-
ενώ σε υδατικά διαλύματα διϊστανται σε πολύ χαμηλό βαθμό και αποδίδουν ένα πρωτόνιο στο νερό ( όξινη συμπεριφορά)
R-O-H + H2O --> RO:- +H3Ο:+
Η ka δίνει την ισχύ των βάσεων σαν οξέα. To PKa=-logKa
Αλκοόλες με μεγαλύτερο Ka είναι ισχυρότερες σε όξινη συμπεριφορά . H μεθανόλη (pka= 15,54), η αιθανόλη ( pka= 16,00), το νερό (pka= 15,74) έχουν παρόμοια ισχύ σαν οξέα. Αλκοόλες με υποκατάσταση πυρηνόφιλη έχουν μεγαλύτερο p Ka όπως η τριμεθυλοαιθανόλη ( pka= 18) άρα είναι ασθενέστερες στην όξινη συμπεριφορά, ενώ αλκοόλες με ηλεκτρονιόφιλη υποκατάσταση όπως η τριφθοροαιθανόλη (pKa=12,43) έχουν ισχυρότερη όξινη συμπεριφορά
Οι φαινόλες φέρουν μια ομάδα υδροξυλίου -ΟΗ, απευθείας συνδεδεμένη με τον αρωματικό δακτύλιο. Είναι από πολλές απόψεις παρόμοιες με τις φαινόλες. Έχουν όξινη συμπεριφορά και είναι πολύ ισχυρότερα οξέα από τις αλκοόλες λόγω της συμμετοχής του οξυγόνου στον συντονισμό
 του αρωματικού δακτυλίου με συνέπεια την αυξημένη σταθεροποίηση του ανιόντος φαινοξειδίου. Η φαινόλη έχει pKa=9,89. Υποκαταστάσεις στον δακτύλιο με πυρηνόφιλους ή ηλεκτρονιόφιλους υποκαταστάτες, ελλατώνει ή αυξάνει την οξύτητα. (Μεθυλοφαινόλη pKa=10,17, και χλωροφαινόλη pKa=9,38)
του αρωματικού δακτυλίου με συνέπεια την αυξημένη σταθεροποίηση του ανιόντος φαινοξειδίου. Η φαινόλη έχει pKa=9,89. Υποκαταστάσεις στον δακτύλιο με πυρηνόφιλους ή ηλεκτρονιόφιλους υποκαταστάτες, ελλατώνει ή αυξάνει την οξύτητα. (Μεθυλοφαινόλη pKa=10,17, και χλωροφαινόλη pKa=9,38)
Ανωτούχες Ετεροκυκλικες ενώσεις με εξαμελή δακτύλιο
 Η πυριδίνη (αζίνη) είναι μια αζωτούχα ετεροκυκλική ένωση ανάλογη του βενζόλιου όπου 5 άτομα άνθρακα και ένα sp2 υβριδοποιημένο άτομο αζώτου του δακτυλίου, συνεισφέρουν ένα π ηλεκτρόνιο στην αρωματική εξάδα. Όμως, το μονήρες ζεύγος ηλεκτρονίων του αζωτου δεν συμμετέχει στο π αρωματικό σύστημα, οπότε η πυριδίνη μπορεί να σχηματίσει δεσμό με ένα οξύ κατά lewis συμπεριφερόμενη σαν τριτοταγής αμίνη. Έτσι η πυριδίνη αποτελεί βάση κατά lewis,
Η πυριδίνη (αζίνη) είναι μια αζωτούχα ετεροκυκλική ένωση ανάλογη του βενζόλιου όπου 5 άτομα άνθρακα και ένα sp2 υβριδοποιημένο άτομο αζώτου του δακτυλίου, συνεισφέρουν ένα π ηλεκτρόνιο στην αρωματική εξάδα. Όμως, το μονήρες ζεύγος ηλεκτρονίων του αζωτου δεν συμμετέχει στο π αρωματικό σύστημα, οπότε η πυριδίνη μπορεί να σχηματίσει δεσμό με ένα οξύ κατά lewis συμπεριφερόμενη σαν τριτοταγής αμίνη. Έτσι η πυριδίνη αποτελεί βάση κατά lewis,  ασθενέσθερη όμως από τις αλκυλαμίνες, λόγω του αρωματικού δακτυλίου που είναι ηλεκτρονιόφιλος. Παρουσία ισχυρών οξέων η πυριδίνη πρωτονιώνεται και σχηματίζεται το κατιόν του πυριδινιωνίου. Το pKa του συζυγούς οξέος της πυριδίνης είναι 5,25
ασθενέσθερη όμως από τις αλκυλαμίνες, λόγω του αρωματικού δακτυλίου που είναι ηλεκτρονιόφιλος. Παρουσία ισχυρών οξέων η πυριδίνη πρωτονιώνεται και σχηματίζεται το κατιόν του πυριδινιωνίου. Το pKa του συζυγούς οξέος της πυριδίνης είναι 5,25
Η πυριμιδίνη (διαζίνη) είναι μια ετεροκυκλική αρωματική οργανική ένωση που περιέχει δύο άτομα αζώτου και είναι παρόμοια με την πυριδίνη στις χημικές ιδιότητες. Ο βασικός χαρακτήρας της είναι μειωμένος σε σχέση με την πυριδίνη. Είναι μια από τους δύο τύπους αζωτούχων βάσεων που βρίσκονται στα νουκλεϊκά οξέα όπως είναι η κυτοσίνη η θυμίνη και η ουρακίλη
.jpg)
Δήμητρα Σπανού
ΠΗΓΕΣ
Amines - Βικιπαίδεια (wikipedia.org)
Φαινόλη - Βικιπαίδεια (wikipedia.org)
ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ JOHN MACMURRY


