της Δήμητρας Σπανού, χημικού, καθηγήτριας Δευτ/θμιας Εκπ/σης 1ο Γυμν. Δάφνης
ΥΠΌ ΚΑΤΑΣΚΕΥΉ
για να είμαι πάντα κοντά σας
ΠΩΣ ΒΛΕΠΟΥΜΕ ΜΕ ΤΑ ΜΑΤΙΑ ΜΑΣ ΟΛΑ ΑΥΤΑ ΤΑ ΧΡΩΜΑΤΑ
ΣΥΝΈΧΕΙΑ ΑΠΌ
Τα χρώματα στη Χημεία και γιατί εμείς τα βλέπουμε. Μέρος πρώτο
απόσπασμα από το πρώτο μέρος
Αυτά τα οπτικά κύτταρα που βρίσκονται στο βάθος του ματιού μας είναι δύο ειδών είναι όλα ακριβώς τα ίδια;
αυτά που αντιλαμβάνονται την ένταση της ακτινοβολίας (τα ραβδία)
κι αυτά που διεγείρονται ανάλογα με την συχνότητα της ακτινοβολίας (κωνία).
Η συγκεκριμένη/ες συχνότητα (ή μήκος κύματος) της ηλεκτρομαγνητικής ακτινοβολίας είναι αυτό που έχει σαν αποτέλεσμα να βλέπουμε -καταλαβαίνουμε- τα χρώματα
Τα κωνία απορροφούν πολύ συγκεκριμένες ακτινοβολίες.
Υπάρχουν τριών ειδών κύτταρα -κωνία. Αυτά που μπορούν να απορροφούν ακτινοβολία της συχνότητας του ερυθρού και του πράσινου άλλα του κυανοιώδους και του κίτρινου και άλλα του λευκού και του μαύρου. Τριχρωματική ακτινοβολία στον άνθρωπο, ενώ στα πρωτεύοντα θηλαστικά είναι διχρωματική.
Γιατί βλέπουμε τόσα διαφορετικά χρώματακαι πολλές φορές ενδιάμεσων αποχρώσεων; Γιατί τα κωνία διεγείρονται ταυτόχρονα αλλά σε διαφορετικό βαθμό κάθε φορά κι εμείς αντιλαμβανόμαστε το συνολικό αποτέλεσμα.Αν ο βαθμός διέγερσης είναι ο ίδιος τότε βλέπουμε το λευκό χρώμα.
Είναι σχετικά εύκολο να καταλάβουμε την έννοια της οπτικής αντίληψης των χρωμάτων που γίνεται με την εισροή συγκεκριμένων ακτινοβολιών στο εσωτερικό του ματιού μας και διαβιβάζονται στις κατάλληλες περιοχές του εγκεφάλου προς επεξεργασία με τα νευρικά κύτταρα.
Για να προχωρήσουμε στην μελέτη των αποχρώσεων των χρωμάτων είναι απαραίτητο να αναφερθούμε στις εκπεμπόμενες από τα σώματα ακτινοβολίες και τα χαρακτηριστικά τους, κυρίως την συχνότητά τους που είναι αυτή που καθορίζει το χρώμα με την συγκεκριμένη του απόχρωση,
Όπως γνωρίζουμε η ηλεκτρομαγνητικής ακτινοβολίας προέρχεται από επιταχυνόμενα ηλεκτρόνια κύματα. Η αρχή της παραγωγής αυτών των Η/Μ κυμάτων από τα σώματα είναι οι μεταπτώσεις των ηλεκτρονίων των στοιβάδων τους από μια στοιβάδα σε μια άλλη.
Πως ακτινοβολούν τα άτομα των σωμάτων
Τα ηλεκτρόνια των ατόμων των υλικών σωμάτων, κινούνται σε ηλεκτρονιακές στοιβάδες με συγκεκριμένη ενέργεια. Η αλλαγή της θέσης κίνησης των ηλεκτρονίων αυτών είναι ένδειξη ότι έχουμε αυτήν την αλλαγή στην θέση τους.
Στις απλές περιπτώσεις αυτή η αλλαγή στην θέση αναφέρεται στην μετακίνηση μεταξύ των ηλεκτρονιακών στοιβάδων ενός ατόμου οι οποίες έχουν καθορισμένη ενέργεια από τους νόμους της κβαντικής μηχανικής.
Είναι η διαφορά των ενεργειών αυτών ΔΕ =Ε1-Ε2 είναι η εκπεμπόμενη ή η ακτινοβολούμενη ενέργεια με ανάλογη συχνότητα σύμφωνα με τον θεμελιώδη νόμο της κυματικής Ε=h.f
 Η κατανομή των ηλεκτρονίων στις στοιβάδες γίνεται με την δημιουργία ζευγαριών αντιπαράλληλου spin και ακολουθώντας την αρχή της ελαχίστης ενέργειας.
Η κατανομή των ηλεκτρονίων στις στοιβάδες γίνεται με την δημιουργία ζευγαριών αντιπαράλληλου spin και ακολουθώντας την αρχή της ελαχίστης ενέργειας.
Εμφανίζονται περιοχές κίνησης αυτών των ηλεκτρονίων που τις αποκαλούμε ατομικά τροχιακά που διακρίνονται σε s , p , d...
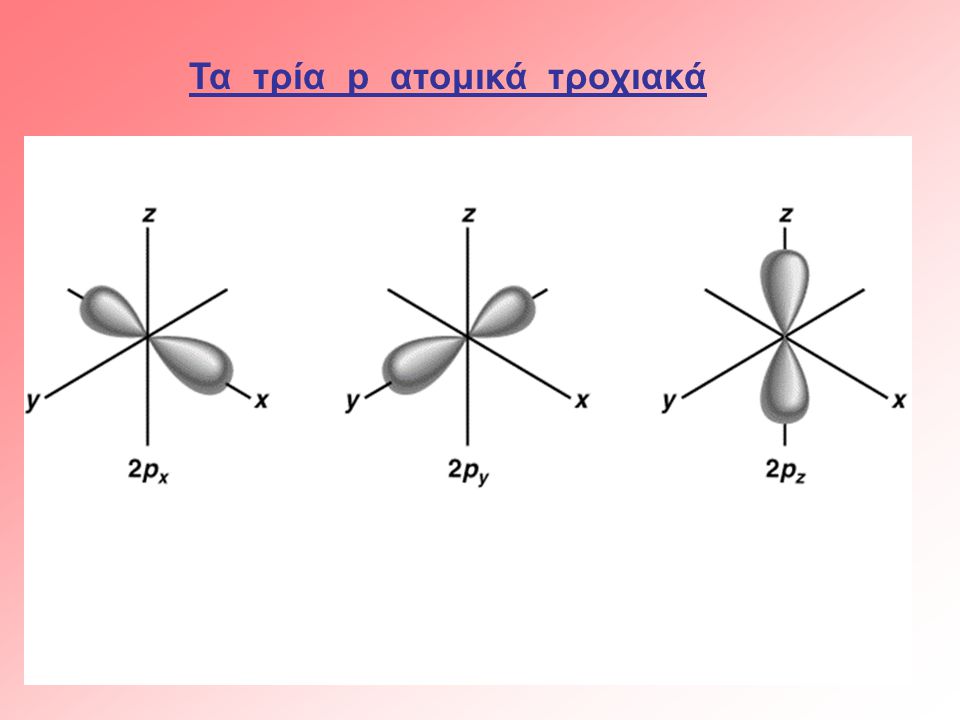

παράδειγμα: τα s τροχιακά για τις πρώτες στοιβάδες των ατώμων που είναι σφαιρικά και τα τρία p τροχιακά στις τρεις κατευθύνσεις του τρισδιάστατου χώρου που είναι λοβοί διπολικοί.
Η ενέργεια της Η/Μακτινοβολίας που εκπέμπεται/απορροφάται κάθε φορά που έχουμε είναι η διαφορά των ενεργειών των δυο σταθμών.
Αυτές οι ΔΕ είναι καθορισμένες και καθορισμένες είναι και οι συχνότητες των ακτινοβολιών. Τα φάσματα που έχουμε είναι γραμμικά εκπομπής ή απορρόφησης
Δεν είναι όλες οι ακτινοβολίες που εκπέμπουν τα υλικά σώματα ορατές. Υπάρχουν σειρές ακτινοβολιών ανάλογα με την μεταπίδησή τους από μια στοιβάδα σε μια άλλη. Μόνο η σειρά Balmer βρίσκεται στο φάσμα της ορατής ακτινοβολίας. Αυτή η διαφορά για φωτόνια του ορατού είναι 1,6 έως 3,2 eV
Μοριακά τροχιακά
Κατά την δημιουργία όμως μορίων ή ιοντικών ενώσεων τα τροχιακά αυτά αλληλοεπιρρεάζονται και πολλές φορές έχουμε αλληλοκάλυψη αυτών των τροχιακών που ισοδυναμεί με την συμβολή των ηλεκρομαγνητικών τους κυμάτων. Το αποτέλεσμα βέβαια να αλλάζουν τα χαρακτηριστικά τους και να δημιουργούνται άλλου τύπου τροχιακά τα μοριακά τροχιακά.
Έτσι όταν τα δυο τροχιακά έχουν παραπλήσιες ενέργειας και ίδια περίπου συμμετρία και όπου τα δυο ηλεκτρομαγνητικά κύματα είναι σε φάση
τα δυο ηλεκτρόνια του ζευγαριού πετυχαίνουν ευνοικότερη ενεργειακή κατάσταση με spin αντιπαράλληλα (δεσμικά) αλλάζει και γίνονται
ηλεκτρόνια αντιπαράλληλου σπιν με όχι ευνοική ενέργεια σύνδεσης (αντιδεσμικα΄) και το σύμβολό τους είναι ένα αστεράκι πάνω από το σύμβολο του δεσμικού.
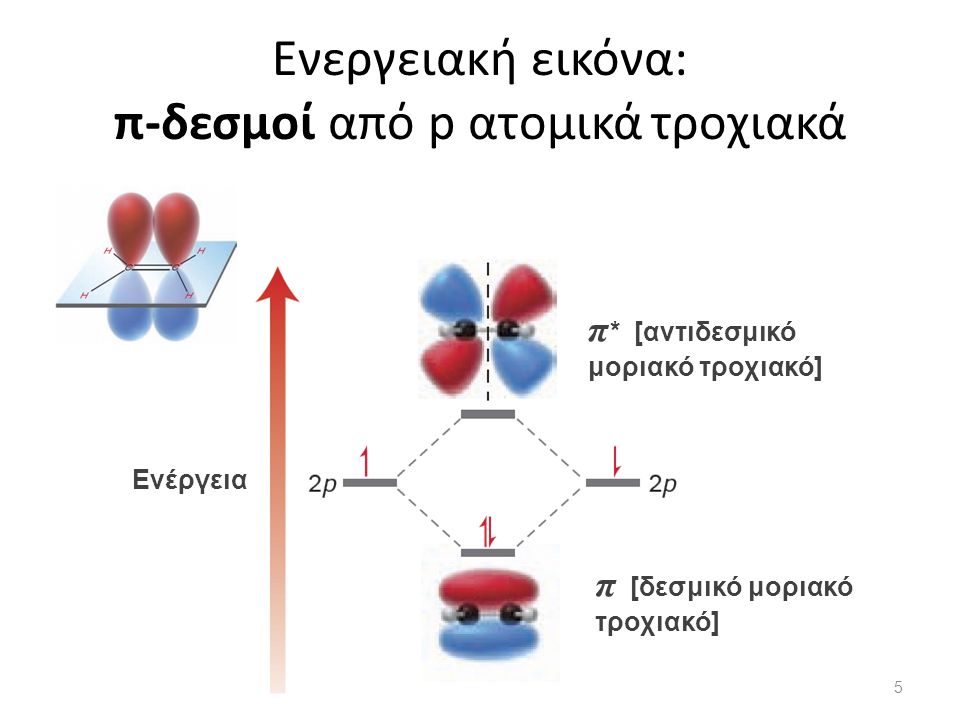
Στην περίπτωση που έχουμε ηλεκτρόνια σ* και π*. Η σχέση των ενεργειακών σταθμών τους φαίνεται από το σχήμα στην συνέχεια
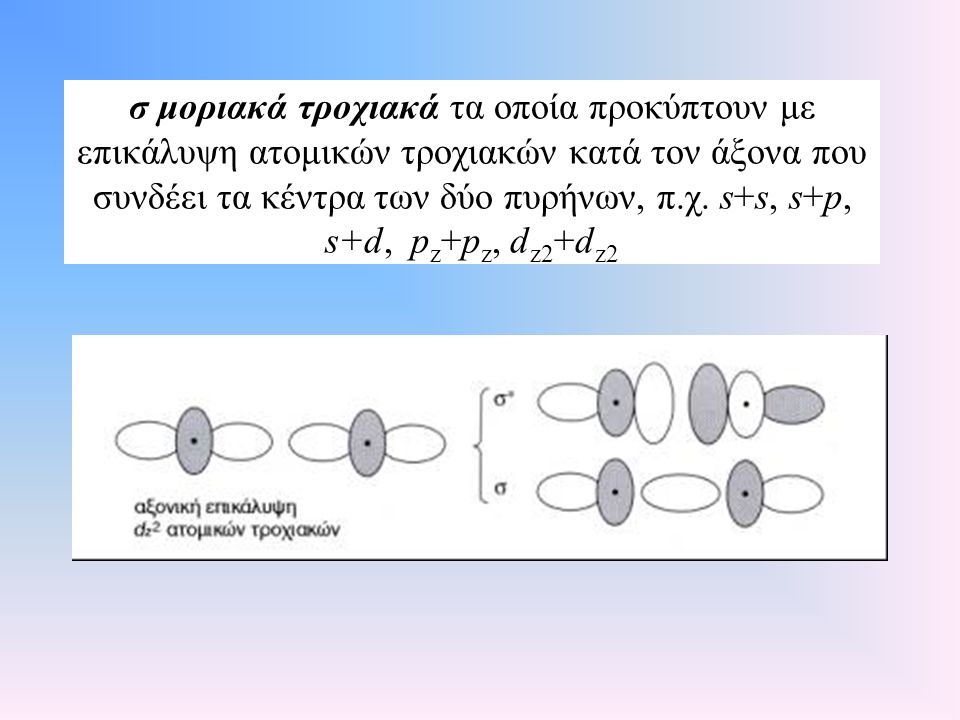
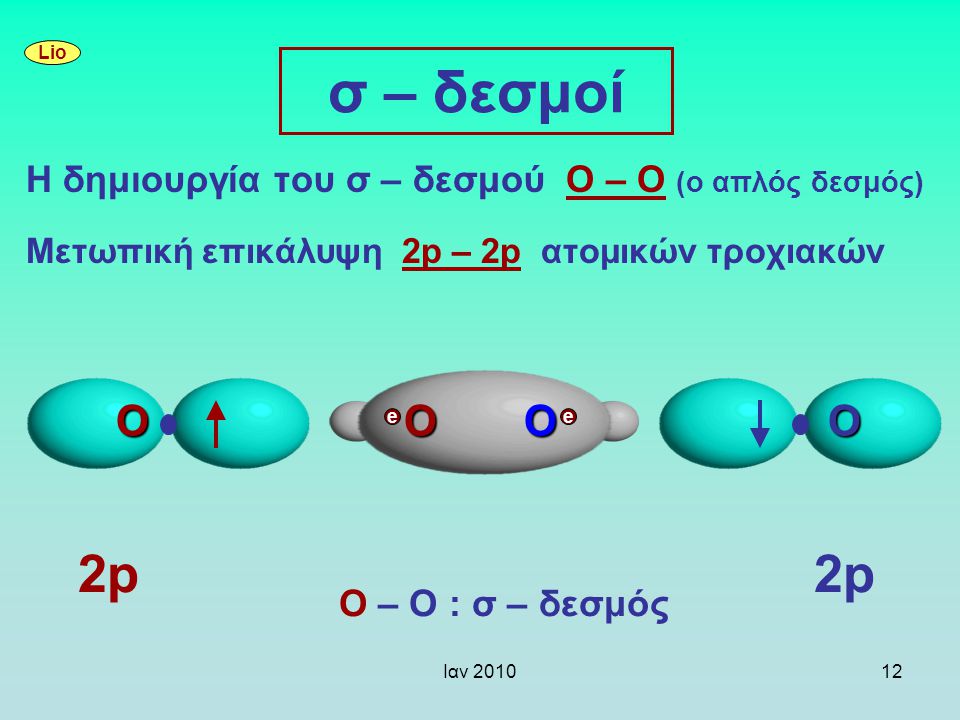
Κατά την αλληλοκάλυψη τροχιακών (που σημαίνει ουσιαστικά την συμβολή των Η/Μ κυμάτων τους) : s με s, s με p και p με p έχουμε τα μοριακά τροχιακά ss sp pp
μπορεί να έχουμε επικάλυψη κατά μήκος του άξονα που συνδέει τους πυρήνες και αυτή είναι η
σ σύνδεση που είναι και η ευνοικότερη ενεργειακά. Όμως μπορεί να έχουμε σύνδεση π με επικάλυψη τροχιακών παράλληλη στον άξονα σύνδεσης των πυρήνων
Κατά την ενεργοποίηση των ηλεκτρονίων αυτό που συμβαίνει είναι ότι η ενέργεια προσλαμβάνεται από το ένα από τα δύο ηλεκτρόνια των ζευγαριών των ηλεκτρονίων με αποτέλεσμα να αλλάζει η κατεύθυνση του spin.
έτσι μπορεί να έχουμε μετάβαση από σ->σ* ή π ->π* και ανάλογα τα επίπεδα ενέργειας.
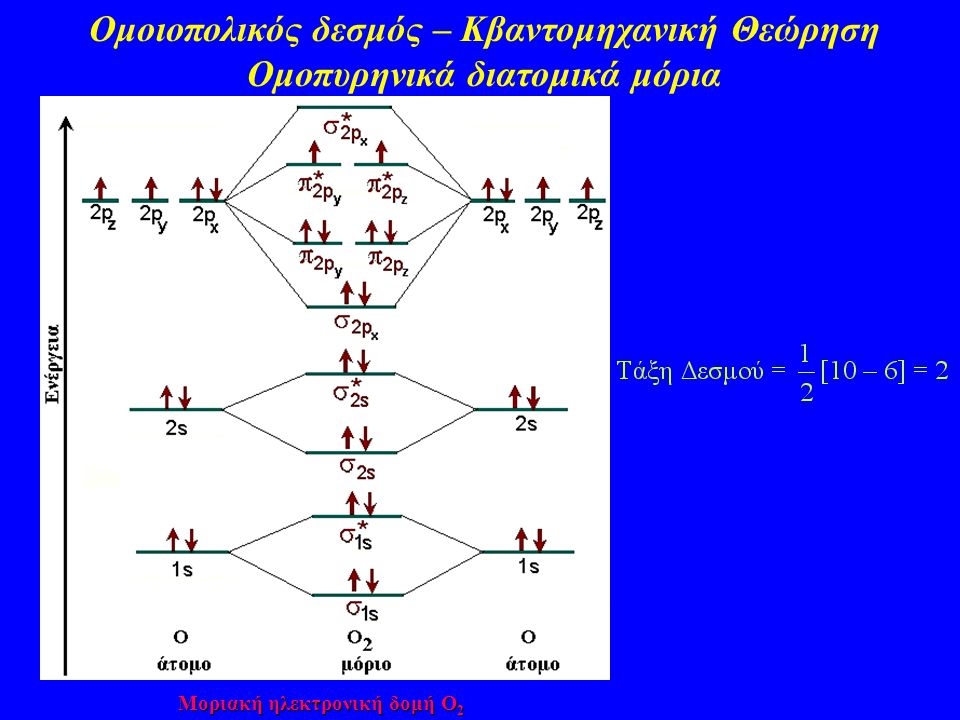
Οι ενεργειακές στάθμες για ένα ζευγάρι ηλεκτρονίων είναι διαφορετικές ανάλογα αν είναι σ ή π αν είναι sd ή ss ή dd. Επίσης αν είναι δεσμικά ή αντιδεσμικά.
Υπάρχουν ενεργειακές στάθμες και ανάλογα με την ενέργεια που απορροφάται ή εκλύεται. Ένα μοριακό τροχιακό μπορεί να αλλάξει ενεργειακή στάθμη εκπέμποντας ή απορροφόντας ανάλογη αντινοβολία και ανάλογου μήκους κύματος και συχνότητα
Υβριδισμός
ΣΕ ορισμένες περιπτώσεις γύρω σε μια περιοχή υπάρχουν τροχιακά που μεταξύ τους εμφανίζουν ασυμετρία και ανομοιογένεια. Για λόγους καλύτερης κατανομής της ενέργεια τα τροχιακά αυτά επαναδιατάσσονται ώστε να εμφανίζουν τώρα ομοιοκατανομή
ακατέργαστο
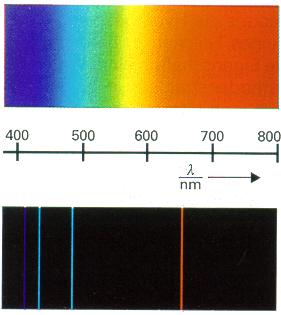
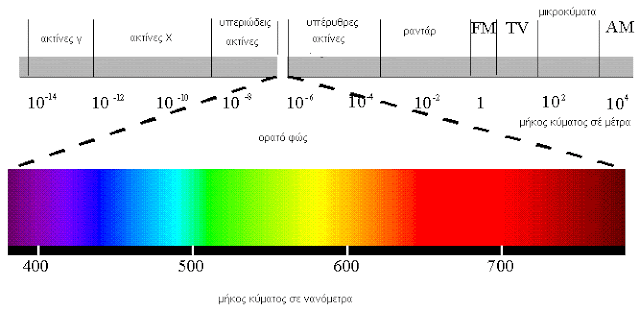
στ. Βλέπουμε γιατί στα μάτια μας πέφτει το ορατό φως δηλαδή ακτινοβολία ηλεκτρομαγνητική που έχει ένα εύρος συχνοτήτων της τάξης από 400 έως 800 ΤΗerz που αντιστοιχεί σε μήκος κύματος ακτινοβολίας από 660-700nm το κόκκινο έως 440-460 nm το μπλε
ΣΧΕΣΗ ΤΗΣ ΜΟΡΙΑΚΗΣ ΔΟΜΗΣ ΤΗΣ ΥΛΗΣ ΚΑΙ ΤΗΣ ΣΥΧΝΟΤΗΤΑΣ ΠΟΥ ΕΚΠΕΜΠΕΙ
Κατ΄αρχήν οι συχνότητες μιας ακτινοβολίας είναι ανάλογες των μεταπτώσεων των ηλεκτρονίων του ατόμου από στοιβάδα σε στοιβάδα και υπάρχουν σειρές που κατηγοριοποιούν τις μεταπτώσεις (ή διεγέρσεις) αυτές . Από αυτές όμως μας αφορούν όσες μπορούν να γίνουν ορατές.
ΠΩΣ ΣΥΜΒΑΙΝΕΙ ΑΥΤΗ Η ΔΙΑΦΟΡΑ ΕΝΕΡΓΕΙΑΣ ΣΤΟΙΒΑΔΩΝ ΝΑ ΠΑΙΡΝΕΙ ΠΕΡΙΣΣΟΤΕΡΕΣ ΤΙΜΕΣ ΑΠΟ ΑΥΤΕΣ ΠΟΥ ΠΕΡΙΛΑΜΒΑΝΕΙ Η ΣΕΙΡΑ BALMER
Στα όρια του φάσματος του ορατού, οι ακτινοβολίες με τις χαμηλότερες συχνότητες γύρω στα 400ΤΗz και ενέργεια αντίστοιχα χαμηλότερη γύρω στο 1,6eV γίνονται αντιληπτές σαν χρώματα στις αποχρώσεις του κόκκινου. Αντίστοιχα στις υψηλότερες συχνότητες του ορατού με συχνότητα 800THz και με ενέργεια φωτονίου γύρω στα 3,2 eV το χρώμα γίνεται μπλέ έως ιώδες. Ενδιάμεσες τιμές συχνοτήτων και ενεργειών δίνουν χρώματα πράσινα και κίτρινα.
.jpg)
ΤΟΣΑ ΧΡΩΜΑΤΑ ΤΟΣΕΣ ΑΠΟΧΡΩΣΕΙΣ!

Τι είναι το χρώμα πως συνδέεται με την χημική σύσταση και τις χημικές ιδιότητες και ποιες είναι οι χημικές μετατροπές που επιρρεάζουν την απόχρωση στο χρώμα;
Ποια είναι η διαφορά σε τέσερα κυανοπράσινα χρώματα το cyan aqua aquamarine turquaoise και γιατί έχουμε άλλωτε κόκκινο, άλλωτε κοραλλί, indian red ή οrange red;
Οπως είδαμε η διαφορά τους στα χρώματα είναι ο τρόπος που περνάει στην αντίληψή μας το διαφορετικό μήκος κύματος της ακτινοβολίας που εκπέμπουν τα σώματα.
Τα ηλεκτρόνια των στοιβάδων των ατόμων μπορεί να βρίσκονται στην θεμελιώδη στάθμη, να διεγείρονται, ή να αποδιεγείρονται
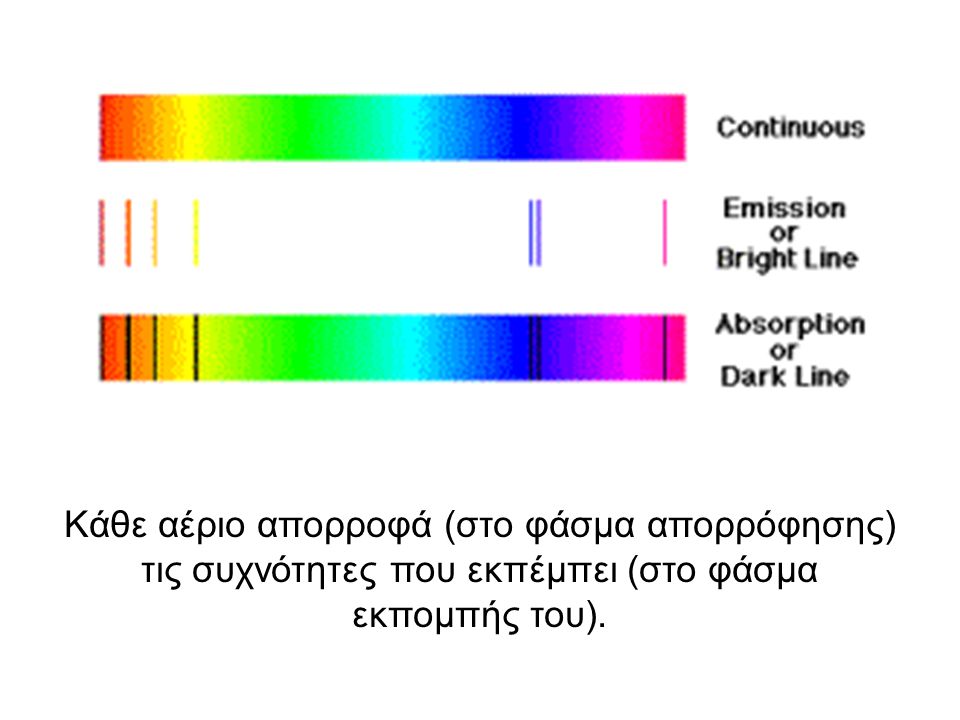 Στην εικόνα δίπλα βλέπουμε την απορρόφηση ακτινοβολίας ορατής, από το άτομα υδρογόνου. Όταν η ακτινοβολία περνά μέσα από υδρογόνο, κατά την έξοδό της, σε ορισμένα σημεία της υπάρχουν μαύρες γραμμές (έλλειψη χρώματος). Εκεί έχει απορροφήσει ακτινοβολία το άτομο του υδρογόνου. Τα ηλεκτρόνιά του έχουν ανάλογα διεγερθεί και κατά την αποδιέγερσή τους θα δώσουν αντίστοιχες ακτινοβολίες των ίδιων συχνοτήτων.
Στην εικόνα δίπλα βλέπουμε την απορρόφηση ακτινοβολίας ορατής, από το άτομα υδρογόνου. Όταν η ακτινοβολία περνά μέσα από υδρογόνο, κατά την έξοδό της, σε ορισμένα σημεία της υπάρχουν μαύρες γραμμές (έλλειψη χρώματος). Εκεί έχει απορροφήσει ακτινοβολία το άτομο του υδρογόνου. Τα ηλεκτρόνιά του έχουν ανάλογα διεγερθεί και κατά την αποδιέγερσή τους θα δώσουν αντίστοιχες ακτινοβολίες των ίδιων συχνοτήτων.

Όταν όμως δεν αναφερόμαστε σε μεμονωμένα άτομα (όπου οι αριθμοί που επιτρέπονται για τα κβαντικά μεγέθη όπως ακτίνα, ενέργεια, συχνότητα ακτινοβολούμενης ενέργειας κ.λ.π. είναι περιορισμένοι και ερχόμαστε στα μόρια και στις συνδέσεις των ατόμων μεταξύ τους, αυτά όλα γίνονται πολυπλοκότερα. Οι αποστάσεις των ηλεκτρονίων από τους πυρήνες τους δεν είναι πια σταθερές, οι ενέργειές τους διαχέονται λόγω των επαγωγικών φαινομένων . Η θέση του κοινού ζευγαριού των ηλεκτρνίων επιρρεάζεται από την έλξη ή την απώθηση από τα άλλα άτομα ή τους τυχόν γειτονικούς υποκαταστάτες.
Έτσι από την συμπεριφορά ενός διεγερμένου ηλεκτρονίου περνάμε στην διέγερση του κοινού ζεύγους ηλεκτρονίων. Έτσι έχουμε τώρα μια ένα πλήθος από συχνοτήτες διέγερσης και αποδιέγερσης. Αυτές οι συχνότητες όμως δεν βρίσκονται πάντα μέσα στο φάσμα του ορατού.
ΠΕΡΙΠΤΩΣΕΙΣ ΣΥΝΔΕΣΕΩΝ ΑΤΟΜΩΝ ΠΟΥ ΔΙΝΕΙ ΕΝΕΡΓΕΙΑΚΕΣ ΣΤΑΘΜΕΣ ΣΤΟ ΦΑΣΜΑ ΤΟΥ ΟΡΑΤΟΥ
ΑΚΤΙΝΟΒΟΛΙΕΣ ΠΟΥ ΑΝΤΙΣΤΟΙΧΟΥΝ ΣΕ ΠΕΡΙΣΣΟΤΕΡΑ ΚΑΙ ΠΛΟΥΣΙΟΤΕΡΑ ΧΡΩΜΑΤΑ
Α. Ενώσεις με αλυσίδες ανθράκων
Στις γνωστές ανθρακικές αλυσίδες των οργανικών ενώσεων -C-C-C-C-C- τα άτομα του άνθρακα αρχικά συνδέονται με απλούς δεσμούς. Δηλαδή ομοιοπολικό ζεύγος ηλεκτρονίων με σύνδεση μετωπική σ και αντιπαράλληλα spin . Αν το μόριο με σ δεσμό, απορροφήσει ενέργεια, κάποιας συγκεκριμένης συχνότητας μεγαλύτερης του ορατού, ένα από τα ηλεκτρόνια του ζεύγους θα διεγερθεί, θα περάσει σε υψηλότερο ενεργειακό επίπεδο , θα αλλάξει το spin του και το ζευγάρι του δεσμού θα έχει τώρα παράλληλο spin. Εχουμε διεγερμένο δεσμό σ* . Όταν αποδιεγείρεται εκπέμπει φωτόνιο συχνότητας επείσης μεγαλύτερης του ορατού φωτός. Η αποδιέγερσή σ - σ* δεν θα τα δώσει ορατή ακτινοβολία ούτε και χρώματα
Αντίθετα σε ανθρακικέw αλυσίδες με διπλούς δεσμούς -C=C-C-
στον διπλό δεσμό έχουμε τον ένα δεσμό σ και τον άλλο πλάγιο π δεσμό. Για τον δεύτερο η διέγερση του ζεύγους σε π* καθώς και η αποδιέγερσή του
π* ->π σχετίζεται με ααπορρόφηση και εκπομπή ενέργειας μέσα στο ορατό φάσμα
Με τα π ηλεκτρόνια και τις αλληλοεπιδράσεις τους, σχετίζεται και το συζυγιακό φαινόμενο
Εδώ εκτός από το επαγωγικό (Ι) φαινόμενο λόγω του οποίου το κοινό ζευγάρι ελκεται ή απωθείται από άλλα άτομα του μορίου εδώ έχουμε και το συζυγιακό φαινόμενο (R) γιατί υπάρχει αλληλοεπίδραση μεταξύ των ίδιων των π ηλεκτρονίων των δεσμών
Τα π ηλεκτρόνια του δεσμού να έλκονται ή να απωθούνται και η πυκνότητά τους τοπικά, αυξάνεται ή ελαττώνεται.
Πολύ καλύτερα αποτελέσματα έχουμε όταν συναντάμε περιπτώσεις συζυγιακών διπλών δεσμών δηλαδή εναλλασόμενων απλών και διπλών δεσμών στην ανθρακικη αλυσίδα. -C=C-C=C-
α και κΓι αυτό επικεντρωνόμαστε σε ουσίες που δημιουργούν ενδιάμεσες ενεργειακές στάθμες λόγω κυρίως μεσομερών καταστάσεων που δημουργούνται σε περιπτώσεις εναλλασόμενων απλών και διπλών δεσμών (συζυγιακοί δεσμοί).
Η
ΠΗΓΕΣ
Διατροφή και Χημεία τροφίμων Ν. Γαλανόπουλος, Γ. Ζαμπετάκης, Μ. Μαυρή, Α. Σιαφάκα
Διαδυκτυακά χρώματα Βικιπαίδεια
https://www.google.gr/search?q=%CF%86%CE%B1%CF%83%CE%BC%CE%B1+%CE%BF%CF%81%CE%B1%CF%84%CE%BF%CF%8D&safe=strict&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjl1abu6N3VAhXQERQKHcIdDQgQ_AUICigB&biw=1247&bih=675#imgrc=9ElK-DKOCbOEjM:
https://slideplayer.gr/slide/2482278/
https://slideplayer.gr/slide/11603144/
https://195.134.76.37/chemicals/chem_lycopene.htm
https://repository.kallipos.gr/bitstream/11419/1249/1/02_chapter_9.pdf
