της Δήμητρας Σπανού Χημικού, καθηγήτριας Δευτ/θμιας Εκπ/σης μόνιμης καθηγήτριας στο 1ο Γυμνάσιο Δάφνης
για τα τυρανισμένα αγγελούδια τους πρεσβευτές του μέλλοντός μας
....το παρελθόν μου σκοτεινό,
το μέλλον μου αβέβαιο
το παρόν μου δύσκολο
μη μου τυραννάτε..."
στοίχοι από τραγούδι απ το ραδιόφωνο βρέθηκε σε μια μικρή ποιητική συλλογή με τίτλο "διάτρητος" του Δ, Παπαχρήστου
Τι σημαίνει "οξείδaναγωγή" στην Χημεία
Ενώ παλιότερα οξειδώσεις ορίζονταν σαν αντιδράσεις ένωσης με το οξυγόνο ή (αργότερα) αφαίρεση υδρογόνου
Aντίστοιχα αναγωγές ορίζονταν σαν αντιδράσεις ένωσης με το υδρογόνο
ή (αργότερα) αφαίρεση οξυγόνου
Σήμερα οι αντιδράσεις αυτές εξετάζονται ως προς την δυνατότητα μετακίνηση ηλεκτρονίων μεταξύ ατόμων ή μορίων.
Αναγκαστικά, τα ηλεκτρόνια αυτά, πρέπει να μεταφερθούν από ένα σώμα σε άλλο σώμα. Το σώμα αυτό στο οποίο προστίθενται ηλεκτρόνια είναι οξειδωτικό και ανάγεται .
Συγκεκριμένα σε όλους τους τύπους οξειδώσεων συμβαίνει αφαίρεση ηλεκτρονίων.
Τα σώματα από τα οποία αφαιρούνται ηλεκτρόνια οξειδώνονται
Σε αερόβιες συνθήκες το οξυγόνο είναι το συνηθέστερο σώμα στο οποίο μεταφέρονται τα ηλεκτρόνια αυτά
Σε αναερόβιες σώματα που μπορούν να δεχθούν ηλεκτρόνια είναι τα νιτρικά ιόντα ΝΟ3-, τα θειικά ιόντα SO4-- , και το διοξείδιο του άνθρακα CO2--. τα οποία ονομάζονται οξειδωτικά σώματα
Αναγκαστικά, τα ηλεκτρόνια αυτά, πρέπει να μεταφερθούν σε άλλο σώμα. Το σώμα αυτό στο οποίο προστίθενται ηλεκτρόνια ανάγεται ενώ αυτό από το οποίο αφαιρούνται οξειδώνεται .
Έτσι έχουμε ημιαντιδράσεις που συμβαίνουν ταυτόχρονα μια οξείδωσης και η άλλη αναγωγής και μαζύ τις καταλογίζουμε σαν αντιδράσεις οξειδοαναγωγής
Ca ⟶ Ca2+ + 2e. και 1/2O2 + 2e ⟶ O2-
και μαζύ γράφονται Ca + 1/2O2 ⟶ CaO (1)
αν΄έχω άλλο οξειδωτικό πλην του οξυγόνου
Ca ⟶ Ca2+ + 2e. και Cl2 + 2e ⟶ 2Cl-
και μαζύ γράφονται Ca + Cl2 ⟶ CaCl2 (2)
Τα ηλεκτρόνια από το ένα σώμα στο άλλο μπορεί να περάσουν άμεσα (όπως σε ένα διάλυμα) ή μέσω μιας τρίτης ουσίας που μπορεί να είναι ένας μεταλλικός αγωγός ή ένας ηεκτρολυτικός αγωγός (τήγματα αλάτων και υδροξειδίων μετάλλων, ή υδατικά διαλύματα που περιέχουν ιόντα).
Αντίστοιχες οξειδοαναγωγικές ημιαντιδράσεις αντιδράσεις έχουμε σε άλλα όπως στοιχεία που συναντώνται με περισσότερους από έναν αριθμούς οξειδώσεως
Πρότυπο ή κανονικό δυναμικό οξειδαναγωγικών ημιαντιδράσεων
Αυτή η ροή ηλεκτρονίων δηλαδή το σταθερό ηλεκτρικό φορτίο των ημιαντιδράσεων σε κατάσταση ισορροπίας, είναι το ηλεκτρικό δυναμικό τους Εο που μετριέται σε Volt .και Συμβατικά παίρνει θετικές τιμές για ιόντα περισσότερο οξειδωτικά του υδρογόνου και αρνητικές για ιόντα λιγότερο οξειδωτικά του Η+.
Οι αντιδράσεις γράφονται πάντα σαν αναγωγικές
Οι θετικές τιμές αντιπροσωπεύει οξειδωτικές συνθήκες και αρνητικές τιμές όταν αντιπροσωπεύει αναγωγικές συνθήκες
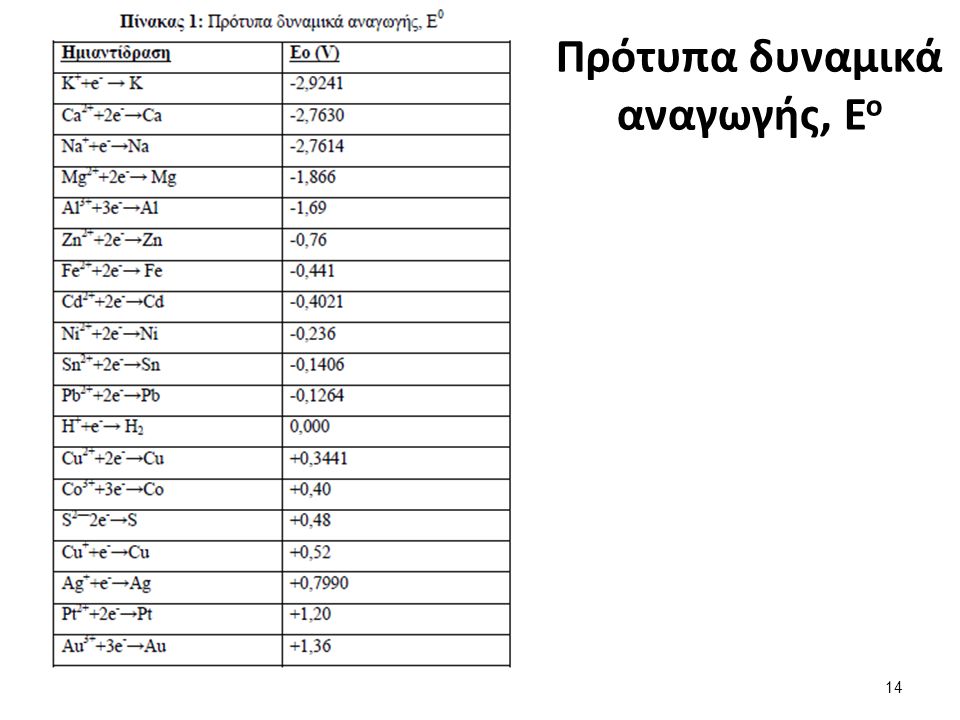
Zn -2e --> Zn 2+
Cu2+ + 2e --> Cu
Αν θεωρήσουμε την κάθε μια από τις δυο ημιαντιδράσεις που αποτελούν
ένα στοιχείο και το ιόν αυτού παρατηρούμε ότι συνήθως υπάρχει μια μεταφορά ηλεκτρονίων εκατέρωθεν.
Εάν από το στοιχείο μεταφέρονται ηλεκτρόνια στο ιόν του τότε έχουμε αναγωγή του στοιχείου Zn -2e --> Zn 2+
Εάν από το ιόν μεταφέρονται ηλεκτρόνια στο στοιχείο του τότε έχουμε οξείδωση του στοιχείου Cu2+ + 2e --> Cu
Το ζεύγος Zn/ Zn 2+ όπως και ή Cu/ Cu 2+ και άλλων , που ανταλλάσουν ηλεκτρόνια και ονομάζονται ηλεκτρόδια
Για παράδειγμα ηλεκτρόδιο χαλκού μπορεί να αποτελείται από ένα χάλκινο έλασμα που βρίσκεται μέσα σε διάλυμα CUSO4. (Cu++ kai SO4--)
Αυτή η διαφορά δυναμικού σχετίζεται με το έργο που παράγεται ή καταναλώνεται για /με την μετακίνηση ηλεκτρονίων
Vb -Va = W/q

Aυτή h Vb -Va δεν μπορεί να μετρηθεί εύκολα . Μετράται μόνο συγκριτικά με το δυναμικό ενός άλλου ηλεκτροχημικού ζεύγους , αυτό του υδρογόνου προς τα ιόντα του Η2 /Η+.
Χρησιμοποιούμε έλασμα λευκοχρύσου βυθισμένο σε διάλυμα HCL στο οποίο διαβιβάζονται φυσαλίδες αέριου υδρογόνου έως ότου αποκατασταθεί ισορροπία με τα Η+ του διαλύματος. Η2 <=> Η+ + e- . Το ηλεκτρόδιο λευκοχρύσου αδρανές, δεν ανταλάσσονται ηλεκτρόνια και συμβατικά παίρνουμε το κανονικό δυναμικό του Η2/Η+ Εο =0. τότε
μετράμε έτσι την Ηλεκτρεγερτική δύναμη του ηλεκτροδίου μας που εξαρτάται από τις συγκεντρώσεις του οξειδωτικού και αναγωγικού του ζεύγους
Αν το ζεύγος δεν είναι σε ισορροπία το δυναμικό του είναι διαφορετικό από το Εοισορροπίας . Το δυναμικό οξειδαναγωγής και το κανονικό δυναμικό οξειδαναγωγής δίνουν την σχέση
Ε= Εο + RT/nF ln [οξειδωτικό]/ [αναγωγικό]
Το Εο Καλείται επίσης και δυναμικό ηλεκτροδίου και είναι χαρακτηριστικό για τα μέταλλα.
Σχετικά Αν θεωρήσουμε τις συγκεντρώσεις του οξειδωτικού και του αναγωγικού ίσες τότε προκύπτει μια σταθερά Εο για κάθε ζεύγος οξειδοαναγωγικό, που ονομάζεται Δυναμικό του Οξειδαναγωγικού ζεύγους Π.Χ. για Cl2 /2Cl- Εο = 1,36V για Cu2+ / Cu Εο = 0,34 (Cu /Cu2+ η Εο =-0,34 V)
για Ca +2/Ca με Eo = 2,87V ή (Cα /Ca2+ η Εο =--2,87 V)
Η διαφορά δυναμικού που υπάρχει μεταξύ στοιχείων και ιόντων τους (ζεύγους),
έχει συνέπεια την παραγωγή έργου και την μεταβολή της ελεύθερης ενέργειάς τους
Η διαφορά δυναμικού στις οξειδαναγωγικές αντιδράσεις έχει συνέπεια την μεταβολή της ελεύθερης ενέργειας DG της αντίδρασης αυτής
Συνήθως όμως To πρότυπο δυναμικό κάθε αντίδρσης και οι μεταβολή του έχει συνέπεια να μεταβάλεται και η ελεύθερη ενέργεια Gibbs. H σχέση που συνδέει το πρότυπο δυναμικό σε μια οξειδοαναγωγική αντίδρσση και η ΔG είναι
Εο= -ΔG/ n .F
όπου, ΔG είναι η ελεύθερη ενέργεια Gibbs n ο αριθμός των moles της ημι-αντίδρασης F η σταθερά Faraday
από την σχέση αυτή έχουμε ΔG = -nFΔΕο
την συγκρίνουμε με την τιμή της Ηλεκτρεγερτική δύναμη του ηλεκτροδίου με το ηλεκτρόδιο υδρογόνου Η2/ 2Η+
και προκύπτουν τιμές σχετικές με το ηλεκτρόδιο υδρογόνου που είναι και αυτές που χρησιμοποιούνται συνήθως.
Οξειδοαναγωγικό σύστημα από δύο ηλεκτρόδια
Σύνδεση ηλεκτροδίων σε σειρά
Μεταξύ των σωμάτων Zn/ Zn 2+που ή Cu/ Cu 2+ και άλλων , που ανταλλάσουν ηλεκτρόνια και ονομάζονται ηλεκτρόδια, υπάρχει μια διαφορά δυναμικού.
Από εδώ και μετά μπορούμε να συνδέσουμε ηλεκτρόδια (που λέγονται και λέγονται οξειδοαναγωγικό ζεύγος) όπως
οξειδαναγωγικόν σύστημα. Fe3+ / Fe2+ με Eo = 0,771V (1) Sn4+ / Sn2+ με Eo=0,150V
To οξεiδωτικότερο δηλαδή αυτό που έχει Εο μεγαλύτερη θα οξειδώσει το άλλο και έτσι, έχουμε
όπως και
2Fe3+ + S n2+ --> 2Fe2+ + Sn4+
το ίδιο για το
Cu2+ /Cu Eo = 0,34 V (1) και Zn2+ /Zn με Εο = -0,76 V (2) τότε έχουμε Cu2+ + Zn --> Cu + Zn2+ (2)
Αν εφαρμώσουμε την σχέση Ε= Εο + RT/nF ln [οξειδωτικό]/ [αναγωγικό]
για κάθε μια από τις δυο ημιαντιδράσεις 1 και 2 έχουμε την διαφορά δυναμικού του συστήματος των δυο ηλεκτροδίων
με ΔΕ = Ε1 -Ε2 = ΔΕο + RT/2F ln [ F e3+]2 [Sn2+] / [Fe2+] [ Sn4+]
ή ΔΕ = Ε1 -Ε2 = ΔΕο - RT/2F ln [ [Fe2+] [ Sn4+]/ F e3+]2 [Sn2+] /
Ανάλογα για να βρούμε πως μεταβάλεται η ελεύθερη ενέργεια G με τις οξειδοαναγωγικές αυτές αντιδράσεις αναφερόμαστε στην σχέση Εο= -ΔG/ n .F
Όπως έχει αναφερθεί, στην θερμοχημεία, για να περιγράψουμε μεταβολές στην ενέργεια χρησιμοποιούμε κυρίως την ΔG (μεταβολή στην ελεύθερη ενέργεια Gibbs).
Εφαρμώζοντας τα ανωτέρω σε βιολογικά συστήματα μπορούμε να πάρουμε σαν παράδειγμα την οξε'ιδωση του γαλακτικού οξέος προς πυροσταφυλικό
H αντίδραση αναγωγής του CH3COCOO-/CH3COHCOO- με Εο = - 0,19V και η μετατροπή του Οξυγόνου σε νερό 1/2 Ο2 / Η2Ο με Εο = 0,80 V
Οξειδώνει το δεύτερο ζεύγος ( 0,80 V >-0,19 V) ΔΕο =-0,99V
2CH3CHOHCOO- +O2 --> 2CH3COCOO- +2H2O
ΔG = -nFΔΕο 'εχουμε όπου είναι ο αριθμός των φορτίων που ανταλλάσει το οξειδούμενο, F είναι η σταθερά FARADAY = 96.500Cb,
ΔG = - 4 *96500Cb*0,99 V = 386000 Cb * V = 386000 joule/mol
Διαφορά δυναμικού μεταξύ οξειδωμένης/ανηγμένης μορφής μιας ουσίας
Όταν σε μόριο, το οποίο υπάρχει ζεύγος ηλεκτρονίων που μοιράζεται μεταξύ δύο ατόμων (ομοιοπολικός δεσμός) , μπορεί να δημιουργούνται δυο τμήματα στο μόριο αυτό, όπου το κοινό τους θέμα να είναι τα ηλεκτρόνια που διαμοιράζονται ή που μετακινούνται. Αν το ένα από τα δύο αυτά μισά έχει "όφελος" από την σύνδεση αυτή λόγω της δομής του , η διαμόρφωση των ηλεκτρομαγνητικών συνθηκών στην περιοχή του, αναγκάζει τα ηλεκτρόνια να κινουνται περισσοτερο αυτήν την περιοχή από ότi στην άλλη που βρίσκεται στο άλλο μισό μέρος του μορίου
HCOOH <--> CO2 +H2 ΔG= -34,3kj/mol
CO2 +H2 <--> HCOOH ΔG=34,3kj/mol
Στο HCOOH τα ηλεκτρόνια του υδρογόνου κερδίζει κυρίως η περιοχή του CO2
Αυτό έχει σαν αποτέλεσμα την εμφάνιση μιας διαφοράς δυναμικού μεταξύ των δυο μισών του μορίου που επιρρεάζει το ηλεκτρόνια που θα κινηθούν μέσα σε αυτό το πεδίο από το μέρος με το υψηλό δυναμικό προς αυτό με το χαμηλό που μπορεί να καταλήξει σε πόλωση του μορίου ή και διάσπαση του.
Δηλαδή έχουμε παραγωγή έργου, απελευθέρωση ενέργειας και μείωση της ηλεκτροχημικής ενέργειας των ηλεκτρονίων μέσα στο ίδιο το μόριο ή στα τμήματα του

Συνέπεια αυτού είναι το συνολικό δυναμικό της ανηγμένης και της οξειδωμένης μορφής μιας ουσίας να είναι διαφορετική και μεταξύ τους να εμφανίζεται επίσης μια διαφορά δυναμικού.
Πότε οι ουσίες της τροφής ελευθερώνουν χημική ενέργεια ;
Πως αυτό συνδέεται με τις βιολογικές οξειδώσεις σε διάφορα στάδια του μεταβολισμού;
Τα προβλήματα που πρέπει να επιλυθούν κατά τις οξειδοαναγωγικές διαδικασίες στον οργανισμό ειναι:
1. Πως να γίνει η μεταφορά των ηλεκτρονίων μεταξύ των σωμάτων μη αντιστρεπτά και να καταλήξουν αυτά στο οξυγόνο που θα εισέλθει από το αναπνευστικό σύστημα και μέσω του αίματος θα εισέλθει στα κύτταρα.
2. Πως στον οργανισμό συμβαίνουν αντιδράσεις όπου μια ένωση οξειδώνεται ή ανάγεται εις βάρος κάποιας άλλης
3. Πως η αποθηκευμένη ενέργεια των τροφών στον οργανισμό να μετατραπεί σε ενέργεια που ο οργανισμός μπορεί να χρησιμοποιήσει , που είναι η χημική ενέργεια των φωσφορικών δεσμών της τριφωσφορικής αδενοσίνης.
Η ελευθέρωση ενέργειας από τις ουσίες της τροφής (υδατάνθρακες, λίπη, πρωτείνες για τον ανθρώπινο οργανισμό) συνδέεται με τις οξειδώσεις των ουσιών αυτών. 
Ο τρόπος αυτός της μεταφοράς ηλεκτρονίων όμως οφείλεται στην δημιουργία περιοχών διαφορετικού δυναμικού (με συνέπει την μετακίνηση ηλεκτρονίων) σε ένα μορίο , σε άτομο και το ιόν , σε συμπλέγματα μορίων κ.λ.π. και σε μετατροπές
που κατευθύνονται σε
Στις οξειδοαναγωγικές αντιδράσεις έχουμε ανάπτυξη δυναμικού μεταξύ περιοχών του πεδίου των αντιδράσεων, όπως, στις αντιδράσεις της αναπνευστικής αλυσίδας και της οξειδωτικής φωσφορυλίωσης, αναπτύσεται τάση εκατέρωθεν και κατά μήκος της μιτοχονδριακής μεμβράνης με αντίστοιχο αποτέλεσμα.
Πολλές φορές η μετακίνηση των ηλεκτρονίων, συμβαίνει περισσότερες από μια φορά, σε πολλά σώματα διαδοχικά από το ένα στο επόμενο
Τα ηλεκτρόνια μεταφέρονται από το πρώτο στο επόμενο και μετά στο μεθεπόμενο .ο.κ. ώστε έχουμε αλύσίδες μεταφοράς ηλεκτρονίων
Μέσα στις σειρές οξειδοαναγωγικών αντιδράσεων παρεμβάλονται σώματα τα ένζυμα που οξειδώνονται και ανάγονται με σκοπό να διευκολύνουν ή να επιταχύνουν αυτές.
Τα ένζυμα για την διακίνηση των ηλεκτρονίων ή των ισοδυνάμων αναγωγής (Η+) υποβοηθούνται από συνένζυμα ή προσθετικές ομάδες.
Τέτοια είναι:
1. NAD και NADP( Πυριδινονουκλεοτίδια) χρησιμοποιείται σαν συνένζυμο στις δευδρογονάσες ενδιάμεσος φορέας αναγωγικών ισοδυνάμων
Το δυναμικό της οξειδαναγωγής της είναι Εο = -0,320 V . Το δυναμικό αυτό προσεγγίζει το δυναμικό πολλών βιολογικών οξειδώσεων και για αυτό χρησιμοποιείται πολύ στους βιολογικούς μεταβολικούς κύκλους .Π.χ. CH3COCOO-/CH3COHCOO- με Εο = - 0,19V (πυροσταφυλικό προς γαλακτικό) ή
-OOC-CH2CH2COCOO- + NH4+ / -OOC-CH2CH2CHNH3+COO- Ε= -0,14V (α κετογλουταρικό = ΝΗ4 / γλουταμινικό)
2. φλαβοπρωτείνες (FAD και FMN) αποτελούν προσθετικές ομάδες στερεά συνδεδεμένες με τα ένζυμα, που μεταφέρουν ένα ή δύο αναγωγικά ισοδύναμα.
Ακομη πολές από αυτές περιέχουν και μέταλλα απαραίτητα για καταλυτική δράση όπως Fe, Mo, Zn k.a.
Το μόριο του ενζύμου μπορεί να φέρει μια ή περισσότερες ομάδες φλαβοπρωτεινών και μέταλλα
Μεταλλοπρωτείνες Χαλκοπρωτείνες Για τις χαλκοπρωτείνες ο μόνος αποδέκτης ηλεκτρονίων είναι το οξυγόνο γιατί το δυναμικό τους είναι αρκετά υψηλό Εο =0,35V. (Ενώ το 1/2 Ο2 / Η2Ο με Εο = 0,80 V)
Το HCN kai το CO2 εάν αυτά εισέλθουν στον οργανισμό δεσμεύονται ισχυρότερα από το οξυγόνο από τις χαλκοπρωτείνες της αναπνευστικής αλυσίδας
με αποτέλεσμα πρόκληση δηλητηριάσεωνις
3. κυττοχρώματα
Παράδειγματα διαδοχικών μετακινήσεων ηλεκτρονίων
1. οι ελεύθερες ρίζες και η επίδρασή τους σε βιομόρια μαζύ με τις αντιοξειδωτικές ουσίες που συμμετέχουν για να τερματίσουν την αλυσίδα των διαδοχικών οξειδώσεων.
2. Στην αναπνευστικής αλυσίδας. η μετακίνηση των ηλεκτρονίων στα μιτοχόνδρια προς το τελικό οξειδωτικό μέσω ενδιάμεσων φορέων
τελικά οδηγούμαστε ,
από την οξειδαναγωγική ουσία στα οξειδοαναγωγικά συστήματα
Έτσι στους ιστούς δεν συναντάμε απομονωμένα οξειδούμενα ή αναγώμενα σώματα, αλλά συστήματα σωμάτων στα οποία ηλεκτρόνια μεταφέρονται από το ένα στο άλλο με ταυτόχρονες οξειδώσεις και αναγωγές και αυτά λέγονται οξειδοαναγωγικά συστήματα και όπου
αυτή η μεταφορά ηλεκτρονίων, συνδεέται με την μεταφορά της χημικής ενέργειας.
Τέτοια συστήματα είναι:
1. NAD και NADP( Πυριδινονουκλεοτίδια)
2. φλαβοπρωτείνες (FAD και FMN
3. κυττοχρώματα
4. ασκορβικό οξύ και δευδροασκορβικό οξύ
5. γλουταθείο
6. λιποικό οξύ και δευδρολιποικό οξύ
7. σύστημα κατεχόλης και ο-κινόνης
για την δράση τους βλέπε
Στα συστήματα αυτά η μεταφορά ηλεκτρονίων γίνεται σε τρία στάδια.
Το πρώτο στάδιο είναι η απόσπαση ατόμων υδρογόνου από ορισμένες ενώσεις με συνέπεια την οξείδωσή των ενώσεων αυτών. Οι αποσπάσεις των ηλεκτρονίων και η οξειδώσεις των ενώσεων, γίνονται ενζυμικά και (εάν δεν προσληφθεί το υδρογόνο από το οξυγόνο με εζυμική υποστήριξη μιας αερόβιας δευδρογονάσης) ή παραλαμβάνεται από ενδιάμεσους φορείς των οξειδοαναγωγικών συστημάτων στην δεύτερη φάση . Στα παράδειγματα οξειδοαναγωγικών αντιδράσεων μεταξύ πυροσταφυλικού και και μεταξύ ισοκιτρικού και α κετογλουταρικού τα υδρογόνα μεταφέρονται σε ενδιάμεσες ενώσεις των οξειδοαναγωγικών συστημάτων όπως είναι το NAD και NADP.
Στο τελικό στάδιο το υδρογόνο ενώνεται με το οξυγόνο
Να σημειώσουμε εδώ ότι η ηλεκτρομαγνητική ενέργεια που μεταφέρεται από το ένα σώμα στο άλλο μέσω των ηλεκτρόνιων δεν είναι πάντα ίδιας ποσότητας,
Έτσι , στην αναπνευστική αλυσίδα (το σημαντικότερο οξειδοαναγωγικό σύστημα στον οργανισμό) το μεταφερόμενο ζευγάρι των ηλεκτρονίων, που μεταφέρεται κατά μήκος της, όταν περνάει από το οξειδοαναγωγικό ζεύγος NADH/NAD που έχει υψηλό δυναμικο οξειδοαναγωγής Εο= -320mV σε περνώντας στην συνέχεια σε άλλα οξειδοαναγωγικά ζεύγη όπως σε ανηγμένες κα οξειδωμένες μορφές κυτοσωμάτων (cyta, cyta3, cytc1, cytb)
Τα κυταχρώματα είναι ένζυμα που καταλύουν παρουσία σιδήρου της αίμης. Τα δυναμικά οξειδαναγωγής τους κυμαίνονται από Εο= 290mV έως Εο = 50 mV
Στην τελική του το ζεύγος των ηλεκτρονίων καταλήγει στο οξυγόνο που μεταφέρεται στην περιοχή του κυττάρου από τους πνε'υμονες μέσω του αίματος.
Το οξειδοαναγωγικό ζευγάρι νερό/ οξυγόνο Η2Ο/Ο2 το δυναμικό του οξειδαναγωγικού ζεύγους κατεβαίνει στο +810mV. Το ένζυμο που είναι κατάλληλο για να καταλύσει την αντίδραση πρέπει να έχει παραπλήσιο δυναμικό οξειδοαναγωγής. Τέτοια ένζυμα είναι φλαβοπρωτείνες που περιέχουν ιόντα χαλκού που λέγοντΑΙ χαλκοπρωτείνες που είδαμε με δυναμικό αρκετά υψηλό Εο =0,35V. (Ενώ το 1/2 Ο2 / Η2Ο με Εο = 0,80 V)
Η σχέση περιγράφεται ακόμα καλύτερα με την εισαγωγή της έννοια του δυναμικού οξειδοαναγωγής.αυτά
Ανάπτυξη Διαφοράς δυναμικού μεταξύ περιοχών του κυττάρου - Μεταφορά ηλεκτρονίων
ΑΝΑΠΝΕΥΣΤΙΚΗ ΑΛΥΣΙΔΑ

Α. Διαφορά δυναμικού εκατέρωθεν της μιτοχονδριακής μεμβράνης (κλίση) με αποτέλεσμα την μετακίνηση ηλεκτρονίων από τα ανηγμένα συνένζυμα NADH και FADH2
Τα NADH και FADH2 οξειδώνονται το μεν πρώτο από το σύμπλεγμα Ι σε NAD, το δε FADH2 αποδείδει ηλεκτρόνια απευθείας στο βοηθητικό υπόστρωμα της ουβικινόνης
Τα ηλεκτρόνια από τα ανηγμένα συνένζυμα εξάγονται στο εξωτερικό μέρος της εσωτερικής μεμβράνης των μιτοχονδρίων από τα σύμπλοκα Ι, ΙΙΙ, ΙV, με συνέπεια να
δημιουργείται διαφορά δυναμικού μεταξύ των δύο πλευρών της μεμβράνης
Β. Ανάπτυξη διαφοράς δυναμικού κατά μήκος της μεμβράνης λόγω διαφορετικής διαφοράς ηλεκτροχημικού δυναμικού μεταξύ των οξειδοαναγωγικών ζεύγων που βρίσκονται στα σύμπλοκα και τους μεταφορείς της αναπνευστικής αλυσυδας
Αυτό σχετίζεται κάθε φορά με την διαφορετικής ενέργειας ( υψηλής ή λιγότερο) του ζεύγους των ηλεκτρονίων που μεταφέρονται και διαφέρει στα διάφορα ζεύγη των οξειδωτικών/ αναγωγικών σωμάτων που συμμετέχουν στην σλυσίδα.
Έτσι, η διαφορά δυναμικού (δυναμικό οξειδοαναγωγής) μεταξύ οξειδωμένης και ανηγμένης μορφής στην αναπνευστική αλυσίδα των μιτοχονδρίων
διαφέρει όσο προχωράμε από τα ανηγμένα συένζυμα προς το οξυγόνο.
Έτσι , στην αναπνευστική αλυσίδα (το σημαντικότερο οξειδοαναγωγικό σύστημα στον οργανισμό) το μεταφερόμενο ζευγάρι των ηλεκτρονίων, που μεταφέρεται κατά μήκος της, όταν περνάει από το οξειδοαναγωγικό ζεύγος NADH/NAD που έχει υψηλό δυναμικο οξειδοαναγωγής Εο= -320mV σε περνώντας στην συνέχεια σε άλλα οξειδοαναγωγικά ζεύγη όπως σε ανηγμένες κα οξειδωμένες μορφές κυτοσωμάτων (cyta, cyta3, cytc1, cytb)
Τα κυταχρώματα είναι ένζυμα που καταλύουν παρουσία σιδήρου της αίμης. Τα δυναμικά οξειδαναγωγής τους κυμαίνονται από Εο= 290mV έως Εο = 50 mV
Στην τελική του το ζεύγος των ηλεκτρονίων καταλήγει στο οξυγόνο που μεταφέρεται στην περιοχή του κυττάρου από τους πνε'υμονες μέσω του αίματος.
Το οξειδοαναγωγικό ζευγάρι νερό/ οξυγόνο Η2Ο/Ο2 το δυναμικό του οξειδαναγωγικού ζεύγους κατεβαίνει στο +810mV. Το ένζυμο που είναι κατάλληλο για να καταλύσει την αντίδραση πρέπει να έχει παραπλήσιο δυναμικό οξειδοαναγωγής. Τέτοια ένζυμα είναι φλαβοπρωτείνες που περιέχουν ιόντα χαλκού που λέγοντΑΙ χαλκοπρωτείνες που είδαμε με δυναμικό αρκετά υψηλό Εο =0,35V. (Ενώ το 1/2 Ο2 / Η2Ο με Εο = 0,80 V)
Αυτή η διαφορά δυναμικού έχει σαν επακόλουθο την κίνηση ηλεκτρονίων και την απελευθέρωση ενέργειας στην αναπνευστική αλυσίδα
Παλιότερα οι οξειδοαναγωγικές αντιδράσεις που εξηγούνται τώρα με τα δυναμικά οξειδοανάγωγής περιγράφονταν διαφορετικά
Μια άλλη περιγραφή αυτού του δυσνόητου θέματος γίνεται με τον αριθμό οξείδωσης
από Βικιπαίδεια μεταφορά
Ο αριθμός οξείδωσης ή βαθμίδα οξείδωσης ή τυπικό σθένος ενός χημικού στοιχείου σε ένα χημικό είδος είναι ένας αριθμητικός δείκτης που αντιστοιχεί στο αλγεβρικόάθροισμα του πραγματικού ηλεκτρονιακού φορτίου που αποκτά το (πρώην) άτομο όταν (τυχόν) σχηματίζει ιόν και κατ' επέκταση ιοντικούς δεσμούς[1] και του φαινομενικού ηλεκτρονιακού φορτίου που αποκτά το άτομο όταν ενώνεται (επίσης τυχόν) ομοιοπολικά με άτομα άλλων στοιχείων, αν τα κοινά ζεύγη ηλεκτρονίων θεωρηθούν ότι αποδίδονται στο ηλεκτραρνητικότερο[2] απ'αυτά,[3] παρ' όλο που στην πραγματικότητα αυτό ποτέ δεν είναι απόλυτα αληθές.
Στο προπάνιο για παράδειγμα ο άνθρακας που θα οξειδωθεί στο προπάνιο, έχει αριθμό οξείδωσης -2 ενώ μετά αντίδραση οξειδοαναγωγής, κατά την οποία μπορεί να μεττρέπεται σε ακετονη ο ίδιος άνθρακας έχει αριθμό οξείδωσης +2 (μεταβολή κατά 4 δηλαδή απομάκρυνση 2+2=4 ηλεκτροίων: 2 ηλεκτρονίων από τον άνθρακα μαζύ με τα 2 υδρογόνα , ενώ τα άλλα 2 του άνθρακα προσεγγίζουν προς το οξυγόνο που τα έλεκει περισότερο.


Καταλήγοντας
Έτσι οι οξειδώσεις χάνουν την ιδέα της ένωσης ενός μεταβολίτη με το οξυγόνο αποκλειστικά, και τα ηλεκτρόνια που μετακινούνται μπορούν να προσλαμβάνονται από άλλες ενώσεις όπως νερό ή φωσφορικό οξύ.
Ακόμα και η μεταβολή της απόστασης των ηλεκτρονίων προσέγγιση ή η απομάκρυνση από πυρήνα, έχει αποτέλεσμα την μεταβολή στο δυναμικό των ατόμων.
Οι οξειδώσεις σε βιολογικες ουσίες των τροφών γίνεται με διάσπαση τους μέσ στον οργανισμό.
C2H6 + H2 --> 2CH4 ΔG = -32,8kj/mol
αυτό έπρεπε να ενεργοποιηθεί και αυτή η ενεργοποίηση γίνονταν από κάποιους καταλύτες που βρίσκονταν στους ιστούς. (ένζυμα )
Δήμητρα Σπανού
ΠΗΓΕΣ
ΣΗΜΕΙΩΣΕΙΣ ΒΙΟΛΟΓΙΚΗΣ ΧΗΜΕΙΑΣ Α. ΓΡΑΝΙΤΣΑΣ
ΙΑΤΡΙΚΗ ΧΗΜΕΙΑ Κ. ΜΟΙΡΑΣ
https://eclass.upatras.gr/modules/document/file.php/GEO360/%CE%94%CE%99%CE%91%CE%9B%CE%95%CE%9E%CE%97%2010.pdf
https://www.chimicamo.org/chimica-organica/ossidazioni-nelle-reazioni-organiche.html
https://el.wikipedia.org/wiki/%CE%91%CF%81%CE%B9%CE%B8%CE%BC%CF%8C%CF%82_%CE%BF%CE%BE%CE%B5%CE%AF%CE%B4%CF%89%CF%83%CE%B7%CF%82
cytochrome-c oxidase
akatergasto



https://www.google.com/patents/WO2008134871A1
Lecture 4: |
Glucose isomerase, aldolase, glyceraldehyde-3-phosphate dehydrogenase and enolase reaction mechanisms. |
| Mon Sept 18 | Voet Chapter 16, pp. 447-464. Mathews, Van Holde: Chapter 13 pp. 450-459. Stryer Chapter 19, pp. 484-489. |

Hexokinase
The required substrate is MgATP2-, and ATP4- inhibits the reaction. Mg2+ partly neutralizes the charge of the phosphate, making it a better target for the weakly nucleophilic O-6 of glucose.
 The glucose-6-phosphate isomerase mechanism is similar to the enediolate mechanism of isomerization of aldoses which occurs in strongly basic solution. The non-enzymic is not stereospecific, and mannose-6-P is produced as a product in addition to fructose-6-P and glucose-6-P. The pH/activity profile of glucose-6-phosphate isomerase shows a bell-shape with pKa at 6.7 and 9.3, corresponding to Glu and Lys. From crystal structures of the enzyme Lys acts to open the pyranose or furanose ring system, while glu acts to abstract H from the alpha carbon, forming the enediolate intermediate. A histidine may assist in stabilizing the anion.
The glucose-6-phosphate isomerase mechanism is similar to the enediolate mechanism of isomerization of aldoses which occurs in strongly basic solution. The non-enzymic is not stereospecific, and mannose-6-P is produced as a product in addition to fructose-6-P and glucose-6-P. The pH/activity profile of glucose-6-phosphate isomerase shows a bell-shape with pKa at 6.7 and 9.3, corresponding to Glu and Lys. From crystal structures of the enzyme Lys acts to open the pyranose or furanose ring system, while glu acts to abstract H from the alpha carbon, forming the enediolate intermediate. A histidine may assist in stabilizing the anion.

In animal aldolase type I, the inherent reactivity of the carbonyl is enhance by converting to the more reactive Schiff base. Type II aldolases of bacteria and fungi use Zn2+ to enhance the polarization of the existing carbonyl.
For Type I aldolase, the side chain amino group of lysine acts as the N-donor. Deprotonation of O-4 is mediated by a tyrosine phenolate ion acting as a weak base.

Glyceraldehyde-3-P dehydrogenase couples the strongly exergonic oxidation of an aldehyde, but traps the energy of oxidation by making a high energy phosphate ester. The enzyme first forms a thiohemiacetal, then oxidizes this to yield an energy rich thioester. The thioester is then displaced by inorganic phosphate.
 Phosphoglycerate mutase contains an energy-rich histidine-phosphate (His-8), which acts as donor to make 2,3-bisphosphoglycerate. The 3-phosphate is then transferred to the histidine to release 2-phosphoglycerate as product.
Phosphoglycerate mutase contains an energy-rich histidine-phosphate (His-8), which acts as donor to make 2,3-bisphosphoglycerate. The 3-phosphate is then transferred to the histidine to release 2-phosphoglycerate as product.
Enolase forms a strong base by proximity of a water molecule bound to a pair of glutamates. This deprotonates to initiate the dehydration via a c
arbanion int
ermediate.

