ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ Ομάδας Προσανατολισμού Θετικών Σπουδών Κεφ4 ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ
Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιά, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος να έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη της φετινής σχολικής χρονιάς
Δήμητρα Σπανού
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2016-2017 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
Κεφάλαιο4 «ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ» Εισαγωγή Παρ. «Έννοια χημικής ισορροπίας-Απόδοση αντίδρασης» Παρ. «Παράγοντες που επηρεάζουν τη θέση χημικής ισορροπίας – Αρχή Le Chatelier» Από την παρ. «Σταθερά χημικής ισορροπίας Kc – Kp» μόνο η υποενότητα «Σταθερά χημικής ισορροπίας Kc» χωρίς την Κινητική απόδειξη του νόμου χημικής ισορροπίας. Παρατήρηση: Δεν θα διδαχθούν τα παραδείγματα και οι ασκήσεις που απαιτούν γνώση της έννοιας μερική πίεση αερίου και του Νόμου μερικών πιέσεων του Dalton.
ΜΕΡΟΣ ΠΡΩΤΟ
(σελ 103 ) ΕΙΣΑΓΩΓΉ
Εάν κατά την διεξαγωγή των χημικών αντιδράσεων το σύνολο των αντιδρώντων μετατρέπεται στα προιόντα, τότε λέμε ότι έχουμε μια αντίδραση μονόδρομη ή ποσοτική , παράδειγμα η οξείδωση του μαγνησίου 2Mg(s) + O2 (g) 2MgO(s).

Στις περισσότερες όμως χημικές αντιδράσεις δεν συμβαίνει αυτό. Οι περισσότερες χημικές αντιδράσεις , εφ όσον αρχίζουν να σχηματίζονται τα προιόντα, προχωρούν και προς τις δυο κατευθύνσεις και λέγονται αμφίδρομες αντιδράσεις.και λέγονται αμφίδρομες αντιδράσεις.
Πρακτικά, σε κάποια στιγμή ανάλογα με την αντίδραση, μετά το τέλος της , βρίσκονται ποσότητες και από τα προιόντα αλλά και από τα αντιδρώντα .
Με την προυπόθεση ότι δεν αλλάξουν οι συνθήκες διεξαγωγής του πειράματος, οι ουσίες αυτές παραμένουν ποσοτκά και ποιοτικά σταθερές.
Φαίνεται σαν να έχει σταματήσει η αντίδραση. Στην πραγματικότητα δεν συμβαίνει αυτό. Αυτό που γίνεται είναι ότι η αντίδραση προχωρά και προς τις δύο κατευθύνσεις με την ίδια ταχύτητα
Ένας άλλος τρόπος να επιρρεαστεί η χημική ισορροπία μιας χημικής αντίδρασης είναι η χρησιμοποίηση ουσιών που επιρρεάζουν την διεξαγωγή της (συνήθως επιταχύνουν τις αργές αντιδράσεις ) και λέγονται καταλύτες.
Οι αντιδράσεις επιρρεάζονται από τις συνθήκες και χρειάζεται ιδιέταιρη μελέτη σε κάθε περίπτωωση. Στην ύλη των εξετάσεων γίνεται η μελέτη τέτοιων αντιδράσεων μόνο όταν συμβαίνουν σε διαφορετικές θερμοκρασίες και δεν περιέχεται η περίπτωση των αντιδράσεων που διεξάγοντια υπό διαφορετικές πιέσεις
(103) ΕΝΝΟΙΑ ΤΗΣ ΧΗΜΙΚΗΣ ΙΣΟΡΡΟΠΙΑΣ. ΑΠΟΔΟΣΗ ΤΗΣ ΑΝΤΙΔΡΑΣΗΣ
Σε μια αμφίδρομη αντίδραση που καταλήγει σε χημική ισορροπία, είναι απαραίτητο, να ξέρουμε που καταλήγει η ισορροπία αυτή.
Για να μελετήσουμε την χημική ισορροπία, μετράμε συνήθως, τις ποσότητες των αντιδρώντων και των προιόντων που παραμένουν σταθερές στο τέλος της αντίδρασης, σαν συγκεντρώσεις , συνήθως σε mol/lt. Στην αμφίδρομη χημική αντίδραση H2(g) + I2(g) ⇔ 2HI (g). μελετάμε την πορεία της προς την μια κατεύθυνση και προς την άλλη , μετρώντας τις συγκεντρώσεις και φτιάχνοντας διαγράμματα
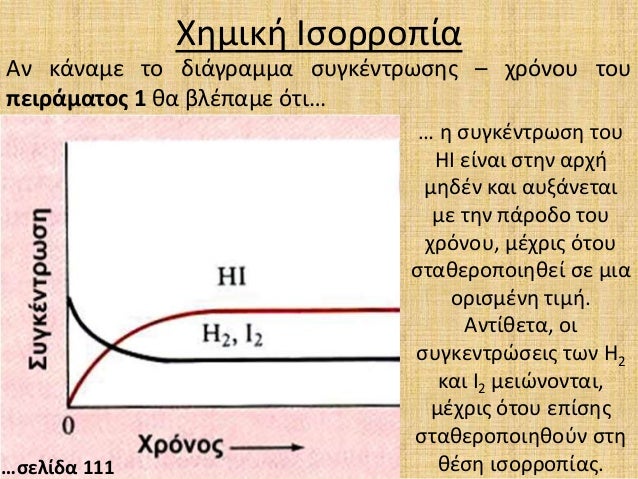
Α. H2(g)+I2(g) 2HI(g) Εάν μελετήσουμε την αντίδραση κατά την κατεύθυνση της σύνθεσης του υδροιώδιου, βλέπουμε στα διαγράμματα συγκεντρώσεων - χρόνου , ότι οι συγκεντρώσεις του H2(g) και του I2(g) μειώνονται έως ότου καταλήξουν σε μια σταθερή τιμή συγκεντρώσεων. Αντίθετα αυξάνεται η συγκέντωση του υδροιώδιου που παράγεται, έως ότου σταθεροποιηθούν οι συγκεντρώσεις και έχουμε την χημική ισορροπία
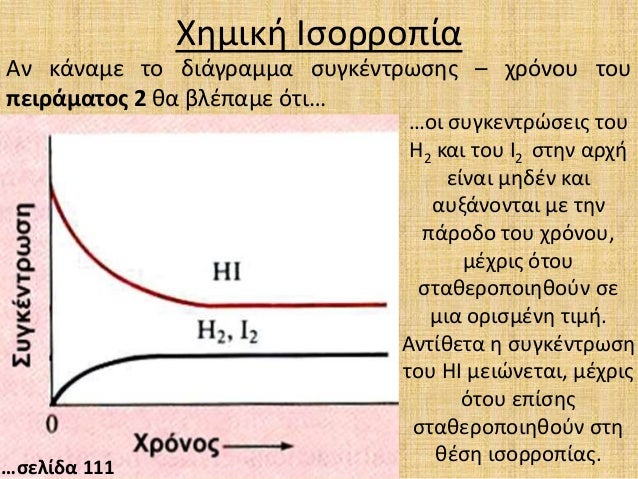 Β. 2HI(g) H2(g)+I2(g) Εάν μελετήσουμε την αντίδραση κατά την κατεύθυνση της διάσπασης του υδροιώδιου, βλέπουμε στα διαγράμματα συγκεντρώσεων - χρόνου, ότι η συγκέντρωση του HΙ(g) μειώνεται, έως ότου καταλήξουν σε μια σταθερή τιμή συγκεντρώσεων. Αντίθετα αυξάνεται η συγκέντρωση του ιώδιου και του υδρογόνου που παράγονται . Όταν σταθεροποιηθούν οι συγκεντρώσεις έχουμε την χημική ισορροπία.
Β. 2HI(g) H2(g)+I2(g) Εάν μελετήσουμε την αντίδραση κατά την κατεύθυνση της διάσπασης του υδροιώδιου, βλέπουμε στα διαγράμματα συγκεντρώσεων - χρόνου, ότι η συγκέντρωση του HΙ(g) μειώνεται, έως ότου καταλήξουν σε μια σταθερή τιμή συγκεντρώσεων. Αντίθετα αυξάνεται η συγκέντρωση του ιώδιου και του υδρογόνου που παράγονται . Όταν σταθεροποιηθούν οι συγκεντρώσεις έχουμε την χημική ισορροπία.
 Στην πραγματικότητα αυτές οι δυο αντιδράσεις γίνονται ταυτόχρονα κατά την ένν H2(g) + I2(g) ⇔ 2HI (g).Μόλις αρχίζει ο σχηματισμός κάποιων μορίων υδροιωδίου αρχίζει ταυτόχρονα και η διάσπασή τους προς την αντίθετη κατεύθυνση αλλά με διαφορετική ταχύτητα από εκείνη της παρασκευής τους.
Στην πραγματικότητα αυτές οι δυο αντιδράσεις γίνονται ταυτόχρονα κατά την ένν H2(g) + I2(g) ⇔ 2HI (g).Μόλις αρχίζει ο σχηματισμός κάποιων μορίων υδροιωδίου αρχίζει ταυτόχρονα και η διάσπασή τους προς την αντίθετη κατεύθυνση αλλά με διαφορετική ταχύτητα από εκείνη της παρασκευής τους.
Εάν φτιάξουμε το διάγραμμα ταχύτητας αντίδρασης -χρόνου και προς τις δύο κατευθύνσεις, θα διαπιστώσουμε , ότι με τον χρόνο η ταχύτητα σχηματισμού και η ταχύτητα διάσπασης εξισώνονται. και από εκεί και μετά ισχύει η χημική ισορροπία της αντίδρασης.
Θεωρητικά όλες οι χημικές αντιδράσεις καταλήγουν σε χημική ισορροπία. Όσον αφορά τις μονόδρομες που αναφέρθηκαν στην αρχή θεωρείται ότι ένα τουλάχιστον από τα αντιδρώντα είναι σε ίχνη έτσι που δεν ανιχνεύονται.
Ακόμα η Χημική ισορροπία μπορεί να είναι ομογενής όταν όλα τα σώματα που συμμετέχουν στην ισορροπία βρίσκονται στην ίδια φάση, π.χ. ( N2(g)+3H2(g) <= > 2ΝΗ3(g) ) ή ετερογενής όταν τα σώματα που συμμετέχουν στην ισορροπία βρίσκονται σε περισσότερες από μια φάσεις π.χ. CaCO3(s) ->CaO(s)+CO2(g)
ΑΠΟΔΟΣΗ ΤΗΣ ΧΗΜΙΚΗΣ ΑΝΤΙΔΡΑΣΗΣ
Σε μια μονόδρομη ποσοτική αντίδραση η ποσότητα των προιόντων που θα πάρουμε είναι αυτή που θα προκύψει εάν αντιδράσει το σύνολο των αντιδρώντων και δώσει τα αναμενώμενα προιόντα. Λέμε τότε ότι έχουμε απόδοση της αντίδρασης 100% ή ότι ο συντελεστής της απόδοσης α είναι 1. Συνήθως όμως οι αντιδράσεις δεν είναι ποσοτικές.
Στις αμφίδρομες αντιδράσεις εάν μετρήσουμε τις ποσότητες των προιόντων στην κατάσταση ισορροπίας θα τις βρούμε λιγότερες από αυτές που θα πέρναμε θεωρητικά εάν το σύνολο των αντιδρώντων μετατρέπονταν σε προιόντα.
Ο συντελεστής της απόδοσης (α) της αντίδρασης είναι η ποσότητα της ουσίας που σχηματίζεται πρακτικά / την ποσότητα της ουσίας που θα σχηματιζόταν θεωρητικά, αν η αντίδρσαη ήταν ποσοτική. Αριθμητικά είναι μεταξύ του ) και του 1.
Η απόδοση της αντίδρασης είναι α.100%
ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΕΠΙΡΡΕΑΖΟΥΝ ΤΗΝ ΘΕΣΗ ΤΗΣ ΧΗΜΙΚΗΣ ΙΣΟΡΡΟΠΙΑΣ. ΑΡΧΗ LE CHATELIER
Όταν ένα σύστημα καταλήξει σε χημική ισορροπία, οι ποσότητες των αντιδρώντων και των προιόντων που υπάρχουν στην κατάσταση αυτή, παραμένουν σταθερές (δημιουργούνται βέβαια διαρκώς, νέες ποσότητες αντιδρώντων και προιόντων, εφ όσον η αντίδραση συνεχίζεται και προς τις δυο κατευθύνσεις με την ίδια ταχύτητα).
Εάν όμως μεταβληθεί κάποιος παράγοντας αυτής της ισορροπίας (θερμοκρασία, Πίεση, Συγκεντρώσεις ) τότε η ισορροπία μετατοπίζεται σε άλλο σημείο και οι ποσότητες των σωμάτων στην νέα ισορροπία είναι διαφορετικές.
Η αντίδραση μεταβαίνει σε νέα ισορροπία με την αλλαγή των ταχυτήτων προς την μια ή την άλλη κατεύθυνση, έως ότου αυτές οι ταχύτητες εξισωθούν ξανά και προκύψει η νέα ισορροπία
Οι αντιδράσεις εξελίσονται ώστε κάποια στιγμή σύντομα ή αργά φτάνουν στην κατάσταση της Χημικής Ισορροπίας. Αυτό που είναι χαρακτηριστικό στην κατάσταση ΧΙ είναι πως οι ποσότητες των αντιδρώντων και των προιόντων που υπάρχουν παραμένουν σταθερές.
Αυτό που συμβαίνει είναι η αντίδραση προχωρά συνεχώς ,αλλά και προς τις δυο κατευθύνσεις με ίσες ταχύτητες .
Ποιες είναι όμως αυτές οι ποσότητες των αντιδρώντων και των προιόντων μιας αντίδρασης που υπάρχουν σε κατάσταση ισορροπίας;
Αποδεικνύεται πως οι ποσότητες αυτές των αντιδρώντων και προιόντων στην κατάσταση ισορροπίας δεν είναι πάντα οι ίδιες αλλά εξαρτώνται από 3 παράγοντες : Τις αρχικές συγκεντρώσεις , την θερμοκρασία και την πίεση
Εάν αυτές ή έστω μια από αυτές αλλάξει τότε το σύστημα φεύγει από την θέση ισορροπίας, οι ταχύτητες προς την μια και την άλλη κατεύθυνση γίνονται διαφορετικές και αυτό συνεχίζεται έως ότου οι ταχύτητες εξισωθούν ξανά και έρθει μια διαφορετική καινούργια ισορροπία.
Προς τα που όμως θα είναι η νέα ισορροπία και ποιες θα είναι οι νέες ποσότητες των σωμάτων της χημικής αντίδρασης
Εδώ ισχύει η αρχή του Le Chatelier ( αρχή της φυγής προ της βίας)
Εάν μεταβάλλουμε έναν από τους συντελεστές της ισορροπίας η ισορροπία μεταβάλλεται και η θέση της μετατοπίζεται προς εκείνη την κατεύθυνση που θα μπορέσει να αναιρέσει την μεταβολή αυτή
1. Μεταβολή της θερμοκρασίας
Ας υποθέσουμε ότι έχουμε την αντίδραση από τα αριστερά προς τα δεξιά που είναι εξώθερμη με ΔΗ<0 . Επομένως στην αντίθετη κατεύθυνση είναι ενδόθερμη , δηλαδή απορροφά θερμότητα)
2SO2(g) + O2(g) <= > 2SO3(g) ΔΗ = -198 kJ (εξώθερμη)
τότε εάν αυξήσουμε την θερμοκρασία θα ευνοηθεί προς αριστερά (ενδόθερμη) και θα αυξηθεί η ταχύτητά της έναντι της ταχύτητας της αντίδραση προς τα δεξια. Έτσι θα απορροφηθεί η πρόσθετη θερμότητα και θα αναιρεθεί αυτή η εξωτερική μεταβολή (αύξηση της θερμοκρασίας).
Αντίθετα εάν αυτή η διπλής κατεύθυνσης αντίδραση διεξάγεται σε συνθήκες ψύχους θα προχωρήσει γρηγορότερα προς τα δεξιά. (έχουμε παρατηρείσει πόσο γρήγορα καίγονται τα καυσόξυλα όταν ο καιρός είναι κρύος)
2. Μεταβολή στην Πίεση
Η μεταβολή στην πίεση σε μια αντίδραση αμφίδρομη που βρίσκεται σε κατάσταση χημικής ισορροπίας έχει νόημα μόνο εάν έχουμε ένα ή περισσότερα αέρια σώματα που συμμετέχουν στην αντίδραση. π.χ. N2(g)+3H2(g) <= > 2NH3(g)
Την πίεση μπορούμε να αυξήσουμε ελαττώνοντας τον όγκο κλειστου δοχείου μέσα στο οποίο βρίσκονται τα σώματα σε ισορροπία. Αντίθετα αν θέλουμε να την ελαττώσουμε αυξάνουμε τον όγκο.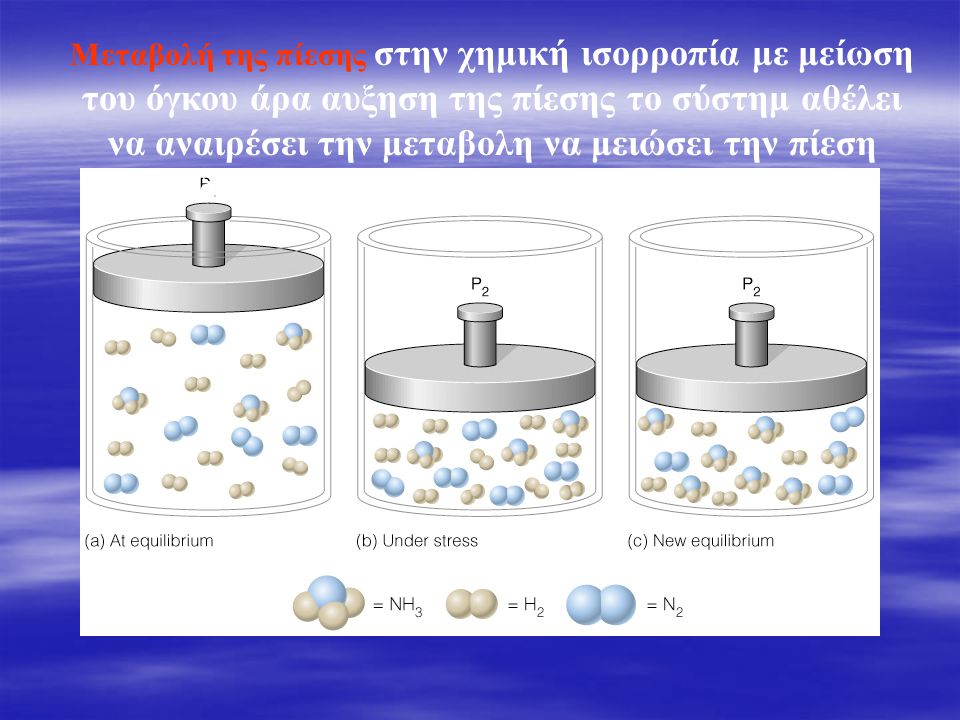
Επίσης για να υπάρξει μεταβολή στην χημική ισορροπία πρέπει να το άθροισμα των moles στο πρώτο και το δεύτερο μέλος της αντίδρασης να είναι διαφορετικά. Αυτό γιατί η πίεση που αναπτύσσεται (σε σταθερό όγκο και θερμοκρασία) εξαρτάται από τον αριθμό των moles . Αν το άθροισμα των moles στο πρώτο και δεύτερο σκέλος μιας αντίδρασης είναι ίδιο , τότε καμμιά διαφορά στην ισορροπία δεν φαίνεται ακόμα κι αν αλλάξει η πίεση.
3. Μεταβολή της συγκέντρωσης μιας ουσίας
 Μια εξωτερική μεταβολή της συγκέντρωσης ενός συστατικού σε ένα σύστημα που βρίσκεται σε ισορροπία, μετατοπίζει ανάλογα την ισορορροπία αυτήν. Εάν προσθέσουμε στο σύστημα που ισορροπεί μια ποσότητα από κάποιο από τα συστατικά της αντίδρασης, που είναι στο ένα σκέλος της,
Μια εξωτερική μεταβολή της συγκέντρωσης ενός συστατικού σε ένα σύστημα που βρίσκεται σε ισορροπία, μετατοπίζει ανάλογα την ισορορροπία αυτήν. Εάν προσθέσουμε στο σύστημα που ισορροπεί μια ποσότητα από κάποιο από τα συστατικά της αντίδρασης, που είναι στο ένα σκέλος της,
τότε,
η ταχύτητα της αντίδρασης από το σκέλος που προσθέσαμε προς το άλλο σκέλος αυξάνεται σχετικά. Έτσι, η ιρορροπία μετατοπίζεται προς την αντίθετη κατεύθυνση ώστε να "λιγοστέψει" αυτό που αυξήσαμε.
Το αντίθετο ακριβώς συμβαίνει αν αφαιρέσουμε μια ποσότητα ενός συστατικού από το ένα σκέλος. Τότε αυξάνει σχετικά η ταχύτητα από το αντίθετο σκέλος προς την μεριά που αφαιρέσαμε .
Σταθερά Χημικής Ισορροπίας
Σε μια κατάσταση χημικής ισορροπίας μας ενδιαφέρει να γνωρίζουμε
Α. Την ταχύτητα που προχωράει η αντίδραση προς την ισορροπία. Αυτό προυποθέται δυσκολους υπολογισμούς και απεικονίζεται σε διαγράμματα που έχουμε δει.
Β. Αν γνωρίζουμε την αρχική σύσταση , να βρούμε προς τα που θα προχωρήσει η αντίδραση και επίσης ποια θα είναι η τελική σύσταση του συστήματος στην κατάσταση ισορροπίας.
Εδώ χρησιμοποιούμε μια σταθερά που λέγεται σταθερά χημικής ισορροπίας . Διακρίνουμε σε Κc και Κp όταν τα σύστημα λειτουργεί σε σταθερή θερμοκρασία, και σταθερή πίεση αντίστοιχα
Σε μια ισορροπία αΑ(g) + βΒ (g) -> γΓ(g) + δΔ(g) ο λόγος του γινομένου των συγκεντρώσεων των προιόντων υψωμένων σε δύναμη ίση με τους συντελεστές τους προς γινομένου των συγκεντρώσεων των αντιδρώντων υψωμένων σε δύναμη ίση με τους συντελεστές τους για συγκεκριμένη θερμοκρασία είναι σταθερός

Η Κc ονομάζεται σταθερά χημικής ισορροπίας και εξαρτάται μόνο από την θερμοκρασία. Για μεγάλες τιμές της η ισορροπία είναι μετατοπισμένη προς τα δεξιά δηλαδή έχουμε αυξημένη απόδοση.
ΠΗΓΕΣ
ΧΗΜΕΙΑ Γ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ ΟΜΑΔΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ
https://ebooks.edu.gr/modules/ebook/show.php/DSGL-B130/472/3126,12567/
