Η ΧΗΜΕΙΑ ΓΥΡΩ ΜΑΣ. Κοινές ουσίες που διευκολύνουν την ζωή μας. Προστασία μετάλλων από την διάβρωση : Μεταλλικές Επικαλύψεις, Μη μεταλλικές επικαλύψεις, Χημικές Επικαλύψεις, Ηλεκτροχημική Προστασία
Δήμητρα Σπανού, χημικός, καθηγήτρια του 1ου Γυμνσίου Δάφνης
ΤΑ ΜΕΤΑΛΛΑ
Τα μέταλλα είναι μια μεγάλη κατηγορία από τα Χημικά Στοιχεία που εμφανίζουν γενικά κοινά χαρακτηριστικά στην χημική δομή και σύνδεση των ατόμων τους καθώς και παραπλήσιες μακροσκοπικές ιδιότητες
Διαθέτουν ένα έως τέσσερα ηλεκτρόνια στην εξωτερική στοιβάδα των ατόμων τους (ηλεκτρόνια σθένους) και χαμηλή ενέργεια ιοντισμού τους (δηλαδή η ικανότητά τους να απομακρύνουν αυτό το ηλεκτρόνιο ώστε να αποκτήσουν σταθερότερη δομή), που εξαρτάται από την θέση τους στον περιοδικό πίνακα.
 Συνέπεια αυτής της τάσης τους τα ηλεκτρόνια που απομακρύνονται κινούνται ανάμεσα σε θετικά ιόντα και όλο αυτό δημιουργεί μια ιδιαίτερη δομή που περιλαμβάνει μια ισχυρή σύνδεση ανάμεσα στα ελεύθερα ηλεκτρόνια και τα άτομα και κατιόντα που παραμένουν κι αυτό ονομάζεται μεταλλικό πλέγμα
Συνέπεια αυτής της τάσης τους τα ηλεκτρόνια που απομακρύνονται κινούνται ανάμεσα σε θετικά ιόντα και όλο αυτό δημιουργεί μια ιδιαίτερη δομή που περιλαμβάνει μια ισχυρή σύνδεση ανάμεσα στα ελεύθερα ηλεκτρόνια και τα άτομα και κατιόντα που παραμένουν κι αυτό ονομάζεται μεταλλικό πλέγμα
Συνέπεια όλων αυτών τα μέταλλα εμφανίζουν αυξημένα Σημεία Τήξης, σημαντική Θερμική και Ηλεκτρική Αγωγιμότητα, ικανότητα Ανάκλασης φωτός, Μεταλλική γυαλάδα, γίνονται Ελάσματα και Σύρματα
Η διάβρωση των μετάλλων
Πρότυπα Δυναμικά Οξείδωσης και Διάβρωση
Την ιδιότητα των μετάλλων να οξειδώνονται δηλαδή να μεταπίπτουν σε θετκά ιόντα, την μετράμε με τα ΠΡΟΤΥΠΑ ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΩΣΗΣ , που είναι η Διαφορά δυναμικού του συστήματος Me/ Mex+ και μπορεί να έχει θετική ή αρνητική τιμή (πίνακας 1 στο τέλος)
Η χημική αντίδραση είναι αντίδραση Οξειδοαναγωγής και γι αυτόν τον λόγο εισάγεται η έννοια του ΔΥΝΑΜΙΚΟΥ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ.
Οι ημιαντιδράσεις που σημειώνονται αποτελούν αντιδράσεις Αναγωγής των μετάλλων οι τιμές αποτελεί τα ΔΥΝΑΜΙΚΑ ΑΝΑΓΩΓΗΣ (πίνακας 2 στο τέλος)
Το ζεύγος του ιόντος του Μετάλλου και του Μετάλλου αυτού (Mex+/Me ) είναι ένα οξειδοαναγωγικό ζεύγος
Το Δυναμικό Αναγωγής έχει:
Zn(s) --> Zn2+ + 2e EZn2+/Zn = -0,76 V
Να έχει τιμή μηδέν (ουδέτερο), για μέταλλα με θερμοδυναμική αστάθεια, μεταξύ κάδμιου και υδρογόνου που διαβρώνονται μόνο σε όξινα περιβάλλοντα,
Να έχει θετική τιμή , για μέταλλα με ενδιάμεση θερμοδυναμική σταθερότητα, που είναι ανθεκτικά στη διάβρωση από υδρογόνο έως ράδιο.
Cu(s) --> Cu2+ + 2e- ECu2+/Cu = 0,34V
Αρνητική τιμή έχει για τα μέταλλα με υψηλή θερμοδυναμική αστάθεια από τα αλκαλια έως κάδμιο με πρότυπο δυναμικό Οξειδοαναγωγής Ε0 <0 που διαβρώνονται πολύ ευκολα,
Τα ευγενή μέταλλα χρυσός, άργυρος ιρίδιο και παλλάδιο έχουν υψηλή θερμοδυναμική σταθερότητα και δεν αλλοιώνονται, παρά μόνο σε ισχυρά οξειδωτικά περιβάλλοντα
Επιπλέον Παράγοντες που επιρρεάζουν την διάβρωση των μετάλλων
Λαμβάνοντας υπ' όψη τα Δυναμικά Οξείδωσης των μετάλλων, από τα οποία εξαρτάται και η αντοχή των μετάλλων στην διάβρωση συνυπολογίζουμε ακόμα τους
περιβαλλοντικές ουσίες, και
τις περιβαλλοντικές συνθήκες ηλεκτρολυτών.
επεξηγηματικά:
- Αυτό σημαίνει ότι όταν το μέταλλο έρχεται σε επαφή με περιβαλλοντικές ουσίες, (οξυγόνο του αέρα, οξέα νερό κ.α.) , αλληλοεπιδρά με αυτές και αλλοιώνεται, γιατί οι χημικές ενώσεις μετάλλων που σχηματίζονται, είναι θερμοδυναμικά σταθερότερες από τα μέταλλα.
Εξαίρεση σε αυτό αποτλούν τα μέταλλα: χαλκός, άργυρος, χρυσός και λευκόχρυσος, που είναι θερμοδυναμικά σταθερά και δεν αλλοιώνονται.
- Εξ ίσου καθοριστικό για την διάβρωση είναι οι περιβαλλοντικές συνθήκες ηλεκρολυτών δηλαδή, και το περιβάλλον μέσα στο οποίο βρίσκεται το μέταλλο να περιέχει ηλεκτρολύτες.
H διάβρωση μπορεί να είναι χημική ή ηλεκτροχημική
Η χημική διάβρωση
Λαμβάνει χώρα μεταξύ μετάλλων και αερίου ή μεταξύ μετάλλου και τήγματος. Υπάρχει άμεση ανταλλαγή ηλεκτρονίων, ώστε δεν χρειάζεται ηλεκτρολύτης για να διασφαλιστεί. Η ανταλλαγή γίνεται μεταξύ της επιφάνειας του μετάλλου και του οξυγόνου του αέρα.
Γενικότερα, Το μέταλλο , όταν έρχεται σε επαφή με περιβαλλοντικές ουσίες, (οξυγόνο του αέρα, οξέα νερό κ.α.) , αλληλοεπιδρά με αυτές και αλλοιώνεται, γιατί οι χημικές ενώσεις μετάλλων που σχηματίζονται, είναι θερμοδυναμικά σταθερότερες από τα μέταλλα.

Η πιο συνηθισμένη αλλοίωση των μετάλλων, που δίνεται στην διεπιφάνεια, είναι η οξείδωσή τους από το οξυγόνο και η μετατροπή τους οξείδια
(Οξείδωση όμως, μπορεί να προκαλέσουν και άλλα αέρια όπως υδρόθειο, υδρατμοί, αλογόνα, διοξείδιο του άνθρακα κ.λ.π.)
Συμβαίνει αρχικά, καταστροφή του μεταλλικού δεσμού και ακολουθεί κάποια χημική αντίδραση οξειδοαναγωγής, στην οποία το μέταλλο περνά στην οξειδωμένη του μορφή με συνέπεια να χάνει τις ιδιότητές του.
Οξείδωση με οξυγόνο:
Παράδειγμα οξείδωσης από το οξυγόνο
3Fe + 3O2 --> Fe3O4 ή Fe + H2SO4 --> FeSO4 + H2
Έτσι στην επιφάνεια του μετάλλου δημιουργείται ένα στρώμα οξειδίου.
Σε ορισμένες περιπτώσεις η διάβρωση συνεχίζεται μέταλλο.
με δύο τρόπους. 1. Οξυγόνο του αέρα διεισδύει μέσω του στρώματος αυτού μέσα στο μέταλλο και το διαβρώνει σε βάθος ή
2. ιόντα μετάλλου διαπερνούν το στρώμα οξειδίου προς την επιφάνεια και δημιουργούν επί πλέον οξείδιο ώστε το στρώμα του οξειδίου μεγαλώνει προς τα πάνω.
Εκτός από τα μέταλλα που είναι θερμοδυναμικά σταθερά, τα περισσότερα μέταλλα στον αέρα, δημιουργούν γύρω τους ένα φιλμ οξειδίου.
Κάποια από αυτά τα οξείδια, καλύπτουν και προστατεύουν το μέταλλο από την περαιτέρω οξείδωση.
και η διάβρωση, σταματά στην επιφάνεια. Όπως για παράδειγμα το Αλουμίνιο, Χρώμιο, Ζιρκόνιο αλλά και ο Χαλκός,
Αυτό εξαρτάται από τον τύπο της μεμβράνης οξειδίου που σχηματίζεται στην επιφάνεια του μετάλλου. Αν η μεμβράνη είναι αρκετά πυκνή και να καλύπτει όλο το μέταλλο ώστε να μην επιτρέπει στο οξυγόνο να διεισδύσει στο εσωτερικό του μετάλλου και να συνεχίσει την διάβρωση, τότε η διάβρωση σταματά στην επιφάνεια..
Αυτή η πιθανότητα εξαρτάταιι από την πυκνότητα του μετάλλου και του οξειδίου καθώς και τα μοριακά τους βάρη του οξειδίου και του μετάλλου
Αυτό μπορεί να υπολογιστεί από τον παράγοντα Pilling Bedworth
Το Αλουμίνιο όταν εκτεθεί στην ατμόσφαιρα, καλύπτεται από μια λεπτή στρώση οξειδίου του , που εμποδίζει την βαθύτερη διάβρωση. Το ίδιο συμβαίνει και με άλλα μέταλλα όπως το Νάτριο που καλύπτεται από το οξείδιό του.
Ο Χαλκός καλύπτεται αρχικά από το οξείδιό του όμως αυτό στην συνέχεια με το διοξείδιο του άνθρακα του αέρα μετατρέπεται σε ανθρακικό χαλκό και εκεί οφείλεται το πρασινωπό του χρώμα.
Σε υγρό περιβάλλον κορεσμένο σε οξυγόνο, το οξείδιο μπορεί να γίνει υδροξείδιο.
2Zn + O2 + 2H2O --> 2Zn(OH)2
Η ηλεκτροχημική διάβρωση
Είναι οι περιβαλλοντικές συνθήκες δηλαδή, και το περιβάλλον μέσα στο οποίο βρίσκεται το μέταλλο.
Συμβαίνει όταν το μέταλλο είναι σε υγρό περιβάλλον ηλεκτρολυτών
Πρακτικά αυτα μπορεί να είναι, εσωτερικό σωλήνων, σε πλοία στη θάλασσα και επίσης στην ατμόσφαιρα όταν επικρατεί υγρασία (κι αυτός είναι ο κοινός τύπος διάβρωσης)
Εδώ εξετάζουμε τα Ηλεκτρικά Δυναμικά αναπτύσονται μεταξύ του κατιόντος μετάλλου και του ηλεκτρολυτικού περιβάλλοντος που καθορίζεται από το PH , δηλαδή την συγκέντρωση Η+ στο διάλυμα και που δίνει την μετακίνηση ηλεκτρονίων που γίνεται μεταξύ του αναγωγικού σώματος (άνοδος, μέταλλο) και του οξειδωτικού (ηλεκτρολυτικό διάλυμα). Έτσι, εισάγεται η έννοια του ΚΑΝΟΝΙΚΟΥ ΔΥΝΑΜΙΚΟΥ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ που αντί για την απευθείας μέτρηση του δυναμικού οξειδοαναγωγής, μετριέται η διαφορά δυναμικού μεταξύ του δυναμικου οξειδοαναγωγής του συστήματος Mex+/Μe και του Δυναμικού οξειδοαναγωγικής ισορροπίας της αντίδρασης αναγωγής του υδρογόνου H2--> 2H+ + 2e- και για να μην προκύψουν νέες τιμές το δυναμικό αυτό θεωρείται συμβατικά ίσο με το μηδέν ώστε οι τιμές ταυτίζονται με τις τιμές του ΠΡΟΤΥΠΟΥ ΔΥΝΑΜΙΚΟΥ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ (ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΩΑΝΑΓΩΓΗΣ)
(Πίνακας των κανονικών Δυναμικών Οξειδοαναγωγής σε πίνακας 3 στο τέλος)
Στην ηλεκτροχημική διάβρωση υπάρχει κάποιος ηλεκτρολύτης λόγω του οποίου, συμβαίνουν καθοδικές και ανοδικές διεργασίες και εμφάνιση ηλεκτρικού ρεύματος.
Συμβαίνουν ταυτόχρονα δύο διεργασίες , στην άνοδο και στην κάθοδο.
Στην ανοδική διαδικασία, μεταλλικά ιόντα αποσπώνται από το μέταλλο και μεταφέρονται στο διάλυμα κι έτσι το μέταλλο διαβρώνεται
Άνοδος: Μe --> Mex+ + xe-
Κάθοδος: Στην καθοδική διαδικασία η περίσσεια των ηλεκτρονίων μεταφέρεται σε άτομα ή ιόντα ηλεκτρολύτη (π.χ σε Η+ ή σε Ο2)
2Η+ +2e- --> H2

Συμβαίνει όταν το μέταλλο είναι σε υγρό περιβάλλον ηλεκτρολυτών όπως σε εσωτερικό σωλήνων, σε πλοία κ.α. και επίσης στην ατμόσφαιρα όταν επικρατεί υγρασία κι αυτός είναι ο κοινός τύπος διάβρωσης
Συμβαίνουν ταυτόχρονα δύο διεργασίες , στην άνοδο και στην κάθοδο.
Στην ανοδική διαδικασία, μεταλλικά ιόντα αποσπώνται από το μέταλλο και μεταφέρονται στο διάλυμα κι έτσι το μέταλλο διαβρώνεται
Άνοδος: Μe --> Mex+ + xe-
Κάθοδος: Στην καθοδική διαδικασία η περίσσεια των ηλεκτρονίων μεταφέρεται σε άτομα ή ιόντα ηλεκτρολύτη (π.χ σε Η+ ή σε Ο2)
2Η+ +2e- --> H2 Αποπόλωση υδρογόνου που παρατηρείται κατά την διάρκεια ηλεκτροχημικής διάβρωσης σ σε όξινο περιβάλλον
Ο2 +4Η+ + 4e- -> 2H2Ο Αποπόλωση οξυγόνου που παρατηρείται κατά την διάρκεια ηλεκτροχημικής διάβρωσης σε ουδέτερο περιβάλλον
Σημεία Ανόδου και σημεία Καθόδου πάνω στο ίδιο μέταλλο

ή
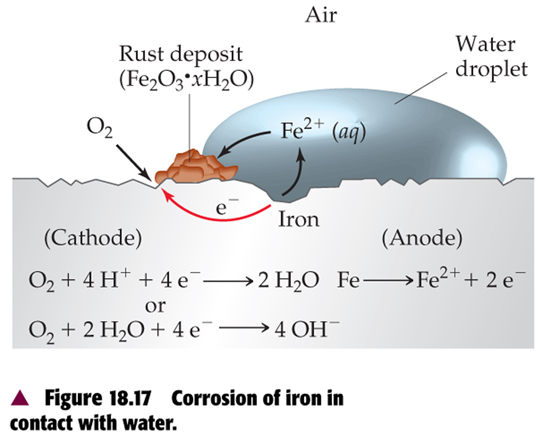
Τι είναι η σκουριά στον σίδηρο
Στην ατμόσφαιρα στην οξείδωση του σιδήρου κάποια μέρη του σιδήρου χρησιμεύουν σαν άνοδος και καποια άλλα στην επιφάνεια στα οποία υπάρχει μεγαλύτερη εισροή οξυγόνου χρησιμεύουν σαν κάθοδος
ΑΝΟΔΟΣ: Fe - 2e- --> Fe2+
ΚΑΘΟΔΟΣ: O2 + 4H+ --> 2H2O
Τι συμβαίνει στα κράματα μετάλλων
Σε οξειδοαναγωγικές αντιδράσεις που συμβαίνουν σε κράματα μετάλλων (Me1, Me2 ) συμμετέχουν ουσιαστικά δύο οξειδοαναγωγικά ζεύγη
Me1x+/Me1 και Me2x+/Me2 που θεωρητικά τα ηλεκτρόνια μεταφέρονται από το οξειδωτικό του ενός στο αναγωγικό του άλλου και στα δύο ζεύγη ,
Επιλεκτική διάβρωση:
Σε πολλές τέτοιες περιπτώσεις, αλλά πρακτικά επικρατεί μεταφορά ηλεκτρονίων από το ισχυρότερο αναγωγικό προς το ισχυρότερο οξειδωτικό λόγω διαφορετικής ταχύτητας των αντιδράσεων οξείδωσης των δύο μετάλλων το λιγότερο αναγωγικό θα βρεθεί σε ένα περιβάλλον πυκνό σε ηλεκτρόνια που ελευθερώνονται από το αναγωγικότερο
τυπικά έχουμε:
Mg --> Mg2+ + 2e-
Mn --> Mn2+ + 2e-
Αλλά τo Μαγνήσιο είναι το αναγωγικότερο
Eo Mg2+/Mg = -2,37V
EoMn2+/Mn = -1,18V
και τελικά έχουμε μεταφορά ηλεκτρονίων προς το οξειδωτικότερο Μαγγάνιο
ΑΝΟΔΟΣ:Mg --> Mg2+ + 2e-
ΚΑΘΟΔΟΣ: O2 + 2H2O + 4e- --> 4OH-
2Fe2+ O2 + 2H2O --> 2Fe(OH)2
σε πολλά Fe(OH)2 ο σίδηρος οξειδώνεται σε τρισθενη 4 Fe(OH)2 O2 + 2H2O --> 4Fe(OH)3
στο τελικό ισολογισμό
Mg +Mn2+ -> Mg2+ + Mn
Επειδή στα κράματα μετάλλων η οξείδωση αρχίζει από το πιο ενεργό μέταλλο του κράματος (αναγωγικότερο)

Αν έχουμε ένα κράμα από Mαγνήσιο και Μαγγάνιο (Mg/Mn) ;opoy πρακτικά ηλεκτρόνια θα μεταφερθούν από το Μαγνήσιο στο Μαγγάνιο
το Μαγνήσιο θα καταστραφεί πρώτο από τη διάβρωση γιατί είναι το πιο ενεργό μέταλλο
Αντοχή στην διάβρωση παρουσιάζουν ορισμένα κράματα μετάλλων
Η αντοχή εξαρτάται από την επιφάνεια γιατί διαφέρει ο βαθμός διάχυσης του οξυγόνου στην επιφάνεια
την μικροδομή του κράματος γιατί το πλέγμα μικτών κρυστάλλων αλλά από
τα στοιχεία του κράματος όπως
Σε χάλυβα με χρώμιο για παράδειγμα, εεμφανίζει αυξημένη ανθεκτικότητα το χρώμιο δημιουργείται γύρω από τον χάλυβα ένα λεπτό φιλμ οξειδίου του χρωμίου που τον προστατεύει
Προστασία από τη διάβρωση
Μεταλλική επικάλυψη
Όπως αναφέρθηκε, εξ ίσου καθοριστικό για την διάβρωση είναι οι περιβαλλοντικές συνθήκες που μπορούν να αλλάξουν την διάβρωση ενός μετάλλου.
Διάβρωση των μετάλλων ισχύει για Αρνητικά Πρότυπα Δυναμικά που αναπτύσοννται μεταξύ του μετάλλου και του κατιόντος του.
Όμως το περιβάλλον μέσα στο οποίο βρίσκεται το μέταλλο έχει τα δικά του χαρακτηριστικά ηλεκτρικού δυναμικού ή PH και αυτό επιρρεάει την διάβρωσή του
Το περιβάλλον του μετάλλου μπορεί να είναι
α. ένα άλλο μέταλλο που να το περιβάλλει
β. ένα ηλεκτρολυτικό διάλυμα
α. Το μέταλλο που χρησιμοποιείται σαν ηλεκτρόδιο σε ηλεκτρολυτικό Διάλυμα καλύπτεται από άλλο μέταλλο
Για να προστατευτούν μέταλλα ηλεκτροδίων επενδύονται με άλλα μέταλλα με πιο αρνητική ή πιο θετική τιμή δυναμικού.
Εδώ να ορίσουμε τις έννοιες Δυναμικό Ηλεκτροδίου και Τυπικό Δυναμικό Ηλεκτροδίου
Δυναμικό ηλεκτροδίου ορίζεται η Διαφορά Δυναμικού μεταξύ του μετάλλου του Ηλεκτροδίου και του Διαλύματος μέσα στο οποίο βρίσκεται (πίνακας 2 στο τέλος)
Τυπικό Δυναμικό Ηλεκτροδίου είναι η Διαφορά Δυναμικού μεταξύ ενός Μεταλλικού Ηλεκτροδίου και ενός Τυπικού Ηλεκτροδίου Υδρογόνου (πίνακας 3 στο τέλος)
Για παράδειγμα, ένα ηλεκτρόδιο από σίδηρο μπορεί να επeνδυθεί από ένα μέταλλο με πιο αρνητική τιμή τυπικού δυναμικού ηλεκτροδίου όπως ο ψευδάργυρος ή το βυρίλιο ή πιο θετική τιμή Τυπικού Δυναμικού ηλεκτροδίου όπως ο χαλκός ή ο άργυρος.
Ανοδική επίστρωση
Αν το μέταλλο καλύπτεται από άλλο με αρνητικότερο δυναμικό από αυτό που προστατεύεται τότε έχουμε ανοδική επίστρωση
Η ανοδική επίστρωση πρέπει να καλύπτει όλο το μέταλλο. Αν υπάρχει σημείο που δεν καλύπτεται, η προστασία διαρκεί έως ότου εξαντληθεί το αρνητικότερο μέταλλο επίστρωσης.
Παράδειγμα όταν ο σίδηρος καλύπτεται από ψευδάργυρο
Ε Fe2+/Fe = -0,440V
Ε Zn2+/Zn = -0,763V
Στην επαφή των δύο μετάλλων στο ηλεκτροχημικό στοιχείο Fe/Zn++ το ηλεκτραρνητικότερο μέταλλο, ο ψευδάργυρος παίζει τον ρόλο της ανόδου και ο σίδηρος της καθόδου με αποδέκτη ηλεκτρονίων το ατμοσφαιρικό οξυγόνο, εάν πρόκειται για ατμοσφαιρική διάβρωση.
Στην ατμοσφαιρική διάβρωση έχουμε στην
ΚΑΘΟΔΟΣ O2 + 2H2O + 4e- --> 4OH-
ΑΝΟΔΟΣ 2Zn - 2e- --> 2Zn2+
2Zn2+ O2 + 2H2O --> 2Zn(OH)2
Γενικά, αυτό βρίσκει εφαρμογή και στην προστασία μετάλλων με επικάλυψή τους με άλλο μέταλλο δραστικότερο αυτού.
αντίστοιχα σε σίδηρο που καλύπτεται με βυρίλιο
Ε Fe2+/Fe = -0,440V
EBe2+/Be =-0,1850V
Καθοδική επίστρωση
Αν το μέταλλο καλύπτεται από άλλο με λιγότερο αρνητικό δυναμικό από αυτό που προστατεύεται τότε έχουμε καθοδική επίστρωση
Ένα ηλεκτρόδιο σιδήρου προστατεύεται έτσι από επίστρωμα χαλκού ή νικέλιου και η επίστρωση πρέπει να καλύπτει όλο το μέταλλο του σιδήρου.γιατί διαφορετικά θα υπάρξει οξειδωση του σιδήρου
 Μη μεταλλική επικάλυψη
Μη μεταλλική επικάλυψη
Επικάλυψη του μετάλλου από ανόργανες ύλες (γυαλί, τσιμεντοκονία) και οργανικές (βερνίκια, χρώματα, άσφαλτος κ.α.) που απομονώνουν το μέταλλο από το περιβάλλον (στην εικόνα ακρυλικό επίστρωμα (Αλκυδικό Metal Primer - KRAFT Paints)
Χημικές επικαλύψεις
Κάλυψη μεταλλικής επιφάνειας:

 Το μέταλλο πρέπει να καλυφθεί με μια ουσία ανθεκτική στην διάβρωση όπως
Το μέταλλο πρέπει να καλυφθεί με μια ουσία ανθεκτική στην διάβρωση όπως
ΟΞΕΙΔΩΣΗ: ορισμένα οξείδια (Al2O3, ZnO, k.a.)
Παραδοσιακά είναι το μίνιον (επιτεταρτοξείδιο του μολύβδου) που είναι μικτό οξείδιο μολύβδου (PbO , Pb2O3) αλλά σήμερα δεν χρησιμοποιείται συχνά για λόγους υγείας
στην εικόνα (https://www.xtools.gr/)
ΦΩΣΦΟΡΟΠΟΙΗΣΗ: Φωσφορικά άλατα (φωσφορικός σίδηρος Fe3(PO4)3 φωσφορικό μαγνήσιο Mn3(PO4)2 φωσφορικός ψευδάργυρος Zn3(PO4)2
Επίδραση στην μεταλλική επιφάνεια
ΝΙΤΡΟΠΟΙΗΣΗ: Κορεσμός της επιφάνειας με άζωτο (αζωτοποίηση).
Αλληλεπίδραση της μεταλλικής επιφάνειας με μεταλλικές ουσίες
Η διάβρωση των μετάλλων ισχύει για Αρνητικά Πρότυπα Δυναμικά που αναπτύσσονται μεταξύ του κατιόντος του μετάλλου και του μετάλλου. Όμως το περιβάλλον μέσα στο οποίο βρίσκεται το μέταλλο έχει τα δικά του χαρακτηριστικά ηλεκτρικού δυναμικού ή PH που εξαρτάται από την συγκέντρωση Η+
Όμως το περιβάλλον μέσα στο οποίο βρίσκεται το μέταλλο έχει τα δικά του χαρακτηριστικά ηλεκτρικού δυναμικού ή PH
Την κίνηση των ηλεκτρονίων δίνει η τιμή του Δυναμικού του ημιστοιχείου (ανόδου)
Ηλεκτροχημική προστασία
Συνδέουμε το προστατευόμενο μέταλλο με την κάθοδο μιας εξωτερικής πηγής ρεύματος με αποτέλεσμα να γίνει κάθοδος. Στην Άνοδο βάζουμε ένα μεταλλικό θραύσμα από ένα πιο ενεργό μέταλλο ΄. Και τα δύο μέταλλα βυθίζονται σε ηλεκτρολυτικό διάλυμα .
Συνδέουμε την κάθοδο μιας εξωτερικής ηλεκτρικής πηγής με Νικέλιο ( το προστατευόμενο μέταλλο)
Τοποθετούμε στην άνοδο ένα κομμάτι μέταλλο πιο ενεργό απ΄πο το Νικέλιο Π.χ. Σίδηρο
Τα δύο μέταλλα βυθίζονται σε διάλυμα Νιτρικού οξέος
Πίνακας 1 ΠΡΟΤΥΠΑ ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΩΣΗΣ

Πίνακας 2 ΠΡΟΤΥΠΑ ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ
(με σύμβαση ειναι τα ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΩΣΗΣ)
.jpg)
Πίνακας 3 ΚΑΝΟΝΙΚΑ ΔΥΝΑΜΙΚΑ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ
.jpg)

Δήμητρα Σπανού
ΠΗΓΕΣ
Microsoft Word - vassiliou-anodic.doc (ntua.gr)
https://link.springer.com/chapter/10.1007/978-3-662-11502-2_8
https://zadachi-po-khimii.ru/obshaya-himiya/page/2
https://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-korroziya-metallov.html
https://el.wikipedia.org/wiki/%CE%A7%CE%B1%CE%BB%CE%BA%CF%8C%CF%82
https://www.google.com/search?
https://jupiter.chem.uoa.gr/pchem/courses/labs/guide_III-3.pdf
https://el.wikipedia.org/wiki/%CE%9A%CE%B1%CE%BD%CE%BF%CE%BD%CE%B9%CE%BA%CF%8C_%CE%B4%CF%85%CE%BD%CE%B1%CE%BC%CE%B9%CE%BA%CF%8C_%CE%BF%CE%BE%CE%B5%CE%B9%CE%B4%CE%BF%CE%B1%CE%BD%CE%B1%CE%B3%CF%89%CE%B3%CE%AE%CF%82
https://www.google.com/search?q=%CF%87%CE%B7%CE%BC%CE%B9%CE%BA%CE%B7+%CE%B4%CE%B9%CE%AC%CE%B2%CF%81%CF%89%CF%83%CE%B7+%CE%BC%CE%B5%CF%84%CE%AC%CE%BB%CE%BB%CE%BF%CF%85&tbm=isch&ved=2ahUKEwj8kIKVis39AhX2k_0HHXVSBREQ2-cCegQIABAA&oq=%CF%87%CE%B7%CE%BC%CE%B9%CE%BA%CE%B7+%CE%B4%CE%B9%CE%AC%CE%B2%CF%81%CF%89%CF%83%CE%B7+%CE%BC%CE%B5%CF%84%CE%AC%CE%BB%CE%BB%CE%BF%CF%85&gs_lcp=CgNpbWcQAzoECAAQAzoICAAQgAQQsQM6CAgAELEDEIMBOgUIABCABDoGCAAQBRAeOgYIABAIEB46BwgAEIAEEBhQ7RBY94wBYNWSAWgAcAB4AIABugGIAb0ZkgEEMC4yNZgBAKABAaoBC2d3cy13aXotaW1nsAEAwAEB&sclient=
https://www.proca.gr/arthra/diavrwsh/
https://www.skroutz.gr/s/23397257/Neotex-Neopox-Special-Primer-1225-4-1-%CE%91%CE%BD%CF%84%CE%B9%CF%83%CE%BA%CF%89%CF%81%CE%B9%CE%B1%CE%BA%CF%8C-%CE%91%CF%83%CF%84
https://www.chemeng.ntua.gr/dpms_ylika/%CE%92%CE%B9%CE%B2%CE%BB%CE%AF%CE%BF%20%CE%94.%20%CE%A5%CF%86%CE%B1%CE%BD%CF%84%CE%AE.pdf
Πίνακας πρότυπων δυναμικών (sch.gr)
ακατέργαστο
- Διάβρωση του εδάφους - ανάλογα με τη σύνθεση του εδάφους, καθώς και τον αερισμό του, η διάβρωση μπορεί να προχωρήσει περισσότερο ή λιγότερο εντατικά. Τα όξινα εδάφη είναι τα πιο επιθετικά, ενώ τα αμμώδη είναι τα λιγότερο.
- Διάβρωση αερισμού - εμφανίζεται όταν άνιση πρόσβαση αέρα σε διαφορετικά μέρη του υλικού.
- Θαλάσσια διάβρωση - εμφανίζεται στο θαλασσινό νερό, λόγω της παρουσίας διαλυμένων αλάτων, αερίων και οργανικών ουσιών σε αυτό .
- Βιοδιάβρωση - εμφανίζεται ως αποτέλεσμα της ζωτικής δραστηριότητας βακτηρίων και άλλων οργανισμών που παράγουν αέρια όπως CO 2 , H 2 S κ.λπ., τα οποία συμβάλλουν στη διάβρωση μετάλλων.
- Ηλεκτροδιάβρωση - εμφανίζεται υπό τη δράση αδέσποτων ρευμάτων σε υπόγειες κατασκευές, ως αποτέλεσμα της εργασίας των ηλεκτρικών σιδηροδρόμων, των γραμμών του τραμ και άλλων μονάδων.
-
Για παράδειγμα, κατά την εφαρμογή ενός στρώματος ψευδαργύρου στο σίδηρο, εάν παραβιαστεί η ακεραιότητα της επικάλυψης, ο ψευδάργυρος λειτουργεί ως άνοδος και θα καταστραφεί και ο σίδηρος προστατεύεται μέχρι να εξαντληθεί όλος ο ψευδάργυρος. Η επίστρωση ψευδαργύρου είναι σε αυτή την περίπτωση ανοδική .
Η καθοδική επίστρωση για την προστασία του σιδήρου μπορεί, για παράδειγμα, να είναι χαλκός ή νικέλιο. Εάν παραβιαστεί η ακεραιότητα μιας τέτοιας επίστρωσης, το προστατευμένο μέταλλο καταστρέφεται.
Μη μεταλλικές επιστρώσεις
Τέτοιες επικαλύψεις μπορεί να είναι ανόργανες (τσιμεντοκονία, υαλώδης μάζα) και οργανικές (ενώσεις υψηλού μοριακού βάρους, βερνίκια, χρώματα, πίσσα).
Χημικές Επικαλύψεις
Σε αυτή την περίπτωση, το προστατευμένο μέταλλο υποβάλλεται σε χημική επεξεργασία προκειμένου να σχηματιστεί ένα ανθεκτικό στη διάβρωση φιλμ της ένωσης του στην επιφάνεια. Αυτά περιλαμβάνουν:
οξείδωση - λήψη σταθερών μεμβρανών οξειδίου (Al 2 O 3 , ZnO, κ.λπ.).
φωσφοροποίηση - λήψη προστατευτικής μεμβράνης φωσφορικών αλάτων (Fe 3 (PO 4 ) 2 , Mn 3 (PO 4 ) 2 );
νιτροποίηση - η επιφάνεια του μετάλλου (χάλυβας) είναι κορεσμένη με άζωτο.
γαλάζιο χάλυβα - η μεταλλική επιφάνεια αλληλεπιδρά με οργανικές ουσίες.
τσιμεντοποίηση - λήψη στην επιφάνεια του μετάλλου της σύνδεσής του με άνθρακα.

Αντίστοιχα συμβαίνει και στα κράματα μετάλλων στα οποία η οξείδωση αρχίζει από το πιο ενεργό μέταλλο του κράματος
