Δήμητρα Σπανού Χημικός, Καθηγήτρια Δ/θμιας Εκπ/σης στο 1ο Γυμνάσιο Δάφνης
ΠΡΟΤΥΠΗ ΕΝΘΑΛΠΙΑ
- Οταν συμβαίνει ο σχηματισμός υλικων σωμάτων από τα συστατικά τους στοιχεία,
- οταν ενα σώμα διαλυεται και βρίσκεται πλεον σε διαλυμενη μορφη,
- οταν συμβαίνει αντίδραση εξουδετέρωσης,
- οταν γίνεται υδρογονωση μιας ακορεστης ουσιας
και σε άλλες αντίστοιχες περιπτώσεις,
τότε, εχουμε μεταβολη στην Ενθαλπία (ΔΗ) απο την μια κατασταση στην άλλη.
Αν τα συστατικά στοιχεία που παιρνουν μέρος στις αντιδρασεις αυτές βρίσκονται σε προτυπη κατάσταση (βλεπουμε παρακατω τι είναι αυτό), τουε μιλάμε για Προτυπη Ενθαλπία.
που συμβολιζεται με το ΔΗfΘ
Στις περιπτώσεις που αναφέρθηκαν, σχηματισμός, διάλυση, εξουδετέρωση κ.λ.π. μιλάμε αντίστοιχα για Προτυπη Ενθαλπια σχηματισμού, διαλύσεως, εξουδετέρωσης κ.λ.π.
ΤΙ ΕΙΝΑΙ Η ΠΡΟΤΥΠΗ ΚΑΤΑΣΤΑΣΗ
Ποτε έχουμε προτυπη κατάσταση:
Για τα αέρια σε θερμοκρασία είναι 298Κ και η πίεση 1At
Για μια διαλυμένη ουσία σε ιδανικό διάλυμα πρέπει να είναι σε συγκέντρωση 1mol/lt και η πίεση 1At
Για μια καθαρή ουσία η προτυπη κατάσταση νοείται για συμπυκνωμενη κατασταση δηλαδή κατάσταση σταθερού όγκου, (υγρό ή στερεά).
(Είναι γνωστό ότι η Ενθαλπία σε ενα θερμοδυναμικό σύστημα υπολογίζεται σπο την εσωτερική του ενεργεια και την ενέργεια που χρειάστηκε για να καταλάβει το σώμα τον ογκο που έχει, ΔΗ= ΔU + pΔV
άρα, γίνεται κατανοητό οτι η μεταβολή της Ενθαλπίας ΔΗ έχει νοημα μονο για υγρά και στερεά σώματα που βρίσκονται σε συμπυκνωμένη κατάσταση και ο υπολογισμός του όγκου τους είναι εφικτός).
Για τα Χημικά Στοιχεία η προτυπη κατάσταση είναι η πιο σταθερή μορφή που έχει το στοιχείο σε πίεση μιας 1 at
Για υγρά και στερεά έχουμε παλι πιεση 1At και θερμοκρασία 25ο C η 298οΚ
ΠΡΟΤΥΠΗ ΕΝΘΑΛΠΊΑ ΣΧΗΜΑΤΙΣΜΟΎ (ΕΝΘΑΛΠΙΑ ΤΥΠΙΚΟΥ ΣΧΗΜΑΤΙΣΜΟΥ)
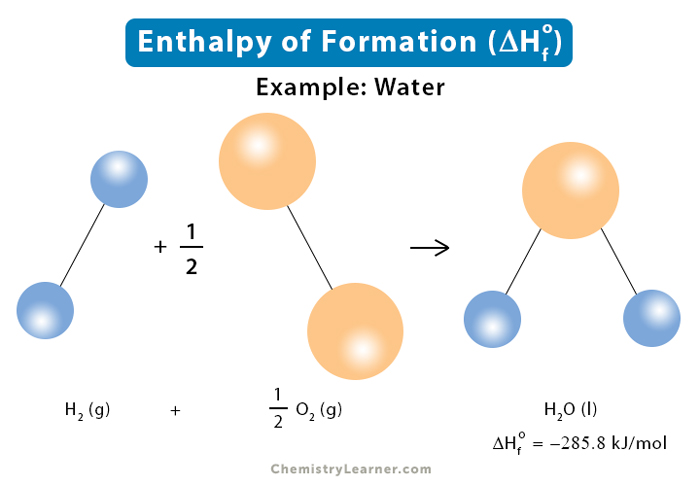
Είναι η ενέργεια που ελευθερώνεται (εξώθερμες αντιδράσεις - αρνητικό πρόσημο ενθαλπίας) , ή απαιτείται (ενδόθερμες αντιδράσεις- θετικό πρόσημο ενθαλπίας) κατά τον σχηματισμό ενός γραμμομορίου μιας ουσίας από τα καθαρά στοιχεία της όταν αυτά βρίσκονται στην πιο σταθερή αλλοτροπική τους μορφή υπό κανονικές συνθήκες Πίεση 1at ή 1,013bar και Θερμοκρασία 25οC
H πρότυπη εντροπία σχηματισμου χημικών στοιχείων στην πιο σταθερή τους μορφή τους είναι μηδενική 0kj/mol)
Μετράται σε μονάδες ενέργειας ανά ποσότητα ουσίας, συνήθως σε KJ/mol ή j/mol ή kcal/mol ή στη Φυσική σε ηλεκτρονιοβόλτ που αντιστοιχούν σε 100kj/mol
ΠΡΟΤΥΠΗ ΕΝΘΑΛΠΊΑ ΣΧΗΜΑΤΙΣΜΟΎ ΧΗΜΙΚΏΝ ΣΤΟΙΧΕΊΩΝ
Ενδιαφέρον παρουσιάζει η Ενθαλπία σχηματισμού ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ.
Αυτή λαμβάνεται ίση με το μηδεν, όταν αυτά είναι σε πρότυπες καταστάσεις ( στη φυσικη κατασταση που αυτα παρουσιάζονται σταθερά, 'ητοι την αλλοτροπικά πιο σταθερή μορφή χημικών στιχείων, είτε σε στερεα, υγρή ή αέρια μορφη) . γιατί "δεν επισέρχεται καμία μεταβολή στον σχηματισμό τους"
Αυτό σημαίνει ότι αν ένα στοιχείο εμφανίζεται σε περισσότερες από μια αλλοτροπικές μορφές επιλέγουμε την πιο σταθερή
Για τον άνθρακα σε μορφή γραφίτη (σταθερότερη αλλοτροπική μορφή) η ενθαλπία σχηματισμού είναι 0 kj/mol
ενώ για τον άνθρακα σε μορφή διαμαντιού είναι +1,90kj/mol
Αυτό πρακτικά, μάλλον εννοεί οτι αν σχηματιστεί μια οποιαδήποτε ποσότητα ενός χημικού στοιχείου από άτομα ή μόρια που το αποτελουν δεν υπάρχει μεταβολη στην συνολική Ενθαλπία αν θεωρήσουμε την σταθερότερη αλλοτροπικη μορφή του
ΠΡΟΤΥΠΗ ΕΝΘΑΛΠΊΑ ΣΧΗΜΑΤΙΣΜΟΎ ΧΗΜΙΚΏΝ ΕΝΩΣΕΩΝ
ΑΠΟ ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΤΟΥΣ (ΣΕ ΠΡΟΤΥΠΗ ΚΑΤΑΣΤΑΣΗ)
Δεν συμβαίνει όμως το ίδιο κατά τον σχηματισμό των χημικων ενώσεων.
Είδαμε ότι, σαν ενθαλπία σχηματισμού ορίζουμε την ενέργεια που ελευθερώνεται ή δαπανάται κατά τον σχηματισμό ενός γραμμομορίου μιας ουσίας από τα καθαρά στοιχεία της όταν αυτά βρίσκονται στην πιο σταθερή αλλοτροπική τους μορφή υπό κανονικές συνθήκες Πίεση 1at ή 1,013bar και Θερμοκρασία 25οC
C (s, graphite) + O2 (g) → CO2 (g) ΕΞΩΘΕΡΜΗ ΔHfo = -393.509 kJ/mol
½ N2 (g) + O2 (g) → NO2 (g) ΕΝΔΟΘΕΡΜΗ ΔHfo = +33.2 kJ/mol
Προφανώς, κατά την δημιουργία χημικών δεσμών, έχουμε μεταβολή στην ενέργεια κατά την σύνδεση ατόμων μεταξύ τους . (Δεσμευτική ενέργεια ή Ενέργεια Σύνδεσης)
* η σύνδεση των ατόμων για την δημιουργία μορίου δημιουργεί μεταβολές στις ηλεκτροδυναμικές ενέργειες των ηλεκτρονίων των ατόμων που καθοδηγείται από την σχέση της ηλεκτροσυγγένειάς τους για την δημιουργία των μορίων ενώ στην συνέχεια, η πολικότητα που εμφανίζεται σε μόρια χημικων ενωσεων σε ομοιοπολικούς πολικούς δεσμούς, αλλά και οι ηλεκτρικές δυνάμεις ιοντικων συνδέσεων στα ιοντικά πλέγματα, δημιουργεί αλλη σχεση στις δυναμικές ενέργειες της σύνδεσης των μορίων τους μεταξύ τους. Αυτό έχει βέβααια σαν αποτέλεσμα να υπάρχει μεταβολή στην Εσωτερική τους Ενέργεια (ΔU) κατά την δημιουργία χημικών ενώσεων από τα χημικά στοιχεία.
Όμως, εκτός από την μεταβολή στο σύνολο της εσωτερικής τους ενέργειας, η θέση των ατόμων μεταξύ τους μεταβάλλεται και και κατά συνέπεια, ο συνολικός όγκος που καταλαμβάνουν σαν μεμονωμένα άτομα και αφού μετά αφού σχηματίσουν δεσμό. Υπάρχει δηλαδή ΔV και ο δεύτερος όρος της ενθαλπίας PΔV είναι προφανώς διάφορος από το μηδεν. Για αντίστοιχους λόγους έχουμε μεταβολή όχι μόνο στην Εσωτερική Ενέργεια αλλά και συνολικά στην Ενθαλπία ) (μεγαλύτερη είναι η μεταβολή Ενθαλπίας κατά τη δημιουργία ιοντικού πλέγματος )
Πιο συγκεκριμένα για ομοιοπολικό δεσμό η ενέργεια σύνδεσης για τον μονό δεσμό είναι από 140 - 595 kJ/mol για τον διπλό δεσμό είναι από 420 - 710 kJ/mol και για τον τριπλό δεσμό είναι 810 - 1080 kJ/mol
ΝΟΜΟΣ ΤΟΥ BORN-HABER
Ο σχηματισμός μιας χημικής ένωσης είναι αποτέλεσμα διακριτών διεργασιών που περιλαμβάνονται στον κύκλο Μπορν- Χάμπερ (Born-Haber) όπως για παράδειγμα, ατμοποίηση, ιονισμός, ηλεκτρονιακή συγγένεια, ενθαλπία πλέγματος κ.α. με τις αντίστοιχες μεταβολές στις ενθαλπίες, όπως στην Ενθαλπία συνδεσης για την δημιουργία μορίου*, στην Ενθαλπία πλέγματος αν πρόκειται για κρυσταλλική ουσία, ή την Ενθαλπία διαμοριακων συνδέσεων κ.λ.π.


ώστε, το άθροισμα όλων των τιμών θα δώσει την ενθαλπία σχηματισμού της χημικής ένωσης.
Βλέπουμε το παραδείγματα κυκλου Born-Haber κρυσταλλικών ενώσεων που αποτελούνται από ένα μέταλλο και ένα αμέταλλο
Κατά τις μεταβολές αυτές μεταξύ των αρχικών και τελικών σωμάτων, η μεταβολή της Ενθαλπίας ορίζεται από την διαφορά μεταξύ της τελικής και της αρχικής κατάστασης , δίνεται δε από την σχέση ΔΗv= ΔU + PΔV
Όμως η ενθαλπία σχηματισμού μιας χημικής ένωσης εξαρτάται μόνο από την ίδια την ουσία και όχι από την διαδικασία δημιουργίας της , υπολογίζεται δε από την μεταβολή της από το αρχικό και το τελικό στάδιο
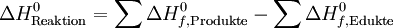
ΠΡΑΚΤΙΚΑ Η ΕΝΘΑΛΠΙΑ ΣΧΗΜΑΤΙΣΜΟΥ ΧΗΜΙΚΗΣ ΕΝΩΣΗΣ ΑΝΑΦΕΡΕΤΑΙ ΜΟΝΟ
ΣΤΗΝ ΜΕΤΑΒΟΛΗ ΕΝΘΑΛΠΙΑΣ ΛΟΓΩ ΑΛΛΗΛΕΠΙΔΡΑΣΕΩΝ ΣΩΜΑΤΙΔΙΩΝ
Αναφερόμαστε αλληλεπιδράσεις σωματιδίων μορίων, ατόμων, ιόντων που δεν οδηγούν στον σχηματισμό ομοιοπολικών χημικών δεσμών
Με την έννοια αυτή η πρότυπη εντροπία σχηματισμού χημικής ένωσης, αποτελεί μια ποσότητα θερμοδυναμικής κατάστασης
ώστε εν τέλει,
Η φυσική σημασία της Ενθαλπία σχηματισμού χημικής ένωσης περιγράφει μόνο τις αλληλεπιδράσεις σωματιδίων
.jpg)
Δήμητρα Σπανού
ΠΗΓΕΣ
Standard enthalpy of formation - Wikipedia
Standard Enthalpy of Formation: Definition, Table, & Equation (chemistrylearner.com)
Διαμοριακή αλληλεπίδραση - Βικιπαίδεια (wikipedia.org)
2.2.4.1 Διαμοριακή δύναμη van der Waals (ntmdt-si.ru)
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ ΜΕΣΑ ΑΠΟ ΤΗΝ ΚΛΑΣΣΙΚΗ ΦΥΣΙΚΗ . 3ο . Μεταβολές στην Εσωτερική Ενέργεια και Ενθαλπία κατά τον σχηματισμό μορίων, ιοντικών πλεγμάτων, συσσωματώσεων των δομικών ομοίων μονάδων (νανοσωματιδίων) της Ύλης
Δυνάμεις διασποράς - Βικιπαίδεια (wikipedia.org)
Διαατομική αλληλεπίδραση - Βικιπαίδεια (wikipedia.org)
PPT - Energetics PowerPoint Presentation, free download - ID:6296243 (slideserve.com)
Μαξ Μπορν - Βικιπαίδεια (wikipedia.org)

.jpg)