Δήμητρα Σπανού Χημικός, Καθηγήτρια Δ/θμιας Εκπ/σης στο 1ο Γυμνάσιο Δάφνης
Η ΣΥΣΧΕΤΙΣΗ ΤΩΝ ΜΟΡΙΩΝ ΚΑΘΟΡΙΖΕΤΑΙ ΑΠΟ ΤΗΝ ΔΡΑΣΗ ΔΙΑΜΟΡΙΑΚΩΝ ΔΥΝΑΜΕΩΝ
OΙ ΑΛΛΗΛΕΠΙΔΡΑΣΕΙΣ ΣΩΜΑΤΙΔΙΩΝ ΕΙΝΑΙ ΜΟΡΙΑΚΕΣ, ΑΤΟΜΙΚΕΣ
ΔΙΑΜΟΡΙΑΚΕΣ ΑΛΛΗΛΕΠΙΔΡΑΣΕΙΣ
Τι είναι οι διαμοριακές αλληλεπιδράσεις: Είναι οι ενεργειακές σχέσεις μεταξύ των μεμονωμένων μορίων της ουσίας ,- αλλά και ατόμων , κατά τις οποίες υπάρχει αλληλεπίδραση μεταξύ τους, που δεν οδηγεί σε χημικό δεσμό (ομοιοπολικό ιοντικό ή μεταλλικό). Είναι ασθενέστερες των ομοιοπολικών δεσμών και δεν επιρρεάζουν σημαντικά την ηλεκτρονιακή διάταξη των σωματιδίων.
Οι διαμοριακές δυνάμεις μεταβάλλονται και λόγω αλλαγών φάσεων (στερεό, υγρό, αέριο) και επομένως η ενθαλπία σχηματισμού μεταξύ φάσεων διαφοροποιείται.
Πρόκειται για: ΔΕΣΜΟΥΣ ΥΔΡΟΓΟΝΟΥ ΚΑΙ ΔΥΝΑΜΕΙΣ ΑΛΛΗΛΕΠΙΔΡΑΣΗΣ WAN DER WALLS
Διαμοριακές αλληλεπιδράσεις Van der Walls
Οι δυνάμεις Van der Walls που περιλαμβάνουν αλληλεπιδράσεις μεταξύ μοριακών κελυφών σε υγρά και κρυστάλλους, είναι πολύ χαμηλότερης έντασης σχετικά με τις ενδομοριακές δυνάμεις και δεν αλλάζουν ουσιαστικά τις χημικές ιδιότητες του μορίου.
Η ενέργεια αλληλεπίδρασης εξαρτάται από την απόσταση διπόλων και μορίων, την πολωσιμότητα των ηλεκτρονίων, τα δυναμικά ιονισμού ατόμων και μορίων.
Οι αποστάσεις μεταξύ των διπόλων μορίων (ακτίνες VanderWalls) είναι κατά μέσο όρο 0,08nm μεγαλύτερες από τις ομοιοπολικές ακτίνες
Επίσης οι ιοντικές ακτίνες είναι πανομοιότυπες με τις ακτίνες VanderWaals
Στον παρακάτω πίνακα από ElementData της Mathematica, από την Wolfram Research
βλέπουμε τις ακτίνες VanderWaals σε pm , 1pm = 10-12m Για τα γκρι κελιά δεν έχει δεδομένα
| Ομάδα (στήλη) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Τελεία (γραμμή) |
||||||||||||||||||||
| 1 | H 110[3] ή 120 |
Αυτός 140 |
||||||||||||||||||
| 2 | Λι 182 |
Be 153[4] |
Β 192[4] |
Γ 170 |
Ν 155 |
Ο 152 | Φ 147 |
ΝΕ 154 |
||||||||||||
| 3 | ΝΑ 227 |
Mg 173 |
Αλ 184[4] |
Si 210 |
Π 180 |
Σ 180 |
CL 175 |
AR 188 |
||||||||||||
| 4 | Κ 275 |
ΓΑ 231[4] |
Sc |
Τι |
V |
Cr |
Μν |
Φε |
Σία |
Νι 163 |
Κυ 140 |
ΖΝ 139 |
Γα 187 |
ΓΕ 211[4] |
Ως 185 |
ΣΕ 190 |
ΜΒ 185 |
KR 202 |
||
| 5 | RB 303[4] |
Sr 249[4] |
Y |
Zr |
Σημ.: |
Στιγμή |
Tc |
Ρου |
Ρη |
Πδ 163 |
Αγ 172 |
CD 158 |
Το 193 |
SN 217 |
SB 206[4] |
ΤΕ 206 |
Ι 198 |
ΧΕ 216 |
||
| 6 | ΚΕΣ 343[4] |
Βα 268[4] |
* |
Λου |
ΗΣΤ |
Ευχαριστώ |
W |
Επανα |
Λειτουργικό σύστημα |
Ιρ |
Σημ. 175 |
AU 166 |
HG 155 |
ΤΙ 196 |
ΤΒ 202 |
ΔΙ 207[4] |
Πάδος 197[4] |
Στο 202[4] |
Rn 220[4] |
|
| 7 | FR 348[4] |
Ρα 283[4] |
** |
Lr |
Ρφ |
ΔΒ |
Γγ |
Bh |
Υς |
Όρος |
ΔΣ |
Ρωγ |
Σο |
Νη |
Φλ |
Μακ |
Lv |
Τ |
Og |
|
| * |
Λα |
Ce |
Πρ |
ΝΔ |
Μ.μ. |
Τμ |
Εε |
Γδ |
Φυματίωση |
Δυ |
HO |
Er |
Τμ |
Υβ |
||||||
| ** |
Εναλλασσόμενο |
Θ |
Πα |
Κα 186 |
Νπ |
Που |
Π.μ |
Εκατοστόμετρο |
ΒΚ |
Πρβ |
Es |
Fm |
Md |
Όχι |
||||||
.
Από που προέρχονται οι δυνάμεις των διαμοριακών συνδέσεων Van der Waals
Οι δυνάμεις Van der Waals έτσι, έχoυν τρεις συνιστώσες:
τις αλληλεπιδράσεις προσανατολισμού των μονίμων διπόλων
τις αλληλεπιδράσεις επαγωγής λόγω πολωσιμότητας των μορίων- (σταθερών και επαγομένων διπόλων) και
τις αλληλεπιδράσεις διασποράς μη πολικών μορίων. Και οι τρεις συνιστώσες εξαρτώνται από την απόσταση
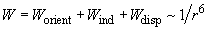
Πρόκειται για ασθενείς ηλεκτρομαγνητικές αλληλεπιδράσεις και παρά την χαμηλή τους ένταση, σχηματίζουν υλικά με ενδιαφέρουσες ιδιότητες (μαγνητικές)
Για μικρά μόρια σε μεγάλες αποστάσεις επικρατούν ελκτικές δυνάμεις σε διαορετικό ποσοστό από τις τρεις συνιστώσες (προσανατολισμού, πόλωση, και διασποράς)
Το δυναμικό U και η ενέργεια W υπολογίζονται διαφορετικά σε κάθε περίπτωση, αλλά σε κάθε μια από τις 3 περιπτώσεις ισχύει και ο παράγοντας της εξάρτησής τους από την απόσταση μεταξύ των μορίων που εξαρτάται από το 1/r6 . ώστε, 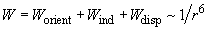 όπου Worient η ενέργεια αλληλεπίδρασης μονίμων διπόλων με ίδια ροπή, Wind η ενέργεια αλληλεπίδρασης μινίμου διπόλου και επαγωμένου διπόλου μορίου και Wdisp η ενέργεια αλληλεπίδρασης μη πολικών μορίων
όπου Worient η ενέργεια αλληλεπίδρασης μονίμων διπόλων με ίδια ροπή, Wind η ενέργεια αλληλεπίδρασης μινίμου διπόλου και επαγωμένου διπόλου μορίου και Wdisp η ενέργεια αλληλεπίδρασης μη πολικών μορίων
Αναλυτικότερα:
α. Δυνάμεις προσανατολισμού μεταξύ μορίων - μονίμων διπόλων όπως το HCl σε υγρή και στερεή κατάσταση. Συμβαίνει μεταξύ μονίμων διπόλων μορίων με την ίδια διπολική ροπή. H ενέργεια αλληλεπίδρασης είναι αντιστρόφως ανάλογη με τον κύβο της απόστασης μεταξύ των διπόλων d1, d2 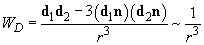
Το διπολικό μόριο προσανατολίζει το άλλο διπολικό μόριο ή καλύτερα το υπόλοιπο διπολικό σύστημα, με αποτέλεσμα την μείωση της ενέργειας.
Η ενέργεια προσανατολισμένης αλληλεπίδρασης μεταξύ δύο τέτοιων διπόλων εξαρτάται από τη φύση τους από την μεταξύ τους επαγωγική αλληλεπίδραση και από την απόσταση .
Η μέση Δυναμική ενέργεια διπολικής- διπολικής αλληλεπίδρασης υπολογίζεται:
μ είναι η διπολική ροπή του μορίου , r η απόσταση, kΤ δίνουν τις διακυμάνσεις στον προσανατολισμό λόγω θερμκής κίνησης.
. Τα διπολα τείνουν να βρίσκονται στην ίδια κατεύθυνση΄σε έναν κοινό άξονα, αν και η θερμική κίνηση τα περιστρέφει και γι αυτόν τον λόγο, η αλληλεπίδραση λόγω προσανατολισμού υπολογίζεται στατιστικά.
Επίσης προτιμώνται τα δίπολα που βρίσκονται σε ενεργειακά πλεονεκτικές θέσεις εφόσον λόγω της κατανομής Gibbs που δείχνουν τις πιθανότητες να βρίσκονται τα δίπολα σε διαφορετικές ενέργειες ανάλογα με την θερμοκρασία.
β. Δυνάμεις πόλωσης μεταξύ σταθερού και επαγώμενου (μειωμένου) διπόλου μορίου στις οποίες το ένα από τα δύο μόρια είναι πολικό και το άλλο όχι πολικό ώστε το ηλεκτρικό πεδίο δημιουργείται από το πολικό που προκαλεί πόλωση d1 και επαγώμενη διπολική ροπή στο μη πολικό μόριο d2 και η ενέργεια κυμαίνεται από 10-20 kj/mol.
Οι βαρυτικές δυνάμεις που αναπτύσσονται μεταξύ διπόλου ατόμου και επαγωμένου διπόλου λέγονται δυνάμεις Debye και είναι ανεξάρτητες από την θερμοκρασία.
Το αποτέλεσμα επαγωγικής αλληλεπίδρασης σταθερού και επαγωμένου δίπολου υπολογίζεται για διαφορετικούς λόγους ίσο με
Όταν πρόκειται για υγρά ή στερεά σώματα, το πολώσιμο μόριο (το μη πολικό που πολώνεται υπό την επίδραση) επιρρεάζεται συμμετρικά από μεγάλο αριθμό γειτονικών μορίων και αντισταθμίζεται η αλληλεπίδραση επαγωγής με αποτέλεσμα μια πραγματική επαγωγική αλληλεπίδραση
Η ενέργεια επαγωγικής αλληλεπίδρασης υπολογίζεται ξανά ίση με Wind= 1/rn . n=8-13
γ. Δυνάμεις διαμοριακής αλληλεπίδραση μεταξύ μη πολικών μορίων ή Δυνάμεις διασποράς -London που εμπλέκονται και μη πολικά μόρια.
Προκαλούνται από στιγμιαίες αλληλεπιδράσεις ατόμων και μορίων μεταξύ τους λόγω διπολικών ροπών που εμφανίζονται και εξαφανίζονται ανάλογα με την προσέγγιση μεταξύ τους συνοδεύονται από στιγμιαία μικροδίπολα.
Η φύση των διαμοριακών δυνάμεων στα μη πολικά συστήματα προσδιορίστηκε από τον F. London με την βοήθεια κβαντικής μηχανικής.
Τα μη πολικά μόρια λόγω κβαντικής αβεβαιότητας διαθέτουν στιγμιαίες διπολικές ροπές. Έτσι μπορούμε να πούμε πως η συσχέτιση της κίνησης των ηλεκτρονίων οδηγεί σε μείωση της ενέργειας που σημαίνει ότι έχουμε κάποιου είδους αυθόρμητες διαμοριακές συνδέσεις.
Ενώ σύμφωνα με την εξίσωση Strondinger για μη πολικά μόρια, σε οποιαδήποτε κατάσταση, οι μέσες τιμές των διπολικών ροπών είναι μηδέν, σε ορισμένες περιπτώσεις (διαγώνια στοιχεία μήτρας) αυτό δεν ισχύει και στιγμιαία, δίνουν στις μέσες τιμές των διπολικών ροπών (που κανονικά είναι μηδέν), μια διπολική ροπή διάφορη από μηδέν που σημαίνει πως στιγμιαία, η ενέργεια αλληλεπίδρασης δεν είναι μηδέν επομένως αυτά τα μη πολικά μόρια αλληλεπιδρούν μεταξύ τους. Αυτό βέβαια δεν είναι μόνιμο, όμως εάν πάρουμε την δεύτερη τάξη των τιμών αυτών, η μέση τιμή του δυναμικού αυτού δεν εξαφανίζεται αλλά παραμένει και αυτό είναι το δυναμικό αλληλεπίδρασης διασποράς
που υπολογίζεται ή όπου Ι η ενέργεια ιονισμού του μορίου. Εαν ο αριθμός των ηλεκτρονίων στο κέλυφος είναι Ν ο τύπος μπορεί να πάρει την μορφή
Αποδεικνύεται ότι το μέγεθος των δυνάμεων London εξαρτάται
α. από την πόλωση του μορίου (ατόμου). Η πόλωση συνδέεται με τον δείκτη διάθλασης ο οποίος δείχνει και την ιδιότητα της ουσίας να διαχέει το φως (δυνάμεις διασποράς. ) Επίσης η πόλωση εξαρτάται
β. από το μέγεθος του σωματιδίου άρα η ισχύς των μοριακών πλεγμάτων αυξάνεται με το μέγεθος των ατόμων και των μορίων που αλληλεπιδρούν
Αυτό φαίνεται και από την αύξηση των σημείων βρασμού στα μη πολικά ευγενή αέρια όπως και σε οργανικά μη πολικά μόρια που συμβαδίζει
με την αύξηση του μεγέθους των μορίων τους Ηe (-268,9oC)
. Ne (-246oC) , Ar (-185,8oC) , Kr (-153oC), Xe (-108oC ), Rn (-63oC)
CH4 (-161oC), C2H6 (-88oC), C3H8 (-42oC), C4H10 (-0,5o C), C5H12 (+36oC)...
Αναφέρω ότι με το πέρασμα στην αέρια κατάσταση έχουμε σε μεγάλο βαθμό εξάλειψη των διαμοριακών αλληλεπιδράσεων και το πέρασμα στα μεμονωμένα μόρια -άτομα)
Ανάλογες εξαρτήσεις υπάρχουν και για την εξάτμιση και την εξάχνωση όπου η ισχύς των διαμοριακές συνδέσεων ελαττώνονται πολυ. την τήξη ακόμα έχουμε εξασθένηση των διαμοριακών συνδέσεων που δίνει διαφορετικό σημείο τήξης ανάλογα με το μέγεθος των μορίων
Συχνά όλες οι διαμοριακές επιδράσεις ενώνονται με την κοινή ονομασία wan der waals και εκράζονται με την σχέση
Υπάρχουν πολλά εμπειρικα δυναμικά για την μοντελοποίηση των διαμοριακών αλληλεπιδράσεων μεταξύ των οποίων γνωστό είναι τα δυναμικά Lennard Jones στα οποία η έλξη περιγράφεται με την έκτη δύναμη της αντίστροφης απόστασης και η άπωση με την δωδέκατη δύναμη της αντίστροφης απόστασης
Η διαφορετική συμβολή στην ενέργεια του δεσμού των τριών διαμοριακών αλληλεπιδράσεων (πολικών, πολικου- επαγωμένου, μη πολικού)
Παρ ότι ολες οι δυνάμεις van der waals μπορούν να εκφραστούν με την μορφή ,
η συμβολή στην ενέργεια του δεσμού των τριών διαμοριακών αλληλεπιδράσεων διαφέρει ανάλογα με την πολικότητα των μορίων. Σε διαμοριακούς δεσμούς μη πολικών μορίων η ενέργεια αλληλεπίδρασης διπολικών μορίων και η ενέργεια αλληλεπίδρασης πολικού και επαγωμένου μορίου μηδενίζονται.
Για άτομα και μη πολικά μόρια οι δύο πρώτοι όροι (προσανατολισμός πολικών και επαγωγή) μηδενίζονται και παραμένει μόνο η ενέργεια διασποράς (στιγμιαία πόλωση). Όσο η διπολική ροπή αυξάνεται σε μόρια, αυξάνει και το ποσοστό της διπολικής ροπής προσανατολισμού και επαγωγής.

Το μόριο CO με συνολική διπολική ροπή COμ =0,12D η προσανατολισμού συνεισφέρει 0,005%, η επαγωγής -14,4% και διασποράς -4,2%
Το μόριο HBr με συνολική διπολική ροπή ΗΒrμ =0,78D η προσανατολισμένη κατά -3,3% η επαγώμενη κατά -2,2%
ενώ αντίστοιχα στο HClμ=1,03D η προσανατολισμένη -14,4% και η επαγώμενη -4,2%
Ένα μεγάλο ποσοστο από την συνολική διπολική ροπή οφείλεται σε ροπή διασποράς, ακόμα και σε πολικά μόρια
Συσσωμάτωση ατόμων μέσω διατομικής αλληλεπίδρασης.
Η διατομική αλληλεπίδραση που είναι αλληλεπίδραση ηλεκτρομαγνητικής φύσης μεταξύ ηλεκτρονίων και πυρήνα ενός ατόμου με ηλεκτρόνια και πυρήνα άλλου ατόμου, που σε υψηλές τιμές σχηματίζει τα διατομικά μόρια (χημικός δεσμός).
Εάν οι τιμές είναι χαμηλές τα άτομα διατηρούν την ατομικότητά τους όπως είναι τα ευγενή αέρια.
Παρά το ότι τα αέρια αυτά είναι μη πολικά υπάρχουν καταστάσεις συσσωμάτωσης που οφείλονται σε δυνάμεις London που ασκούνται τώρα μεταξύ ατόμων (όχι μορίων)
Αυτό συμβαίνει λόγω διακύμανσης του ηλεκτρικού φορτίου που συμβαίνει καθώς τα άτομα κινούνται το ένα προς το άλλο, εμφανίζουν στιγμιαία διπολική ροπή διάφορη από το μηδέν και αναπτύσουν μεταξύ τους δυνάμεις διασποράς London
Πιστεύεται ότι, η ενέργεια διασποράς καθορίζεται από κβαντομηχανικές διακυμάνσεις στην πυυκνότητα ηλεκτρονίων
Εκτός από τις καταστάσεις συσσωμάτωσης των ευγενών αερίων, η διατομική αλληλεπίδραση London εκδηλώνεται στην συναρμολόγηση νανουλικών, διάφορες ατομικές συστάδες , φουραλένια κ.α.
.jpg)
Δήμητρα Σπανού
ΠΗΓΕΣ
Standard enthalpy of formation - Wikipedia
Standard Enthalpy of Formation: Definition, Table, & Equation (chemistrylearner.com)
Διαμοριακή αλληλεπίδραση - Βικιπαίδεια (wikipedia.org)
2.2.4.1 Διαμοριακή δύναμη van der Waals (ntmdt-si.ru)
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ ΜΕΣΑ ΑΠΟ ΤΗΝ ΚΛΑΣΣΙΚΗ ΦΥΣΙΚΗ . 3ο . Μεταβολές στην Εσωτερική Ενέργεια και Ενθαλπία κατά τον σχηματισμό μορίων, ιοντικών πλεγμάτων, συσσωματώσεων των δομικών ομοίων μονάδων (νανοσωματιδίων) της Ύλης
Δήμητρα Σπανού
Δυνάμεις διασποράς - Βικιπαίδεια (wikipedia.org)
Διαατομική αλληλεπίδραση - Βικιπαίδεια (wikipedia.org)
Διαμοριακή αλληλεπίδραση - Βικιπαίδεια (wikipedia.org)
Van der Waals Forces - Βικιπαίδεια (wikipedia.org)
межмолекулярные взаимодействия и температура
Δεσμοί υδρογόνου - Βικιπαίδεια (wikipedia.org)
Δεσμοί υδρογόνου - ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ: ΒΑΣΙΚΕΣ ΑΡΧΕΣ (studme.org)
Ακτίνα βαν ντερ Βάαλς - Βικιπαίδεια (wikipedia.org)
ακατέργαστο
Η Ενθαλπία σχηματισμού του νερού σε υγρή μορφή είναι 285,8kj/mol και σε αέρια μορφη είναι στους 100οC είναι 40,7 kj/mol ενώ, η κανονική Ενθαλπία (με θερμοκρασία 25οC και πιεση 1at -υγρό) είναι 241,818 kj/mol, βλέπουμε μια διαφορά γυρω στα 44 kj/mol κι αυτη είναι στην πραγματικοτητα η Ενθαλπία που οφειλεται στην συνδεση των μορίων του νερου (διαμοριακές συνδέσεις) έτσι ώστε από ασύνδετα ή ασθενώς συνδεόμενα μόρια νερού ακαθόριστου όγκου περνάμε σε σχηματισμό συσσωματωμένης υγρής υλης (το ίδιο ισχύει και για στερεά) που έχει συμπυκνωμένο , σταθερό τον όγκο. Εδώ οι συνθήκες για την εμφάνιση υγρού νερού μπορούν να είναι οι κανονικές οπότε μπορούμε να καταννοούμε και την πρότυπη ενθαλπία σχηματισμού νερού.

.jpg)



 όπου Ι η ενέργεια ιονισμού του μορίου. Εαν ο αριθμός των ηλεκτρονίων στο κέλυφος είναι Ν ο τύπος μπορεί να πάρει την μορφή
όπου Ι η ενέργεια ιονισμού του μορίου. Εαν ο αριθμός των ηλεκτρονίων στο κέλυφος είναι Ν ο τύπος μπορεί να πάρει την μορφή 
