Δήμητρα Σπανού Χημικός, Καθηγήτρια Δ/θμιας Εκπ/σης στο 1ο Γυμνάσιο Δάφνης
Η ΣΥΣΧΕΤΙΣΗ ΤΩΝ ΜΟΡΙΩΝ ΚΑΘΟΡΙΖΕΤΑΙ ΑΠΟ ΤΗΝ ΔΡΑΣΗ ΔΙΑΜΟΡΙΑΚΩΝ ΔΥΝΑΜΕΩΝ
Η ΔΙΠΟΛΙΚΗ ΡΟΠΗ ΤΩΝ ΧΗΜΙΚΩΝ ΔΕΣΜΩΝ ΚΑΘΟΡΙΖΕΙ ΤΙΣ ΔΙΑΜΟΡΙΑΚΕΣ ΤΟΥΣ ΑΛΛΗΛΕΠΙΔΡΑΣΕΙΣ
Ηλεκτρική Διπολική Ροπή είναι μια διανυσματική ποσότητα που χαρακτηρίζει την ασυμμετρία κατανομής θετικών και αρνητικών φορτίων σε ένα ηλεκτρικά ουδέτερο σύστημα.
- Η μονάδα μέτρησης στο SI είναι C.m, όμως
- η τάξη μεγέθους στις διπολικές ροπές χημικών δεσμών υπολογίζεται από το φορτίο ηλεκτρονίου e= 1,6.10-19 και το μήκος του χημικού δεσμού που είναι της τάξης 10-10 m. Ετσι, η διπολική ροπή των μορίων δίνεται σε debyes (D) kai 1 C m = 2,9979 × 1029 D.
Διπολική ροπή χημικού δεσμού. Διπολική ροπή ηλεκτρικού διπόλου. Διπολική ροπή διατομικού μορίου
Το απλούστερο σύστημα φορτίων με μη μηδενική διπολική ροπή είναι το ηλεκτρικό δίπολο:
- Δύο φορτία +q , -q, σε απόσταση l σχηματίζουν ένα ηλεκτρικό δίπολο με διπολική ροπή m=q.l.
- Σε έναν χημικό δεσμό, η διπολική ροπή οφείλεται στην μετατόπιση του νέφους των ηλεκτρονίων σε ένα από τα άτομα.
Aν το μόριο είναι διατομικό, υπάρχει μόνο ένας δεσμός (απλός , διπλός ή τριπλός) τότε η διπολική ροπή δεσμού είνα
Δεσμός μη πολικός, δεσμός ομοιοπολικός πολικός, δεσμός ιοντικός
Στην μοριακή διπολική ροπή
η τιμή της είναι από 0 D έως 11 D. Παράδειγμα ένα διατομικό μόριο με μηδενική διπολική ροπή είναι το Cl2 κι άλλο το HBr που έχει διπολική ροπή 10,5 D

Αν η διαφορά ηλεκτραρνητικότητας των ατόμων είναι χαμηλή και διπολική ροπή είναι κοντά στο μηδέν κια μικρότερη του 0,5 ονομάζεται δεσμός μή πολικός
Ένας χημικός δεσμός χαρακτηρίζεται πολικός ομοιοπολικός αν η διαφορά ηλεκτραρνητικότητας των ατόμων είναι μεγάλίτερη του 0,5 αλλά μικρότερη του 2 και η διπολική ροπή είναι σημαντικά διαφορετική από το μηδέν Παραδείγματα το νερό με =1,85D και η αμμωνία με-1,45Δ
Ένας χημικός δεσμός χαρακτηρίζεται ετεροπολικός ή ιοντικός αν η διαφορά ηλεκτραρνητικότητας των ατόμων είναι μεγαλύτερη του 2 και το μόριο διασπάτοι σε ιόντα
Παράδειγμα ένα διατομικό μόριο με μεγάλη διπολική ροπή είναι το KBr σε αέρια φάση που έχει διπολική ροπή 10,5 D
Χαρακτηριστικά παραδείγματα μορίων
Προπάνιο CH3CH2CH3 MB=44 μ=0,1D ΣΖ=-44oC
Διμεθυλαιθέρας CH3-O-CH3 MB=46 μ=1,3D ΣΖ=-46o
Ακεταλδευδη CHO-CH3 MB=44 μ=2,7D ΣΖ=21oC
Αιθανονιτρίλιο CH3CN MB=41 μ=3,9D ΣΖ=82οC
Διπολική ροπή συστήματος Ν φορτισμένων σωματιδίων. Διπολική ροπή πολυατομικών μορίων
Για ένα σύστημα Ν σωματιδίων: Αν έχουμε σύστημα Ν σωματιδίων που συνολικά είναι ηλεκτρικά ουδέτερο
με φορτία των σωματιδίων qi και το διάνυσμα της απόστασης μεταξύ τους ri, ο υπολογισμός της συνολικής ηλεκτρικής διπολικής ροπής είναι πολυπλοκότερος. Μπορεί να υπολογιστεί
α. σαν διανυσματικό άθροισμα των μεμονωμένων διπολικών ροπών των χημικών δεσμών
Το διάνυσμά της κατευθύνεται από το κέντρο βάρους των αρνητικών φορτίων στο κέντρο βάρους των θετικών φορτίων
Σε μόρια και μοριακά συστήματα το κέντρο βάρους των θετικών φορτίων συμπίπτει με τις θέσεις των ατομικών πυρήνων και η κατανομή των ηλεκτρονίων περιγράφεται από την πυκνότητα πιθανότητας.
Ετσι σε ένα μόριο που αποτελείται από τρία ή και περισσότερα άτομα μπορεί να υπάρχουν περισσότεροι χημικοί δεσμοί, με διαφορετική πολικότητα
Β. Υπολογίζοντας τις διπολικές ροπές ξεχωριστά των θετικών και ξεχωριστά των αρνητικών φορτίων και αθροίσουμε διανυσματικά
Η διπολική ροπη του μορίου εξαρτάται όχι μόνο απότην διαφορά ηλεκτραρνητικότητας
αλλά και από την γεωμετρική διαμόρφωση και το μέγεθος του μορίου
α. Διαφορά στην ηλεκτραρνητικότητα
Όπως αναφέρθηκε αν σε έναν χημικό δεσμό η διπολική ροπή είναι σημαντικά διαφορετική από το μηδέν εάν τα δύο άτομα του δεσμού έχουν μεγάλη διαφορά ηλεκτραρνητικότητας.
Επίσης διαφορά στην ηλεκτραρνητικότητα συχνά ιδίως σε οργανικά μόρια, η ύπαρξη λειτουργικών χαρακτηριστικών ομάδων όπως Οξυγόνο, Φωσφόρος, Άζωτο και θείο και δημιουργεί πολικότητα στο μόριο. Όπως CH3COOH, C2H5CONH2, CH3OH K.A.
Όταν αυξάνει ο αριθμός των ανθράκων η πολικότητα στο μόριο ελλατώνεται
β. Στην γεωμετρική του διαμόρφωση
Για να βρούμε την διπολική ροπή ενός μορίου δεν αρκεί μόνο να έχουμε τις διπολικές ροπές των ατόμων του αλλά
την γεωμετρική του διαμόρφωση εφόσον οι διπολικές ροπές αθροίζονται διανυσματικά.

Σε κάποιες περιπτώσεις συμβαίνει οι μεμονωμένοι δεσμοί να είναι πολικοί αλλά η συνολική διπολική ροπή του μορίου να είναι μηδέν όπως στο μεθάνιο.
Ας δούμε περιπτώσεις:

Το διοξείδιο του άνθρακα είναι μη πολικό, αν και ο διπλός δεσμός C=O έχει διπολική ροπή. Όμως βρίσκονται σε ευθεία διάταξη και οι διπολικές ροπές αλληλοεξουδετερώνονται.
 Το μεθάνιο με την τετραεδρική γεωμετρία του έχει διπολική ροπή μηδέν, είναι μη πολικό μόριο.
Το μεθάνιο με την τετραεδρική γεωμετρία του έχει διπολική ροπή μηδέν, είναι μη πολικό μόριο.
Σε αντίθεση στην αμμωνία που το μόριό της αποτελεί τριγωνική πυραμίδα
έχουμε στον φλοιό του αζώτου 4 ζεύγη ηλεκτρονίων, τα 3 από τους ομοιοπολικούς δεσμούς με το υδρογόνο και το 4ο είναι το μονήρες ζεύγος του αζώτου. Αν τα ζεύγη αυτά ήταν ισότιμα όπως είναι στο μόριο του μεθανίου.
θα διατάσονταν σε κορυφές τετραέδρου όπως είναι στο μεθάνιο και το μόριο δεν θα εμφάνιζε πολικότητα.

Όμως αυτό δεν ισχύει και έτσι οι γωνίες στην διάταξη διαφέρουν ώστε το μονήρες ζεύγος ηλεκτρονίων δίνει στο μόριο της αμμωνίας διπολική ροπή
Το ίδιο παρατηρούμε αν τα υδρογόνα του μεθανίου (διπολική ροπή =0) μ=0D) αντικατασταθούν σταδιακά με άτομα χλωρίου. Η διπολική ροπή αυξάνει πολύ όταν στο ένα άκρο του μορίου ένα υδρογόνο αντικατασταθεί με χλώριο (χλωρομεθάνιο με διπολική ροπή μ=1,92D) και μειώνεται σε επόμενες αντικαταστάσεις όταν τα επόμενα χλώρια που εισέρχονται (διχλωρομεθάνιο μ=1,6D, τριχλωρομεθάνιο μ=1,04D) ισορροπούν σχετικά την ανισοκατανομή φορτίου στο μόριο έως ότου στο τετραχλωρομεθάνιο μ=0D η διπολική ροπή μηδενίζεται
Ο πίνακας δείχνει αναλυτικές περιπτώσεις μορίων που η γεωμετρία τους επιρεάζει την διπολική τους ροπή
Η ηλεκτρική ροπή καθορίζει τις ηλεκτρικές ιδιότητες του ηλεκτρικού πεδίου του διπόλου ή του συστήματος φορτισμένων σωματιδίων αλλά και τις επιδράσεις που δέχονται αυτά από άλλα πεδία.
γ. το μέγεθος του μορίου
Το μέγεθος του μορίου επιρρεάζει το μέγεθος των δυνάμεων της διαμοριακής αλληλεπίδρασης. Όσο μεγαλύτερο είναι το μόριο τόσο πιο εύκολα έλκονται τα εξωτερικά ηλεκτρόνια από ένα άλλο μόριο και η διαμοριακή αλληλεπίδραση γίνεται ισχυρότερη
Παράδειγμα το ιώδιο πολώνεται ισχυρότερα από το φθόριο γιατί είναι μεγαλύτερο.
Για μεγάλα μόρια οι δυνάμεις London είναι ισχυρότερες από τις δυνάμεις διπόλου- διπόλου και σε πολύ μεγάλα ακόμα κι από τους δεσμούς υδρογόνου
Πίνακας 14. Χαρακτηριστικά των μορίων αλογόνου
| Ουσία | Φθόριο | Χλώριο | Βρώμιο | Ιώδιο |
| Μοντέλα μορίων και τα μεγέθη τους | 0,142 νμ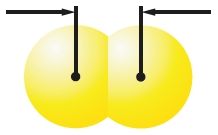 F2 |
0,198 νμ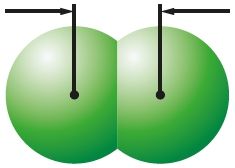 Cl2 |
0,228 νμ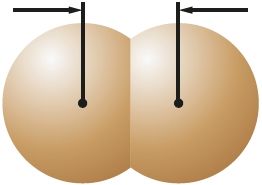 ΜΒ2 |
0,266 νμ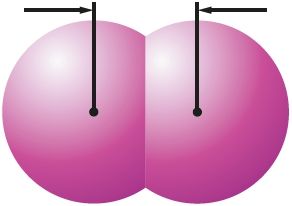 Εγώ2 |
| Σημείο ζέσεως, °C | –188,2 | –34,1 | +58,8 | +184,4 |
Aπό τις οργανικές ουσίες, Βουτάνιο ΣΖ= -0,5ο C, πεντάνιο ΣΖ= 36 oC, εξάνιο ΣΖ= 69ο C, επτάνιο ΣΖ= 98ο C, οκτάνιο ΣΖ=126ο C,
Δήμητρα Σπανού

Δήμητρα Σπανού
ΠΗΓΕΣ
Ηλεκτρική διπολική ροπή. Η Μεγάλη Ρωσική Εγκυκλοπαίδεια (bigenc.ru)
Ηλεκτρική διπολική ροπή - Βικιπαίδεια (wikipedia.org)
Διπολική ροπή δεσμού - Βικιπαίδεια (wikipedia.org)
Αμμωνία - Βικιπαίδεια (wikipedia.org)
https://slideplayer.gr/slide/16955556/
Anorganische Chemie: Atome, Atombindung und Moleküle (abitur-wissen.org)
https://www.slideshare.net/slideshow/diamoriakes-dynameis/174734230#3
05-ΔΙΑΜΟΡΙΑΚΕΣ ΔΥΝΑΜΕΙΣ .pdf (aua.gr)
Polarity And Electronegativity Relationship (windows.net)



