Δήμητρα Σπανού συνταξιούχος χημικός καθηγήτρια Βθμιας Εκπαίδευσης
υπό κατασκευή
ΕΙΙΣΑΓΩΓΙΚΟ
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΣΥΜΠΕΡΙΦΟΡΑ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ κ.λ.π.
Ο τομέας αυτός αποτελεί συνέχεια από τον προηγούμενο: Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΕΣΩΤΕΡΙΚΗ ΔΟΜΗ ΥΛΙΚΩΝ ΣΩΜΑΤΩΝ.
Πολλές φορές στα κεφάλαια για την εσωτερική δομή των υλικών σωμάτων, αναφέρονται και οι ιδιότητές τους, που πάντα σχετίζονται με την εσωτερική τους δομή. Όμως επειδή συνήθως πρόκειται γαι θέματα πιο εκτεταμένα και δυσκολονόητα, τα δίνω εδώ κάπως ξεχωριστά, ώστε να μην αποσπούν την προσοχή από το κυρίως θέμα που είναι η εσωτερική δομή των υλικών σωμάτων
ΑΛΛΟΤΡΟΠΙΑ ΚΑΙ ΑΛΛΟΤΡΟΠΙΚΗ ΣΥΜΠΕΡΙΦΟΡΑ ΧΗΜΙΚΏΝ ΟΥΣΙΩΝ
ΠΟΙΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΕΜΦΑΝΙΖΟΝΤΑΙ ΜΕ ΑΛΛΟΤΡΟΠΙΚΕΣ ΜΟΡΦΕΣ
ΤΙ ΕΙΝΑΙ Η ΑΛΛΟΤΡΟΠΙΑ
Σε ορισμένες περιπτώσεις κάποιο χημικό στοιχείο εμφανίζεται σαν δύο ή περισσότερες ουσίες ίδιες αλλά με διαφορετικό τρόπο συσσώρευσης, και με διαφορετικές ορισμένες ιδιότητές τους, που βρίσκονται όμως στην ίδια φάση. Αυτό ονομάστηκε Αλλοτροπία και διατυπώθηκε πρώτη φορά από τον Σουηδό Χημικό Berzelius
Οι απλές ουσίες είναι περίπου 400 πολύ γιατί μαζύ με τα χημικά στοιχεία του Περιοδικού πίνακα - που φτάνουν σήμερα τα 120 με τα τεχνητά-, συμπεριλαμβάνονται και οι αλλοτροπικές τροποποιήσεις τους. Αυτές που δίνουν επίσης απλές ουσίες οι οποίες έχουν όμως σε πολλές περιπτώσεις διαφορετικές ιδιότητες
(Το ίδιο φαινόμενο της αλλοτροπίας στις χημικές ενώσεις αλλά εκεί ονομάζεται ισομέρεια)
Στην Αλλοτροπία σε χημικά στοιχεία διακρίνουμε δύο περιπτώσεις.
Α. Αλλοτροπία σύνθεσης Διαφορετικός αριθμός ατόμων στο μόριο
 Παράδειγμα το οξυγόνο Ο2 και το Όζον Ο3 (αλλοτροπία σύνθεσης)
Παράδειγμα το οξυγόνο Ο2 και το Όζον Ο3 (αλλοτροπία σύνθεσης)
Β. Αλλοτροπία της μορφής, όταν υπάρχει διαφορετικός τρόπος τοποθέτησης των μορίων- ιόντων στο κρυσταλλικό πλέγμα
Η μεταβολή του κρυσταλλικού μεταλλικού πλέγματος εξαρτάται κατά μεγάλο βαθμό στις διαφορετικές δυνατότητες ολίσθησης για κάθε τύπο κρυσταλλικού πλέγματος
Παράδειγμα ο κασσίτερος Sn: σε θερμοκρασία μικρότερη από 13,2 έχουμε τον αSn που είναι γρίζος, κρυσταλλική σκόνη, πλέγμα διαμαντιού, μεταξύ 13,2 και 161 βαθμούς κελσίου έχουμε τον λευκό κασσίτερο βSn όλκιμο μέταλλο με μεταλλικό πλέγμα και με μεταλλική λάμψη ενώ σε υψηλότερες θερμοκρασίες 161 έως 232 τον γSn μεγάλη σκληρότητα και ευθραυστοτητα και ρομβικό πλέγμα,
Εδώ θα δώσω μόνο κάποια παραδείγματα αλλοτροπίας που αναφέρονται στην εσωτερική δομή των υλικών σωμάτων
Ένα συνηθισμένο τέτοιο παράδειγμα είναι το χημικό στοιχείο φωσφορος (Ρ) στον οποίο υπάρχουν 11 αλλοτροπικές Οι πιο γνωστές είναι ο λευκός (δηλητηριώδης, λάμπει στο σκοτάδι και μπορεί να έχει αυθόρμητη ανάφλεξη), ο ερυθρός φωσφόρος (δεν είναι δηλητηριώδης, δεν λάμπει στο σκοτάδι και δεν μπορεί να έχει αυθόρμητη ανάφλεξη), ο μαύρος φωσφόρος είναι χημικά αδρανής και αγώγιμος στο ηλεκτρικό ρεύμα
(Εδώ πρέπει να αναφέρω ότι υπάρχει το ίδιο φαινόμενο για τα κρυσταλλικά πλέγματα χημικών ενώσεων, αυτό όμως δεν λέγεται αλλοτροπία αλλά πολυμορφισμός)
ΑΛΛΟΤΡΟΠΙΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ
Η αλλαγή ενός αλλότροπου στοιχείου σε ένα άλλο μπορεί να συμβεί για διάφορες αλλαγές στις περιβαλλοντικές συνθήκες όπως στην Θερμοκρασία, στην Πίεση, στην Ηλεκτρομαγνητική Ακτινοβολία, που μπορεί να είναι φυσικοί ή λόγω επεξεργασίας (τεχνητοί)
Όταν αυτοί έχουν σαν αποτέλεσμα την αλλαγή στην δομή ενός χημικού είδους, ώστε με τις αλλαγές στην δομή του να έρχονται συνήθως τροποποιήσεις των φυσικών και χημικών του ιδιότητων έχουμε αλλοτροπικό μετασχηματισμό.
Αλλαγές μπορεί να εμφανιστούν στην συνέχεια, σε φυσικές ιδιότητες όπως η σκληρότητα (για στερεά), η ηλεκτρική αγωγιμότητα, το σημείο τήξης και το χρώμα αλλά και σε χημικές ιδιότητες όπως η οξειδοαναγωγική ικάνότητα, η αντοχή στην διάβρωση κ.α. .
 Η αλλοτροπία επίσης μπορεί να είναι μονότροπη, όταν ένα από τα αλλότροπα είναι σταθερότερο από τα άλλα και είναι δυνατή η μετάβαση από μια όχι σταθερή αλλοτροπική δομή σε μια σταθερή χωρίς να είναι δυνατό και το αντίστροφο.
Η αλλοτροπία επίσης μπορεί να είναι μονότροπη, όταν ένα από τα αλλότροπα είναι σταθερότερο από τα άλλα και είναι δυνατή η μετάβαση από μια όχι σταθερή αλλοτροπική δομή σε μια σταθερή χωρίς να είναι δυνατό και το αντίστροφο.
Παράδειγμα η μετάβαση του λευκού φωσφόρου υπό πίεση 1,25GPa και θερμοκρασία 200οC σε μαύρο (σταθερότερο αλλότροπο)

ή η μετατροπή του γραφίτη σε διαμάντι σε πίεση 6GPa και θερμοκρασία 1500Cο (με καταλύτη Ni, Cr, Fe κ.α.) ενώ το διαμάντι μετατρέπεται γρήγορα σε γραφίτησε θερμοκρασίες ανω των 1000Cο
και εναντιότροπη εάν τα διάφορα αλλότροπα επικρατούν σε διαφορετικές συνθήκες το κάθε ένα και μπορούν να μετατρέπονται το ένα στο άλλο ανάλογα και αυτό συνήθως συμβαίνει όταν οι αλλοτροπικές τροποποιήσεις γίνονται κάτω από το σημείο τήξεως.
Παράδειγμα ο σίδηρος: ο σίδηρος έως την θερμοκρασία των 770οC έχει πλέγμα κυβικό κεντρωμένο με παραμέτρους α=0,286nm και μαγνητικές ιδιότητες. Πάνω από αυτήν οι διαστάσεις του πλέγματος αυξάνονται έως τους 910ο C με α=0,290nm
ΠΟΥ ΟΦΕΙΛΟΝΤΑΙ ΚΑΙ ΠΩς ΠΡΑΓΜΑΤΟΠΟΙΟΥΝΤΑΙ ΟΙ ΑΛΛΟΤΡΟΠΙΚΕΣ ΜΕΤΑΒΑΣΕΙΣ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ
Οι μεταβάσεις χημικού στοιχείου από την μια στην άλλη ατομική ή μοριακή κατάσταση συμβαίνουν όταν αλλάζουν οι περιβαλλοντικές συνθήκες όπως: η θερμοκρασία, η πίεση η πίεση μαζί με την θερμοκρασία ηλεκτρομαγνητικές ακτινοβολίες.
Για τα στοιχεία που έχουν κυσταλλικά πλέγματα: Ας θυμιθούμε ότιαρχικά....
ένα κρυσταλλικό μεταλλικό πλέγμα είναι μια διάταξη των ιόντων του μετάλλου μέσα στον χώρο η οποία έχει ορισμένα χαρακτηριστικά που ονομάζονται παραμέτροι του μοναδιαίου κελιού (κυττάρου του πλέγματος). Αυτά είναι :
τον τύπο (δομή) του πλέγματος (κυβικό, εξαγωνικό κ.λ.π.) την πυκνότητα συσκευασίας (αριθμό των ατόμων ανά στοιχειώδες κύτταρο) την απόσταση μεταξύ των κυψελίδων.
Κατά την αλλοτροπική μετατροπή, η ουσία κρυσταλλώνεται σε διαφορετικές αλλοτροτροπικές τροποποιήσεις με την αλλαγή της μιας από τις τρεις παραμέτρους, ενώ οι άλλες δύο παράμετροι παραμένους σταθερές.
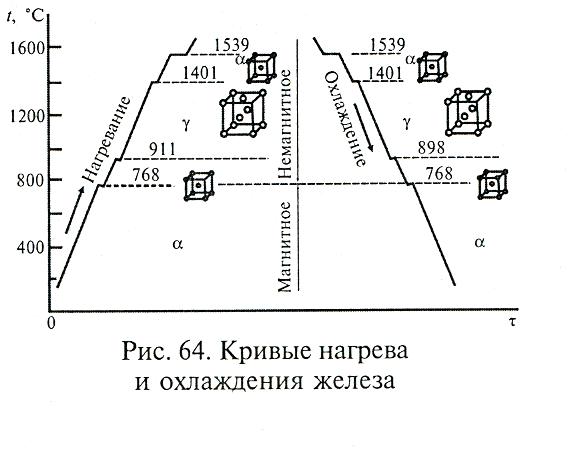 Τα μικροσωματίδια της απλής ύλης μπορεί να έχουν διαφορετικές μορφές με τις οποίες συντονίζονται τα άτομα και ιόντα του κρυσταλλικού πλέγματος, ανάλογα με τις περιβαλλοντικές συνθήκες για την μεγαλύτερη θερμοδυναμική ισορροπία.
Τα μικροσωματίδια της απλής ύλης μπορεί να έχουν διαφορετικές μορφές με τις οποίες συντονίζονται τα άτομα και ιόντα του κρυσταλλικού πλέγματος, ανάλογα με τις περιβαλλοντικές συνθήκες για την μεγαλύτερη θερμοδυναμική ισορροπία.
Το παράδειγμα του σιδήρου έχουμε μεταβολή του μεγέθους και των αποστάσεων των κυψελίδων, όταν σε θερμπκρασία έως 911οC το κρυσταλλικό πλέγμα του είναι κυβικό κεντρωμένο και σε θερμοκρασία από 911 έως 1401ο παραμένει μεν κυβικό κεντρωμένο αλλά αλλάζουν οι αποστάσεις μεταξύ των ατόμων του πλέγματος και εποεξαγωνικό πυκνά συσκευασμένομένως οι αποστάσεις μεταξύ των κυψελίδων ενώ ο τύπος του πλέγματος και η πυκνότητα συσκευασίας παραμένουν σταθερά
Το παράδειγμα του λιθίου έχουμε μεταβολή του τύπου του κρυσταλλικού  πλέγματος. Το Λίθιοπ σε θερμοκρασία
πλέγματος. Το Λίθιοπ σε θερμοκρασία

δωματίου περίπου 400οΚ έχει πλέγμα κυβικό επικεντρωμένο με αριθμό συσκευασίας 2 και α=0,35021nm και αριθμό συντονισμού 8
σε χαμηλες θερμοκρασίες κάτω από 78οΚ μετατρέπεται σε λίθιο εξαγωνικού πυκνά συσκευασμένου κρυσταλλικού πλέγματος με παραμέτρους κυττάρου α=0,3111nm και c=0,5093nm με πυκνότητα συσκευασίας Ζ=2 και αριθμό συντονισμού 12
Αν πρόκειται για μέταλλα
η αλλοτροπικές μεταβολές πραγματοποιούνται σε
μέταλλα που εμφανίζονται με αλλοτροπικές μορφές, τα οποία είναι κυρίως εκείνα που διαθέτουν πολλούς αριθμούς οξείδωσης που αλλάζουν με την θερμοκρασία. Το μεταλλικό πλέγμα που αποτελείται από ιόντα στους κόμβους και νέφος ηλεκτρονίων, επιρρεάζεται από την θερμοκρασία. Αλλαγές στην θερμοκρασία μπορούν να προκαλέσουν αλλαγές στις κινήσεις του νέφους των ηλεκτρονιων και αυτό να επιρρεάσει τα ιόντα στους κόμβους και την μετακίνησή τους στους κόμβους ενός νέου πλέγματος. Ο πολλαπλός αριθμός οξείδωσης βοηθά τα ιόντα να καλύψουν την απομάκρυνση των ηλεκτρονίων και να σταθεροποιούνται καλλίτερα.
ΣΕ ΠΟΙΑ ΣΤΟΙΧΕΙΑ ΕΜΦΑΝΙΖΟΝΤΑΙ ΑΛΛΟΤΡΟΠΙΚΟΙ ΜΕΤΑΣΧΗΜΑΤΙΣΜΟΙ
Έχει διαπιστωθεί ότι η αλλοτροπία ευνοείται σε χημικά στοιχεία που έχουν υψηλό βαθμό οξείδωσης και ικανότητα των ατόμων να συνδέονται σε ομοαλυσίδες. Επομένως περισσότεροι αλλοτροπικοί σχηματισμοί παρατηρούνται στα αμέταλλα και τα ημιμέταλλα.
Μόνο στα 28 από τα μέταλλα έχουμε -σε κανονική ατμοσφαιρική πίεση- αλλοτροπικές μορφές ενώ 6 σχηματίζουν αλλοτροπικές τροποποιήσεις με τεχνική επεξεργασία. Ο μεταλλιολόγος P. N. Vsilyev έδειξε πως τα στοιχεία που έχουν μεταβλητό σθένος που εξαρτάται από την θερμοκρασία παρουσιάζουν αλλοτροπία.
στην διεύθυνση chemicalstudy.ru/allotropiya-himicheskih-elementov/
υπάρχει ολοκληρωμένος πίνακας Χημικών Στοιχείων με τις αλλοτροπικές τους μεταποιήσεις. Παραθέτω τις πρώτες σειρές
Αλλοτροπία χημικών στοιχείων (μέρος 1):
| Ατομικός αριθμός | Χημικό στοιχείο
|
Σύμβολο | Αλλοτροπία χημικών στοιχείων |
| 1 | Υδρογόνο | H | |
| 2 | Ήλιο | Αυτός | |
| 3 | Λίθιο | Λι | 3 αλλοτροπικές τροποποιήσεις λιθίου:
- λίθιο με κυβικό κρυσταλλικό πλέγμα με κέντρο τον όγκο, |
ΠΗΓΕΣ
Μονοτροπία | Αυτό είναι... Τι είναι η Μονοτροπία;
Ποια στοιχεία έχουν αλλοτροπικές τροποποιήσεις
Πίνακας αλλοτροπίας μετάλλων και αμετάλλων
https://www.bing.com/images/search?view=detailV2&ccid=qX1DwdDE&id=3BB8B80ADB71CD14DF89066BEFD1A6255159CBBB&thid=OIP.qX1DwdDE2NQauw3I27OXOAHaF-&mediaurl=https%3a%2f%2fstudfile.net%2fhtml%2f2706%2f464%2fhtml_y4Xch3Paf1.EM7V%2fhtmlconvd-Obeg5A_html_fbf4e794190a64be.jpg&cdnurl=https%3a%2f%2fth.bing.com%2fth%2fid%2fR.a97d43c1d0c4d8d41abb0dc8dbb39738%3frik%3du8tZUSWm0e9rBg%26pid%3dImgRaw%26r%3d0&exph=461&expw=572&q=%d0%b0%d0%bb%d0%bb%d0%be%d1%82%d1%80%d0%be%d0%bf%d0%bd%d1%8b%d0%b5+%d1%84%d0%be%d1%80%d0%bc%d1%8b+%d0%b6%d0%b5%d0%bb%d0%b5%d0%b7%d0%b0&FORM=IRPRST&ck=5E924CEEDE06B1836778D7D85E3AB50F&selectedIndex=0&itb=0
Λίθιο, Ατομικές Ιδιότητες, Χημικές και Φυσικές Ιδιότητες
Αλλοτροπία χημικών στοιχείων (μέρος 1):
