Δήμητρας Σπανού καθηγήτριας Χημικού β/θμιας Εκπ/σης
υπό κατασκευή
Για την επίλυση και κατανόηση ασκήσεων σειράς αντιδράσεων
Υπάρχουν 2 ειδών ασκήσεις.
1.Αυτές που δίνουν τον Συντακτικό τύπο ενώσεων και ζητούν να συμπληρώσουμε αντιδράσεις ή σειρά αντιδράσεων.
2.Αυτές που δίνονται ενώσεις με άγνωστο Συντακτικό τύπο και μας ζητούν βάσει στοιχείων να καθορίσουμε εμείς τις ενώσεις αυτές.
Για να λύσουμε ασκήσεις τύπου 2 προσπαθούμε να βρούμε στην άσκηση κάποιο σημείο που να δίνει στοιχεία κάποιας από τις χημικές ενώσεις της άσκησης. όπως χαρακτηριστικές ιδιότητες, αντιδράσεις που δίνει κ.α.
Αλλαγή χρώματος, καταβύθιση ιζήματος, ελευθέρωση φυσαλίδων
Αν βρούμε έστω και έναν από τους τύπους που ψάχνουμε , μπορούμε με βάσει αυτόν να συνεχίσουμε και με άλλους.
Άσκηση 1
Οργανική ένωση Α C4H9Cl με αλκοολικό διάλυμα NaOH δίνει αλκένιο B C4H8 το οποίο με βρώμιο Br2 δίνει ένωση Γ C4H8Br2. To Γ με αλκοολικό διάλυμα ΚΟΗ δίνει αέριο Δ C4H6 το οποίο με νερό δίνει ένωση Ε C4H8O που δεν ανάγει το φελλίγγειο υγρό Ποιοι είναι οι συντακτικοί τύποι των ενώσεων Α, Β, Γ, Δ, Ε.
Λύση
Μελετάμε μια- μια τις ενώσεις με τον άγνωστο συντακτικό τύπο
'Ενωση Α: Πρόκειται για αλκυλαλογονίδιο που δεν γνωρίζουμε την θέση του αλογόνου
Ένωση Β Στο αλκένιο C4H8 δεν γνωρίζουμε την θέση του διπλού δεσμού
Ένωση Γ Στο διαλογονίδιο δεν γνωρίζουμε την θέση των 2 βρωμίων
Ένωση Δ. Αλκένιο που δεν γνωρίζουμε την θέση του διπλού δεσμού
Ένωση Ε. Η ένωση μπορεί να είναι αλδεύδη ή κετόνη με πιθανούς συντακτικούς ττύπους τους εξής: 1. CH3CH2CH2CHO 2. CH3COCH2CH3.
Ξεκινάμε από εκεί που μπορούμε να έχουμε κάποια ένδειξη
Εφόσον η ένωση Ε δεν ανάγει το φελλίγγειο υγρό πρόκειται για την 2 την κετόνη Ε : CH3COCH2CH3
H ένωση Ε είναι κετόνη που έχει προκύψει από ενυδάτωση του αλκενίου Δ . Το Δ που μπορεί να έχει συντακτικό τύπο 1.CH3CH2C≡CH 2.CH3C≡CCH3.
Εφόσον με ενυδάτωση δίνει κετόνη ο διπλός δεσμός πρέπει να είναι σε άνθρακα2
Ώστε πρόκειται για την 2.Βουτίνιο2 Δ: CH3C≡CCH3
Η ένωση Δ έχει προέλθει από την διβρωμοπαράγωγο Γ C4H8Br2
Αυτό μπορεί να είναι 1,3 διβρωμοπαράγωγο ή 1,2 διβρωμοπαράγωγο, ή 2,2 διβρωμοπαράγωγο , ή 1,1διβρωμοπαράγωγο ;h 2,3 διβρωμοπαράγωγο. Από αυτά αλκίνια δίνουν όσα έχουν τα βρώμια στον ίδιο άνθρακα ή σε γειτονικούς άνθρακες. Δηλαδή το 1,2 διβρωμοπαράγωγο το 1,1 διβρωμοπαράγωγο και το 2,2διβρωμοπαράγωγο. Από αυτό βουτίνιο2 παίρνουμε μόνο από το 2,3 διβρωμοπαράγωγο σύμφωνα με τον κανόνα του Saytseff.
Η ένωση2,3διβρωμοβουτάνιο Γ :CΗ3CΗBrCΗBrCH3
To αλκένιο που με την προσθήκη βρωμίου έδωσε το 2,3διβρωμοπαράγωγο είναι προφανώς το βουτένιο2 :Β :CΗ3CΗ=CΗCH3
Αυτό προήλθε με αφυδραλογόνωση του χλωροβουτάνιου (Α). Τα ισομερή του Α είναι χλωροβουτάνιο1 και χλωροβουτάνιο2. Το Α είναι το χλωροβουτάνιο2
Α :CΗ3CΗClCΗ2CH3 που σύμφωνα με τον κανόνα του Saytseff θα δώσει το βουτένιο2 με αφυδραλογόνωση.
Η σειρά των αντιδράσεων είναι η εξής:
1. CΗ3CΗClCΗ2CH3 +NaOH ------> NaCl + H2O + CΗ3CΗ=CΗCH3
2 CΗ3CΗ=CΗCH3 + Br2 -------> CΗ3CΗBrCΗBrCH3
3. CH3CHBrCHBrCH3 + NaOH (δ.αλκοολης)--> CH3C≡CCH3 (κύριο προϊόν)+2NaBr +2 Η-ΟΗ Άσκηση 2
1. Οι υδρογονώσεις σε διπλό -τριπλό δεσμό, τις περισσοτερες φορές γίνονται παρουσία νικελίου
2. Τα αντιδραστήρια Grignard παρασκευάζοναι με την επίδραση Mg σε RX σε απόλυτο αιθέρα
( από Χημεία Γ Λυκείου :Τα αντιδραστήρια Grignard παρασκευάζονται κατά την επίδραση Mg σε διάλυμα RX σε απόλυτο αιθέρα. RX + Mg απόλυτος αιθέρας RMgX Ο αιθέρας πρέπει να είναι απόλυτος, γιατί η παραμικρή ποσότητα νερού αντιδρά με το RMgX και δίνει αλκάνιο, οπότε καταστρέφεται το αντιδραστήριο Grignard: RMgX + HOH → RH + Mg(OH)X
3. Παρασκευή αλκυλαλογονιδίων Mια κατηγορία οργανικών ενώσεων που χρησιμοποιούται υχνά για παρασκευές άλλων οργανικών ενώσεων είναι τα αλκυλαλογονίδια.
Παρασκευάζονται κυρίως από αλκάνια που αντιδρούν με αλογόνα . Το αλογόνο όμως πρέπει να διασπαστεί σε ελεύθερες ρίζες Χ2 -(uv)--> 2Χ .και την συνέχεια να αντιδράσει με το αλκάνιο. Για τον λόγο αυτό απαιτείται υπεριώδες φως ή θερμότητα
Για τις διακρίσεις έχουμε υπ΄όψην μας
1.Οι ακόρεστες διακρίνονται από τις κορεσμένες γιατί αποχρωματίζουν διάλυμα βρωμίου ενώ οι ακόρεστες όχι.
RCH=CH2 + Br2 (διάλυμα κεραμέρυθρο) ---> RCH(Br)CH2(Br)
2. Οι αλκοόλες διακρίνονται από τους αιθέρες γιατί αντιδρούν με το Νάτριο και εκλύεται αέριο υδρογόνο. Οι αιθέρες (ίδιος μοριακός τύπος δεν αντιδρούν)
RCH2OH + Na --->RCONa + H2
3. Τα Καρβονικά οξέα και τα Aλκίνια με τριπλό δεσμό στην άκρη αντιδρούν επίσης με το Νάτριο και εκλύεται αέριο υδρογόνο
4. Aλκίνια με τριπλό δεσμό στην άκρη. Με αμμωνιακό διάλυμα χλωριούχου χαλκού καταβυθίζεται κεραμέρυθρο ίζημα
RC≡CH+ CuCl + NH3 --->RC≡CCu
5. Τα οργανικά οξέα ελευθερώνουν διοξείδιο του άνθρακα αν αντιδράσουν με ανθρακικό νάτριο
RCOOH + Na2CO3 --> RCOONa + CO2
6. Η αλοφορμική αντίδραση δείχνει ότι άχουμε κετόνες ή αλκοόλες με την ομάδα στον δεύτερο άνθρακα ή ακεταλδεύδη
Άσκηση 3
Έξη δοχεία περιέχουν μια από τις ακόλουθες χημικές ενώσεις C6H16, C3H7C≡CH, CH3CH(COH)CH3, CH3COCH3, CH3CH2CH2COOH, CH3CH2CH=O
1. Tα Α . Β. Ε. δοχεία με Na δίνουν Η2
2. Τα Β και Δ δίνουν την αλοφορμική αντίδραση
3. Τα Α, Γ, και ΣΤ αποχρωματίζουν το δ/μα Βρωμίου
4. Τα Β και ΣΤ οξειδώνονται από διάλυμα KMnO4
Απάντηση
1. Μπορεί να είναι τα C3H7C≡CH, CH3CH(COH)CH3, CH3CH2CH2COOH
2. Μπορεί να είναι τα CH3CH(COH)CH3, CH3COCH3.
3. Μπορεί να είναι οι ακόρεστες C8H16, C3H7C≡CH,
4. Οξειδώνονται η αλκοόλη CH3CH(COH)CH3 σε κετόνη και η αλδεύδη CH3CH2CH=O
σε οξύ
Η Α είναι η C3H7C≡CH, Η Β είναι η CH3CH(COH)CH3 η Γ είναι η άλλη ακόρεστη C8H16 η Δ είναι η CH3COCH3 η Ε η τρίτη που αντιδρά με Na είναι CH3CH2CH2COOH και η ΣΤ
Άσκηση 4
Η ένωση C4H10O παρουσιάζει τις παρακάτω χημικές ιδιότητες 1. αντιδρά με μεταλλικό νάτριο 2. αποχρωματίζει όξινο διάλυμα υπερμαγγανικού καλίου 3. αντιδρά με αλκαλικό διάλυμα Ιωδίου και δίνει Ιωδοφόρμιο Ποιος είναι ο συντακτικός τύπος και η ονομασία της ένωσης. (εξετάσεις 1985)
Λύση
Η ένωση C4H10O μπορεί να είναι αλκοόλη ή αιθέρας. Πρόκειται για αλκοόλη αφού αντιδρά με μεταλλικο νάτριο. (τα αλκίνια με ακραίο τριπλό δεσμό και τα οξέα αποκλείονται από τον μοριακό τύπο της ένωσης. Ο αποχρωματισμός του διαλύματος υπερμαγκανικού Καλίου δείχνουν ότι η ένωση οξειδώνεται σε καρβονυλική ένωση (αν είναι δευτεροτεγής αλκοόλη) η σε οξύ (αν είναι πρωτοταγής αλκοόλη) .
Αλλά αφού δίνει την αλοφοορμική πρόκειται για δευτεροταγή αλκοόλη με το ΟΗ στην 2 θέση . Έχουμε λοιπόν την βουτανόλη2 CH3CH2CH(OH)CH3
CH3CH2CH(OH)CH3 +Na ---> CH3CH2CH(ONa)CH3 +1/2 H2
σε κετόνη: R-C=O R΄+ HCN --> RC*OH (CN)R΄ B είναι RC*(R΄)OH(CN) (Ο αριθμός των ανθράκων του R και του R΄μαζί είναι 3)
Υδρόλυση του υδροξυνιτρίλιου με τον ασύμμετρο άνθρακα δίνει υδροξυοξέα
RC*(R΄)OH CN + ΗOH --> RC*(R΄)OH COOH + NH3 + H+)
Αφού η Α (R-CΟR΄) δίνει αλοφορμική αντίδραση R΄ είναι CH3 και R αλκύλιο ή υδρογόνο. και R είναι C2H5
kai η Α είναιC2H5COCH3 kai η Β είναι C2H5COH(CH3)CN
C2H5COCH3+ 3Ι2 + 4NaOH ---> CHI3 + C2H5COONa + 3H2O + 3NaI το αλάτι Γ είναι C2H5COONa
2C2H5COONa + H2SO4 ---> 2 C2H5COOH + Na2SO4 αυτό είναι το προϊόν Δ είναι C2H5COOH που αντιδρά με ανθρακικό ασβέστιο
C2H5COOH + Ca(OH)2 ---> (C2H5COO)2 Ca + 2H2O το αλάτι είναι το (C2H5COO)2Ca που στην συνέχεια συμπυκνώνεται με ισομοριακή ποσότητα μυρμυγκικού ασβεστίου (HCOO)2Ca 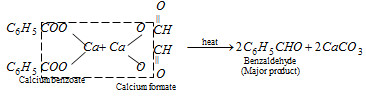
(C2H5COO)2 Ca + (HCOO)2Ca --->2C2H5CHO + 2CaCO3 H Ε είναι η C2H5CHO
Η Ε αντιδρά με αντιδραστήριο Tollens
C2H5CHO + NH3 + AgNO3 ----> C2H5COONH4 +2Ag + 2NH4NO3
To ΣΤ προιόν είναι C2H5COONH4
.
Ασκηση 6
Να συμπληρώσουμε τις αντιδράσεις
CH3CΗ=CH2 +Cl2----> A
A+ 2NaOH -----> B + 2NaCl + 2H2O
B+H2O --------> Γ
Γ + HCN -------> Δ
Δ + 2Η2Ο ------> Ε + ΝΗ3
Ε + NaOH ------> ΣΤ + Η2Ο
Άσκηση 7
Οργανική ένωση Α C4H9OH εμφανίζει οπτική ισομέρια Στην Α επιδρά θειονυλοχλωρίδιο SOCl2
και λαμβάνεται σχεδόν ποσοτικά η ένωση B: C4H9Cl . Στην Β επιδρά κυανιούχο κάλιο ΚCN και το λαμβανόμενο προϊόν είναι το Γ. Αυτό υδρολύεται και προκύπτει η ένωση Δ στην οποία επιδρά υδροξύδιο του νατρίου NaOH και δίνει τηνένωση Ε. Αν η ένωση Ε επιδράσει στην ένωση Β προκύπτει οργανικός εστέρας Ζ. Ποιες είναι οι αυτές ενώσεις. Α, Β, Γ, Δ, Ε, Ζ.
Λύση
Η 'ενωση Α μπορεί να είναι αλκόλη ή αιθέρας. Το γεγονός ότι εμφανίζει οπτική ισομέρεια μας οδηγεί στο συμπέρασμα ότι υπάρχει σ αυτή ασύμμετρο άτομο άνθρακα. Από τα ισομερή, η μόνη ένωση που έχει είναι η βουτανόλη2 Α: CH3CH2CH(OH)CH3. Aν στην Α επιδράσει θειονυλοχλωρύδιο προκύπτει χλωροβουτάνιο2 Β: CH3CH2CHClCH3.
Στην συνέχεια επιδρά στο χλωροβουτάνιο το κυανιούχο κάλιο το οποίο υποκαθιστά το χλώριο και δίνει νιτρίλιο Γ: CH3CH2CH(CN)CH3.
Το νιτρίλιο αυτό υδρολύεται και προκύπτει καρβοξυλικό οξύ Δ: CH3CH(CH3)COOH.
Το οξύ εξουδετερώνεται με NaOH και δίνει το οργανικό αλάτι E: CH3CH(CH3)CΟΟNa.
4. CH3 C≡ CCH3 +ΗOH → CH3-CH2COΗ=CH2 (ενόλη)--> CH3CH2-CO-CH3 (κετόνη) (προσθήκη κατά Markovnikov και ισομερίωση για σταθερότερη ένωση)
Δήμητρα Σπανού
