Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός, έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιότερα, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος να έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη όπως διαμορφώνεται κάθε νέα εξεταστική περίοδο
Δήμητρα Σπανού
υπό κατασκευή
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2017-2018 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
ΕKTΟΣ ΑΠΟ:
- την υποενότητα «Επαγωγικό φαινόμενο» της παρ. 7.1 «Δομή οργανικών ενώσεων - Διπλός και τριπλός δεσμός- Επαγωγικό φαινόμενο»,
- την παρ. 7.2 «Στερεοϊσομέρεια (εναντιομέρεια και διαστερεομέρεια)»,
- τις υποενότητες «Η αλογόνωση των αλκανίων», «Η αρωματική υποκατάσταση» και «Μερικοί μηχανισμοί οργανικών αντιδράσεων» της παρ. 7.3 «Κατηγορίες οργανικών αντιδράσεων και μερικ οί μηχανισμοί οργανικών αντιδράσεων»,
- την υποενότητα «Οργανικές συνθέσεις» της παρ. 7.4 «Οργανικές συνθέσεις - Διακρίσεις» με εξαίρεση την αλογονοφορμική αντίδραση
Οργανική Χημεία
Από Κεφ7 παρ 7.3 σημεία από την θεωρία που πρέπει να προσέξουμε
Αντιδράσεις οξείδωσης και αναγωγής στην Οργανική Χημεία
Το θέμα της οξείδωσης και της αναγωγής θεωρείται γνωστό.
Εδώ αναφέρονται περιπτώσεις οργανικών αντιδράσεων στις οποίες αλλάζει ο αριθμός οξείδωσης, σε συγκεκριμένο/α άτομα άνθρακα της ένωσης.
Δηλαδή όταν για παράδειγμα, η προπανάλη CH3CH2CH2OH οξειδώνεται σε προπανικό οξύ, οξειδώνεται συγκεκριμένα ο άνθρακας 1 και κανένα άλλο άτομο. απο τον άνθρακα αυτόν έχουμε απομάκρυνση αρνητικού φορτίου/ αύξηση του αριθμού οξείδωσης
Πως υπολογίζουμε το φορτίο του οξειδούμενου ή αναγόμενου άνθρακα της ένωσης
Για να υπολογίσουμε το φορτίο του συγκεκριμένου άνθρακα αθροίζουμε αλγεβρικό τα φορτία όλων των ατόμων της ένωσης και τα εξισώνουμε με το 0 ή με το συνολικό φορτίο του συμπλέγματος των ατόμων

Η πυκνότητα του ηλεκτρικού φορτίου σε ένα άτομο άνθρακα δίνει την έννοια της μεγαλύτερης ενέργειας ενώ μια ένωση οξειδωμένη φέρει ο οξειδωμένος άνθρακας φέρει μικρότερη ενέργεια
Πότε έχουμε οξείδωση μιας οργανικής ένωσης
Η ηλεκραρνητικότητα ενός ή περισσότερων από τους άνθρακες της ένωσης ελλατώνεται και και το αρνητικό φορτίο γύρω του/τους αραιώνει και ο αριθμός οξείδωσης αυξάνεται . Αυτό γίνεται αν ο άνθρακας αυτος της ένωσης,
. α. συνδεθεί με άλλο άτομο με μεγαλύτερη από αυτό ηλεκτραρνητικότητα όπως το οξυγόνο, το άζωτο, τα αλογόνα C-O, C-N, C-X
Π.χ. αιθάνιο (CH3CH3) με πάρουμε αιθανόλη (CH3CH2OH)
ή αν από μεθάνιο με ΑΟ στον άνθρακα με ΑΟ -4 πάρουμε χλωρομεθάνιο (CH3Cl) ή αιθανόλη (CH3ΟΗ) με ΑΟ -2 αύξηση του ΑΟ κατά 2
[ο άνθρακας κερδίζει το ηλεκρικό φορτίο που οφείλεται στους 3 ομοιοπολικούς δεσμούς του με τα 3 άτομα υδρογόνου αλλά χάνει το φορτίο του ομοιοπολικού δεσμού με το χλώριο άρα -3-1 =-2 με τελικό αριθμό οξείδωσης -2].
β. αν διασπαστουν δεσμοί υδρογόνου. Από διπλό δεσμό μεταβούμε σε απλό δεσμό. π.χ από αιθάνιο (CH3CH3) με ΑΟ -3 παίρνουμε αιθένιο (CH2=CH2) me AO -2 έχουμε αύξηση του ΑΟ κατά 1
Πότε έχουμε αναγωγή μιας οργανικής ένωσης
Η ηλεκραρνητικότητα ενός ή περισσότερων από τους άνθρακες της ένωσης αυξάνεται και και το αρνητικό φορτίο γύρω του/τους πυκνώνει και ο αριθμός οξείδωσης ελατώνεται . Αυτό γίνεται αν ο άνθρακας αυτος της ένωσης,
. α. αποσυνδεθεί με άλλο άτομο με μεγαλύτερη από αυτό ηλεκτραρνητικότητα που είναι συνδεδεμένο όπως το οξυγόνο, το άζωτο, τα αλογόνα C-O, C-N, C-X Π.χ. από αιθανόλη (CH3CH2OH) με ΑΟ ανθρακα -1 πάρουμε αιθάνιο (CH3CH3) με ΑΟ -3 μείωση ΑΟ κατά 2
β. αν διασπαστουν δεσμοί υδρογόνου. Από διπλό δεσμό μεταβούμε σε απλό δεσμό
Η ηλεκραρνητικότητα του άνθρακα αυξάνει και το αρνητικό φορτίο γύρω του πυκνώνει, εάν συνδεθεί με άλλο άτομο με μικρότερη από αυτό ηλεκτραρνητικότητα όπως το υδρογόνο. C-H
Παράδειγμα στο μεθάνιο (CH4) ο άνθρακας κερδίζει το ηλεκτρικό φορτίο που οφείλεται στους 4 ομοιοπολικούς δεσμούς του με τα 4 άτομα υδρογόνου με αριθμό οξείδωσης -4, στο αιθάνιο (C2H6) οι δύο άνθρακες φέρουν αριθμό οξείδωσης -3 ενώ στο αιθένιο (C2H4)οι δύο άνθρακες φέρουν αριθμό οξείδωσης -2 και στο αιθίνιο (C2H2)οι δύο άνθρακες φέρουν αριθμό οξείδωσης -1
Παρόμοια από αιθάνιο (CH3CH3) με ΑΟ -3 πάιρνουμε αιθένιο (CH2=CH2) με ΑΟ -2 αύξηση κατά 1
Πολλές από τις αντιδράσεις της παρ 7.3 προσθήκης , απόσπασης, υποκατάστασης, πολυμερισμού, αποτελούν και αντιδράσεις οξειδοαναγωγής.
Πότε δεν έχουμε αντίδραση οξείδωσης ή αναγωγής
Η ηλεκραρνητικότητα του άνθρακα παραμένει ίδια εάν συνδεθεί με άλλο άτομο άνθρακα C-C
Παραδείγματα οργανικών οξειδώσεων
Οξείδωση αλκοολών
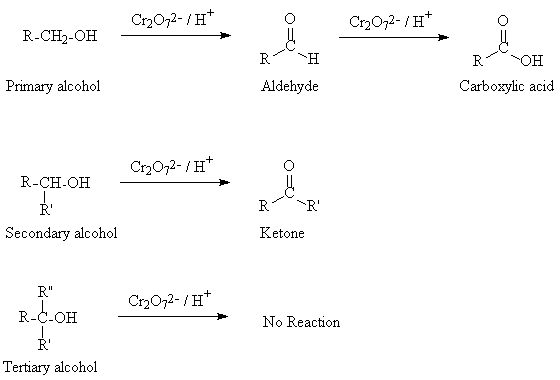
Οι πρωτοταγείς αλκοόλες αρχικά οξειδώνονται σε δύο στάδια.
Πρώτη βαθμίδα οξείδωσης
Αρχικά σε αλδεϋδες με ήπια οξειδωτικά μέσα όπως το διχρωμικό κάλιο (K2Cr2O7) ή καταλυτικά με θέρμανση παρουσία χαλκού
Σε δεύτερο στάδιο σε οργανικά οξέα με ισχυρότερα οξειδωτικά μέσα όπως το υπερμαγκανικό Κάλιο (ΚΜnO4)
Παραδείγματα
5RCH2 OH + 4KMnO4 + 6H2 SO4 → 5RCOOH + 4MnSO4 + 2K2 SO4 + 11Η2 O
3RCH2 OH + 2K2 Cr2 Ο7 + 8H2 SΟ4 →3RCOOH + 2Cr2 (SΟ4 ) 3 + 2K2 SΟ4 + 11H2 Ο
Στις αντιδράσεις αυτές οι συντελεστές βρίσκονται βάσει της μεταβολής του αριθμού οξείδωσης του οξειδούνου άνθρακα. Η μεταβολή αυτή μπαίνει σαν συντελεστής στην ένωση του δεύτερου μέλους που περιέχει τον ανηγμενο άνθρακα.
Μεταβολή Αριθμών οξείδωσης στις οξειδώσεις αλκοολών
Από -1 που είναι στις πρωτοταγείς αλκοόλες φτάνει σε +1 στις αλδευδες kαι από -2 που είναι στη μεθανόλη φτάνει σε 0 στις μεθανάλη μεταβολή κατα 2
και +3 στα οργσνικά οξέα και +2 στα μεθανικό οξυ μεταβολή κατά 4
Από 0 που είναι στις δευτεροταγείς αλκοόλες φτάνει σε +2 στις κετόνες μεταβαλή κατά 2

Στην αιθανόλη ο αριθμός οξείδωσης του άνθρακα είναι -1 , στην αιθανάλη είναι +1 ενώ στο αιθανικό οξύ είναι +3
Τα δυο αυτά οξειδωτικά το υπερμαγκανικό κάλιο και το διχρωμικό κάλιο δίνουν χαρακτηριστικές αντιδράσεις και χρησιμοποιούνται για ανιχνεύσεις. ΣΤο υπερμαγκανικό κάλιο που το μαγγάνιο βρίσκεται σε μορφή ιόντων με αριθμό οξείδωσης +7 με χρώμα ιώδες όταν οξειδώνει , ανάγεται σε αριθμό οξείδωσης +2 και είναι άχρωμο
ΣΤο διχρωμικό κάλιο που το χρώμιο βρίσκεται σε μορφή ιόντων με αριθμό οξείδωσης +6 με χρώμα πορτοκαλί όταν οξειδώνει , ανάγεται σε αριθμό οξείδωσης +3 και είναι πράσινο
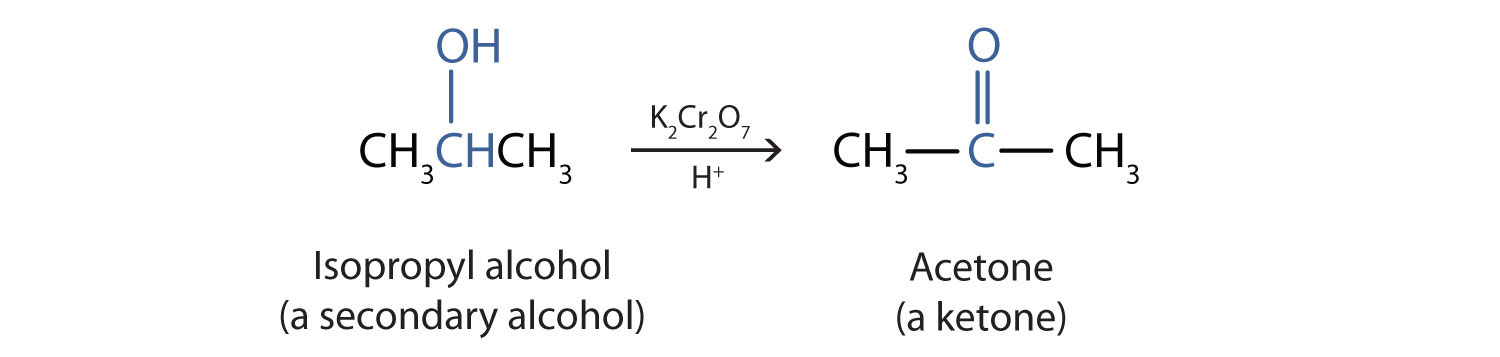
Οι δευτεροταγείς αλκοόλες οξειδώνονται σε ένα μόνο στην πρώτη βαθμίδα οξείδωσης σε κετόνες
Αυτό γίνεται με κάποιο οξειδωτικό μέσο όπως το διχρωμικό κάλιο ή με καταλυτική αφυδρογόνωση
Δεύτερη βαθμίδα οξείδωσης Οξείδωση αλδεϋδών σε οργανικά οξέα

Για την οξείδωση των αλδεϋδών, Εκτός από το διχρωμικό κάλιο (K2Cr2O7) και το υπερμαγκανικό Κάλιο (ΚΜnO4)
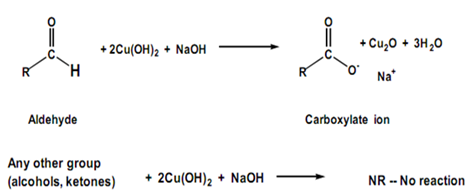
χρησιμοποιούνται και ήπια οξειδωτικά μέσα όπως το αντιδραστήριο Fehling (ή φελίγειο υγρό) και το αντιδραστήριο Tollens,
Kαι στις δυο περιπτώσεις οι αντιδράσεις αυτές δίνουν χαρακτηριστικά αποτελέσματα από τα οποία μπορούμε να συμπεράνουμε ότι πρόκειται για οξειδώσεις αλκοολών , οι οποίες δεν αντιδρούν με τα αντιδραστήρια αυτά παρά μόνο οι αλδεύδες.
Όταν οξειδώνεται αλδεϋδη με φελίγγειο υγρό το μονοξείδιο του χαλκού στο δεύτερο μέρος δίνει κεραμέρυθρο ίζημα
Όταν οξειδώνεται αλδεϋδη με το αντιδραστήριο Tollens τo o μεταλλικός άργυρος στο δεύτερο μέρος που προκύπτει από την αναγωγή των ιόντων αργύρου στο πρώτο μέλος της αντίδρασης σχημστίζει καθρέφτη (κάτοπτρο αργύρου) στα τοιχώματα του δοχείου της αντίδρασης
Τρίτη βαθμίδα οξείδωσης οργανικών οξέων σε διοξείδιο του άνθρακα, Μόνο για το μεθανικό οξύ και το οξαλικό οξύ και τα άλατά τους
5HCOOH + 2KMnO4 + 3H2 SO4 →5CO2 + 2MnSO4 + K2 SO4 + 8Η2 O
5(COONa)2 + 2KMnO4 + 8H2 SO4 →10CO2 + 2MnSO4 + K2 SO4 + 5Na2 SO4 + 8H2 O
Η μεταβολή του αριθμού οξείδωσης του άνθρακα είναι 2
Εάν θεωρήσουμε συνολική οξειδωτική αντίδραση με αρχική ένωση μεθανόλη και τελικό προιόν οξείδωσης του άνθρακα το διοξείδιο του άνθρακα η συνολική μεταβολή του αριθμού οξείδωσης του διοξείδιου του άνθρακα είναι 6.
Eπεκτείνοντας μπορούμε να συμπεριλάβουμε και τον υδρογονάνθρακα στην σειρά οξειδωτικών αντιδράσεων ώστε στην προκειμένη περίπτωση από το μεθάνιο μπορούμε με διαδοχικές οξειδωτικές αντιδράσεις να φτάσουμε στο διοξείδιο του άνθρακα
Μεθάνιο--> μεθυλική αλκοόλη--> μεθανάλη--> μεθανικό οξύ --> διοξείδιο του άνθρακα με συνολική μεταβολή του ΑΟ ίση με 8
Παραδείγματα οργανικών αντιδράσεων αναγωγής
Αναγωγή με προσθήκη υδρογόνου
Σε αλκένια
Παράδειγμα: Προσθήκη υδρογόνου σε αλκένια. Μείωση του ΟΑ του άνθρακα. Μεταβολή του άνθρακα του διπλού δεσμού στο αιθένιο, από 0 σε -1 μεταβολή κατά 1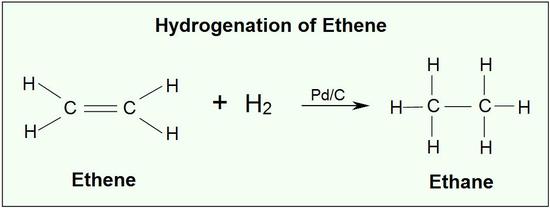
Προσθήκη υδρογόνου σε αλκίνια. Μεταβολή του άνθρακα του διπλού δεσμού στο αιθίνιο, από -1 σε -2 μείωση κατά 1 και από -2 σε -3 μείωση κατά 1

Σε αλδεύδες και κετόνες καταλυτική υδρογόνωση
 από την αλδεύδη στην πρωτοταγή αλκοόλη ο ΑΟ από 1 μειώνεται σε -1 , μεταβολή κατά 2
από την αλδεύδη στην πρωτοταγή αλκοόλη ο ΑΟ από 1 μειώνεται σε -1 , μεταβολή κατά 2
από την κετόνη στην δευτεροταγή αλκοόλη ο ΑΟ από 1 μειώνεται σε -1 , μεταβολή κατά 2
σε νιτρίλια CH3 C ≡N + 2Η2 → CH3 CH2 NH2
ο άνθρακας από ΑΟ+3 στο νιτρίλιο μειώνεται σε -1 μεταβολή κατά 4
Οργανικά Οξέα και βάσεις σαν οξειδωτικές και αναγωγικές ουσίες
Θεωρώντας την άποψη του Bronsted Lowry για τον προσδιορισμό των οξέων - βάσεων: Οξύ θεωρείται το σώμα που δίνει πρωτόνια ενώ βάσεις είναι οι δέκτες πρωτονίων. Έτσι είναι καθαρό το γεγονός ότι τα οξέα και οι βάσεις αποτςλούν ενώσεις οξειδωτικές ή αναγωγικές.
Τα οξέα αποτελούν ουσίες που ανάγονται.
Εφόσον ένα οξύ έχει την ιδιότητα να αποβάλει πρωτόνια (Η+) δηλαδή θετικό φορτίο αυτό σημαίνει αύξηση της ηλεκτραρνητικότητάς του
δηλαδή αύξηση του αρνητικού του του αρνητικού του φορτίου (αφού προστίθεται και το αρνητικό φορτίο του υδρογόνου που αποχωρεί σαν πρωτόνιο).
Άρα ο αριθμός οξειδώσεώς του μειώνεται. Οι οργανικές ουσίες που αποβάλουν πρωτόνιο (οξέα κατά Bronsted Lowry) αποτελούν σώματα που ανάγονται.
Τέτοια σώματα είναι τα καρβοξυλικά οργανικά οξέα RCOOH, oi αλκοόλες RCH2OH, η φαινόλη C6H5OH, και τα αλκίνια τύπου R-C≡C-H
Ποιες οργανικές ενώσεις μπορούμε να κατατάσουμε στα οξέα:
Για να εκδηλώσουν την όξινη δράση τους όμως ταοργανικά οξέα RCOOH, oi αλκοόλες RCH2OH, η φαινόλη C6H5OH, και τα αλκίνια τύπου R-C≡C-H
πρέπει να υπάρξει ο αποδέκτης πρωτονίων (η α βάση κατά Bronsted Lowry) που να είναι ουσία με μικρότερη ηλεκτραρνητικότητα ώστε να αποδεκτεί τα πρωτόνια.
Το νερό όπως ξέρουμε διίσταται ως εξής , H2O + H2O <--> H3Ο+ + OH-
Αν η ηλεκτραρνητηκότητα των οργανικών ουσιών που αναφέραμε υπερβαίνει αυτήν του νερού, τότε το νερό παίζει ρόλο βάσης και δέχεται τα πρωτόνια. Οι ουσίες αυτές είναι δύο. !. τα καρβοξυλικά οξέα 2. οι φαινόλες, που ιονίζονται (1) και αντιδρούν με τα βασικά διαλύματα και δίνουν άλατα (2)
1. RCOOH + H2 O --> RCOO- + H3 O+
2.RCOOH + NaOH → RCOONa + Η2 O
Οι αλκοόλες και τα αλκίνια,είναι ασθενέστερα οξέα, δεν ιονίζονται στο νερό και αντιδρούν μόνο με Νάτριο και Κάλιο σε αντικατάσταση του Υδρογόνου τους
Ποιες οργανικές ενώσεις μπορούμε να κατατάσουμε στις βάσεις:
Οι συζυγείς βάσεις των οργανικών οξέων όπως καρβοξυλικά ιόντα, φαινυλοξυανιόντα, αλκοξυανιόντα ανιόντα ακετυλιδίου
(RCOO- , C6H5O- , RCH2O- , RC≡C-) Ακόμα τα αλκύλοανιόντα R-
ΧΑρακτηριστικές βάσεις είναι οι αμίνες RNH2
ΠΗΓΕΣ
/www.bing.com/images/search?view=detailV2&ccid=ZBsGPPXb&id=2342E63D2708E9D
ebooks.edu.gr/modules/document/file.php/DSGL-C135/Διδακτικό%20Πακέτο/Βιβλίο%20Μαθητή/22-0231-02_Chimeia_C-Lyk-ThSp_BM.pdf
https://www.epil.gr/ekp_iliko/antidraseis_g_likeiou.pdf

