Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός, έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιότερα, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος να έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη όπως διαμορφώνεται κάθε νέα εξεταστική περίοδο
Δήμητρα Σπανού
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2017-2018 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
ΕKTΟΣ ΑΠΟ:
- την υποενότητα «Επαγωγικό φαινόμενο» της παρ. 7.1 «Δομή οργανικών ενώσεων - Διπλός και τριπλός δεσμός- Επαγωγικό φαινόμενο»,
- την παρ. 7.2 «Στερεοϊσομέρεια (εναντιομέρεια και διαστερεομέρεια)»,
- τις υποενότητες «Η αλογόνωση των αλκανίων», «Η αρωματική υποκατάσταση» και «Μερικοί μηχανισμοί οργανικών αντιδράσεων» της παρ. 7.3 «Κατηγορίες οργανικών αντιδράσεων και μερικ οί μηχανισμοί οργανικών αντιδράσεων»,
- την υποενότητα «Οργανικές συνθέσεις» της παρ. 7.4 «Οργανικές συνθέσεις - Διακρίσεις» με εξαίρεση την αλογονοφορμική αντίδραση
Οργανική Χημεία
Από Κεφ7 παρ 7.3 σημεία από την θεωρία που πρέπει να προσέξουμε
Η παράγραφος 7.3 καθώς και η επόμενη 7.4 θεωρούνται από τις δυσκολότερες της ύλης Οργανικής Χημείας καθώς περιέχουν πλήθος χημικών αντιδράσεων ΄έτσι που φαίνεται ακατόρθωτο να απομνηνευτούν από τον μαθητή. Περιέχει όμως και μηχανισμούς που δίνουν την λογική των αντιδράσεων αυτών. ώστε εάν γίνουν αυτοί κατανοητο, γίνεται αυθόρμητα ευκολότερη η προσπάθεια για την κατανόησή τους.
Εδώ δεν θα προσπαθήσω να ξαναγράψω όλες αυτές τις οργανικές αντιδράσεις που αναφέρονται στο σχολικό βιβλίο, αλλά να τονίσω σημεία από την θεωρία, που κάποιες φορές παρνούν απαρατήρητα, είναι όμως απαραίτητα και για την κατανόηση αλλά και για τις ασκήσεις που υπάρχουν κάτω από την θεωρία αυτή.
Αντιδράσεις Υποκατάστασης
Όταν σε ένα οργανικό μόριο, ένα άτομο ή μια ομάδα ατόμων αντικαθίσταται από μια άλλη
Υποκατάσταση σε αλκυλαλογονίδια
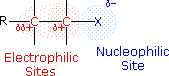 Από τα αλκυλαλογονίδια με υποκαταστάσεις παίρνουμε πολλά άλλα οργανικά προαίόντα. Η ερμηνεία είναι η εξής:
Από τα αλκυλαλογονίδια με υποκαταστάσεις παίρνουμε πολλά άλλα οργανικά προαίόντα. Η ερμηνεία είναι η εξής:
Τα αλκυλαλογονίδια μπορούν να δωθούν σαν ενώσεις Α+Β_ όπου το θετικό τμήμα της ένωσης αποτελεί το αλκύλιο και το αρνητικό το άτομο του αλογόνου. R+ X- Στόν δεσμό άνθρακα -Αλογόνου, τα αλογόνα Φθόριο, Χλώριο, βρώμιο, εμφανίζουν σημαντικά μεγαλύτερη ηλεκτραρνητικότητα από τον άνθρακα . Έτσι η λειτουργικλη ομάδα C-X είναι πολωμένη με τον άνθρακα ηλεκτρόφιλο και το αλογόνο πυρινόφιλο.
Γι αυτόν τον λόγο, τα αλκυλαλογονίδια μπορούν εύκολα να δώσουν αντιδράσεις πυρηνόφιλης υποκατάστασης . Αυτό βέβαια εξαρτάται και από την δύναμη του ομοιοπολικού δεσμού άνθρακα αλογόνου. Για παράγειγμα στον πίνακα παρατηρούμε πως στο αιθάνιο ο δεσμός C-H είναι 368kj/mol ενώ στο αντίστοιχο αλκυλαλογονίδιο χλωροαιθάνιο είναι 343kj/mol άρα σταθερότερος.

 Aντίστοιχη ενέργεια δεσμού C-O, C-N, C-S κ.λ.π. μας δίνει την δυνατότητα ή μη των αντιδράσεων υποκατάστασης Π.χ. Ο δεσμός C-N είναι 300kj/mol δηλαδή ακόμη σταθερότερος από του C-cl του χλωροαιθάνιου. Η υποκατάσταση λοιπόν CH3CH2Cl + NH3 --> CH3CH2NH2 + HCl θα πραγματοποιηθεί
Aντίστοιχη ενέργεια δεσμού C-O, C-N, C-S κ.λ.π. μας δίνει την δυνατότητα ή μη των αντιδράσεων υποκατάστασης Π.χ. Ο δεσμός C-N είναι 300kj/mol δηλαδή ακόμη σταθερότερος από του C-cl του χλωροαιθάνιου. Η υποκατάσταση λοιπόν CH3CH2Cl + NH3 --> CH3CH2NH2 + HCl θα πραγματοποιηθεί
Αντιδράσεις υποκατάστασης του αλογόνου των αλκυλογονιδίων. Για παρασκευή αλκοολών, νιτριλίων, αιθέρων, αμινών, εστέρων, αλκινίων
Τα αλκυλαλογονίδιο λοιπόν, θεωρείται το υπόστρωμα ενώ η ένωση που αντιδρά με αυτό αποτελεί μια βάση κατά LEWIS. To υπόστρωμα χάνει το αλογόνο του το οποίο και δεν ευρίσκεται σε οργανικό προϊόν της αντίδρασης και έτσι το αλογόνο αναφέρεται σαν αποχωρούσα ομάδα.
Υποκατάσταση του αλογόνου από την ομάδα του υδροξυλίου - Παρασκευή αλκοολών
RX + NaOH (υδατικό Διάλυμα) --> ROH + NaX
Υποκατάσταση του αλογόνου από την ομάδα του κυάνιου (-CN )- Παρασκευή νιτριλίων
RX + KCN --> RCN + NaX
Υποκατάσταση του αλογόνου από αιθερομάδα (RO -) Παρασκευή αιθέρων
RX + R΄ONa --> ROR΄ + NaX
Υποκατάσταση του αλογόνου από την αμμωνία (ΝΗ3)- Παρασκευή αμινών
RX + ΗΝΗ2 --> RΝH2 + NaX
Υποκατάσταση του αλογόνου από εστερομάδα (ROO-) - Παρασκευή εστέρων
RX + R΄OONa --> ROOR΄ + NaX
Υποκατάσταση του αλογόνου από την ομάδα αλκινίουμε τον τριπλό δεσμό στην 1 θέση (RC≡C-) Παρασκευή ανώτερων αλκινίων
RX + R΄C≡CNa(ακετυλίδιο) --> R΄C≡CaR + NaX
Αντιδράσεις αλογόνωσης αλκοολών (υποκατάστασης του υδροξυλίου των αλκοολών). Για παρασκευή αλκυλαλογονιδίων
ROH + SOCl2 --> RCl + SO2 + HCl
Αντιδράσεις αλογόνωση αλκανίων . Για παρασκευή αλκυλαλογονιδίων (Φωτοχημική αντίδραση)
RH + X2 (φως)--> RX + HCl
Υδρόλυση εστέρα. Αντιδράσεις υποκατάστασης σε εστέρες (ROOR΄) . Υποκατάσταση της ομάδας OR από υδροξύλιο (ΟΗ-)
RCOOR΄ + ΗΟΗ (οξινο ή βασικό περιβάλλον)--> RCOOΗ + R΄ΟΗ
Εστεροποίηση οξέος. Αντιδράσεις υποκατάστασης σε οξέα. Υποκατάσταση της ομάδας υδροξύλιου (ΟΗ) του οξέος από (R΄Ο-) .
RCOOH + R΄ΟΗ (οξινο περιβάλλον)--> RCOOR΄ +Η2Ο
Σαπωνοποίηση εστέρα. Αντιδράσεις υποκατάστασης σε εστέρες (ROOR΄) . Υποκατάσταση της ομάδας R από νάτριο (Na)
RCOOR΄ + NaΟΗ (οξινο περιβάλλον)--> RCOONa + R΄ΟΗ
Αντιδράσεις Πολυμερισμού
Σε περιπτώσεις απλού πολυμερισμού ν μόρια από το μονομερές πολυμερίζονται (ενώνονται κατά κάποιον συγκεκριμένο τρόπο, με την διάσπαση συνήθως διπλών ή τριπλών δεσμών με αποτέλεσμα να δημιουργείται ένα μεγάλο μόριο με ν μονάδες )
Πολυμερισμός ενώσεων που έχουν την ρίζα βινύλιο -C=C-
Πολυμερισμός αιθενίου H2C=CH2
ν H2C=CH2 --> (-H2C-CH2- )ν
Πολυμερισμός βουτενίου
ν H2CCH=CHCH2 --> -(H2C)CH-CH(CH2)- )ν
Πολυμερισμός προπενίου
ν CH=CHCH2 --> (-CH-CH(CH2)- )ν
Πολυμερισμός βινυλοχλωρίδιου
ν HClC=CH2 --> (-HClC-CH2- )ν
Πολυμερισμός ακρυλονιτρίλιου
ν H(CΝ)C=CH2 --> (-H(CΝ)C-CH2- )ν
Πολυμερισμός στυρόλιου
Πολυμερισμός συζυγών 1,4 αλκαδιενίων -CH2=CACH=CH2- (A= H, CH2, Cl, )
Πολυμερισμός 2μέθυλο 1,3 βουταδιένιο (ισοπρένιο)
ν(-CH2=C (CH3)CH=CH2- ) --> (-CH2C (CH3)=CHCH2- )ν
Πολυμερισμός 2χλώρο 1,3 βουταδιένιο (χλώροπρένιο)
ν(-CH2=C (CCl)CH=CH2- ) --> (-CH2C (CCl)=CHCH2- )ν
Πολυμερισμός 1,3 βουταδιένιο
ν(-CH2=CH CH=CH2- ) --> (-CH2CH =CHCH2- )ν
Συνπολυμερισμός
Δύο ή περισσότερα είδη μονομερούς που το καθένα μπορεί να πολυμεριστεί και να δώσει απλό πολυμερές, πολυμερίζονται τώρα μαζί με αποτέλεσμα στο νέο πολυμερές να περιέχονται και τα δύο (ή περισσότερα είδη) των μονομερών με τυχαία ή εναλλασσόμενη κατανομή
Συνπολυμερισμός 1,3 βουταδιένιο με στυρόλιο προς τεχνητό καουτσούκ ή BUNA S

Συνπολυμερισμός 1,3 βουταδιένιο με ακρυλονιτρίλιο προς τεχνητό καουτσούκ ή BUNA Ν

ΠΗΓΕΣ
https://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/alhalrx1.htm
https://www.bing.com/images/search?view=detailV2&ccid=i%2bS2vDxf&id=9AA8B95C80C8651B09D4F2E3D7DBEFA153AE3B34&thid=OIP.i-S2vDxflW-b93jYqEeNxAHaDu&mediaurl=http%3a%2f%2fd2vlcm61l7u1fs.cloudfront.net%2fmedia%252F98f%252F98fb1cfc-0e2d-4d51-8656-7dc976d6f99b%252FphppEfsvz.png&exph=1030&expw=2046&q=Dissociation+Energy&simid=607993266500076593&selectedIndex=10&ajaxhist=0
ΠΗΓΕΣ
ebooks.edu.gr/modules/document/file.php/DSGL-C135/Διδακτικό%20Πακέτο/Βιβλίο%20Μαθητή/22-0231-02_Chimeia_C-Lyk-ThSp_BM.pdf
https://www.epil.gr/ekp_iliko/antidraseis_g_likeiou.pdf
/www.bing.com/images/search?view=detailV2&ccid=BryOU435&id=BBB838D1F5C7952B7058C028E3C2736928462869&thid=OIP.B
/www.bing.com/images/search?view=detailV2&ccid=BryOU435&id=BBB838D1F5C7952B70
