Tι θα πρέπει να καταλάβουμε από το βιβλίο της Χημείας Προσανατολισμού Γ τάξης Ενιαίου Λυκείου. Μια προσπάθεια να τονίστουν τα βασικά σημεία του μαθήματος με στόχο την κατανόησή του
από την Δήμητρα Σπανού χημικό, καθηγήτρια Δευτεροβάθμιας Εκ/σης 1ου Γυμνασίου Δάφνης
Παρ ότι είμαι καθηγήτρια Χημικός έχω πολλά χρόνια να διδάξω την Χημεία της Θετικής Κατεύθυνσης
στην οποία από ότι ξέρω , έχουν γίνει κάποιες αλλαγές στην ύλη από παλιά, που την δίδασκα φροντιστηριακά.
Θα ξεκινήσω μια προσπάθεια ,να δώσω με απλό και όσο γίνεται σύντομο τρόπο ,την ύλη του βιβλίου αυτού ,
με στόχο να μπορεί ο υποψήφιος να έχει , αρχικά, μια εικόνα σχετικά για τα θέματα που θα τον απασχολούν ανά κεφάλαιο
Ταυτόχρονα είναι και για μένα μια καλή ευκαιρία θα τα ξαναθυμηθώ και να ενημερωθώ για την ύλη όπως διαμορφώνεται κάθε νέα εξεταστική περίοδο
Δήμητρα Σπανού
ΑΠΟ ΤΗΝ ΕΞΕΤΑΣΤΕΑ ΠΑΝΕΛΛΑΔΙΚΩΝ ΕΞΕΤΑΣΕΩΝ ΛΥΚΕΙΩΝ 2017-2018 ΧΗΜΕΙΑ ΠΡΟΣΑΝΑΤΟΛΙΣΜΟΥ ΘΕΤΙΚΩΝ ΣΠΟΥΔΩΝ
ΕKTΟΣ ΑΠΟ:
- την υποενότητα «Επαγωγικό φαινόμενο» της παρ. 7.1 «Δομή οργανικών ενώσεων - Διπλός και τριπλός δεσμός- Επαγωγικό φαινόμενο»,
- την παρ. 7.2 «Στερεοϊσομέρεια (εναντιομέρεια και διαστερεομέρεια)»,
- τις υποενότητες «Η αλογόνωση των αλκανίων», «Η αρωματική υποκατάσταση» και «Μερικοί μηχανισμοί οργανικών αντιδράσεων» της παρ. 7.3 «Κατηγορίες οργανικών αντιδράσεων και μερικ οί μηχανισμοί οργανικών αντιδράσεων»,
- την υποενότητα «Οργανικές συνθέσεις» της παρ. 7.4 «Οργανικές συνθέσεις - Διακρίσεις» με εξαίρεση την αλογονοφορμική αντίδραση
Κεφ7 Οργανική Χημεία
Η Πληθώρα των οργανικών ενώσεων με την επικράτηση κυρίων ομοιοπολικών δεσμών απλών, διπλών και τριπλών όπως και ο σχηματισμός πολλών μεγάλων μορίων αλλά και πολυμερών ενώσεων, προυποθέτει ορισμένες γνώσεις, ούτως ώστε, φαινόμενα όπως
(Κεφ 7.1)
- η δημιουργία ομοιοπολικών δεσμών και η θεωρίες της,
- η σύνδεση ατόμων του οργανικού μορίου με ομοιοπολικούς δεσμούς, απλούς , διπλούς, τριπλούς δεσμούς,,
- ο τύπος του ομοιοπολικού δεσμού ως προς την επικάλυψη των τροχιακών, καθενός από τα ηλεκτρόνια που δημιουργούν το ομοιοπολικό ζεύγος
(σ και π)
- την συνολική ενέργεια του ομοιοπολικού δεσμού, όπως διαμορφώνεται με την αλληλοεπικάλυψη των μεμομωμένων τροχιακών καθενός από τα ηλεκτρόνια του ομοιοπολικού δεσμού, και εξαρτάται από την απόσταση των δύο πυρήνων
- Το φαινόμενο ,της υβριδοποίησης ορισμένων τροχιακών με την αναίρεση ορισμένων συγκεκριμένων τροχιακών του μορίου και την δημιουργία άλλων τροχιακών που είναι μεταξύ τους ισότιμα και συνολικά χαμηλότερης ενέργειας από αυτής του συνόλου των αρχικών που αναιρέθηκαν
- Τον σχηματισμό απλών , διπλών, τριπλών δεσμών σε ενώσεις του άνθρακα και την υβριβοποίηση διπλών δεσμών (εκτός ύλης)
- το επαγωγικό φαινόμενο, κατά το οποίο τα δεσμικά ηλεκτρόνια έλκοναι ανισομερώς, από τους δύο πυρήνες, λόγω υποκαταστατών διαφορετικής ηλεκτραρνητικότητας (εκτός ύλης)
- Η ανάκληση γνώσεων από το κεφ6 όπως η απεικόνηση των τροχιακών και ο κανόνας του Hund
Η δημιουργία χημικών δεσμών ερμηνεύεται κατά δύο τρόπους.
1. Η θεωρία δεσμού σθένους που στηρίζεται στην παραδοχή της ύπαρξης φορτισμένων σωματιδίων που περιστρέφονται γύρω από τον πυρήνα. Είναι φαινομενικά απλούστερη και συνήθως επιλέγεται εδώ για την ερμηνεία των φαινομένων. Στηρίζεται στον κανόνα της οκτάδας, δηλαδή του αριθμού των 8 ηλεκτρονίων που πρέπει το άτομο να έχει στην εξωτερική ηλεκτρονιακή στοιβάδα ( δομή ευγενών αερίων) για να είναι σταθερό.
2. Η θεωρία των μοριακών τροχιακών που χρησιμοποιείται εναλλακτικά ανάλογα με τις περιπτώσεις και είναι η έκφραση των αρχών της κβαντομηχανικής στο άτομο . Σύμφωνα με αυτήν το ηλεκτρόνιο δεν έχει καθορισμένη θέση αλλά πιθανότητα εύρεσης του ηλεκτρονίου σε κάθε σημείο γύρω από τον πυρήνα, η μαθηματική έκφραση της οποίας μαζύ με η γραφική της παράσταση (επίλυση της εξίσωσης Schrodinger )

είναι γνωστά σαν τροχιακά. Στο σχήμα έχουμε δύο τέτοια ένα για το πρωτόνιο του πυρήνα (μωβ) και ένα για το ηλεκτρόνιο της τροχαιάς (γαλάζιο) Το γαλάζιο τροχιακό της εικόνας είναι που θα μας απασχολήσει στην συνέχεια.
Συνήθως όμως τα τροχιακά κατανοούνται καλύτερα με την σχηματική εικόνα του ηλεκτρονιακού φορτίου γύρω από τον πυρήνα που προκύπτει από την περιστροφική κίνηση του ηλεκτρονίου ή σαν το "ηλεκτρονιακό νέφος" γύρω από τον πυρήνα που οφείλεται σε κάθε ένα ηλεκτρόνιο και όχι σαν επίλυση της εξίσωσης του Schrodinger.
(αλλά και έτσι διδάσκονται στην ύλη της Χημείας της Γ Λυκείου),
Έτσι όμως, με την παρομοίωση των τροχιακών σαν ηλεκτρονιακού νέφους γύρω από τον πυρήνα το οποίο οφείλεται στην κίνηση του κάθε ενός ηλεκτρονίου,
οι δυο αυτές θεωρίες αποκτούν κάποια συνάφεια που βάσει αυτής συνεχίζεται η μελέτη του ομοιπολικού δεσμου.
Μελετώντας αρχικά τον ομοιπολικό δεσμό στο Η2 ανακαλούμε:
1.Το σχήμα αυτών των τροχιακών 1ης υποστοιβάδας s κάθε στοιβάδας, είναι σφαιρικό και η συνολική ενέργεια αυτού, που οφείλεται στην περιστροφική κίνηση (κινητική) και ηλεκτρική έλξη από πυρήνα (δυναμική) και δίνεται στο προηγούμενο σχήμα καθώς και ηνενέργειά του.
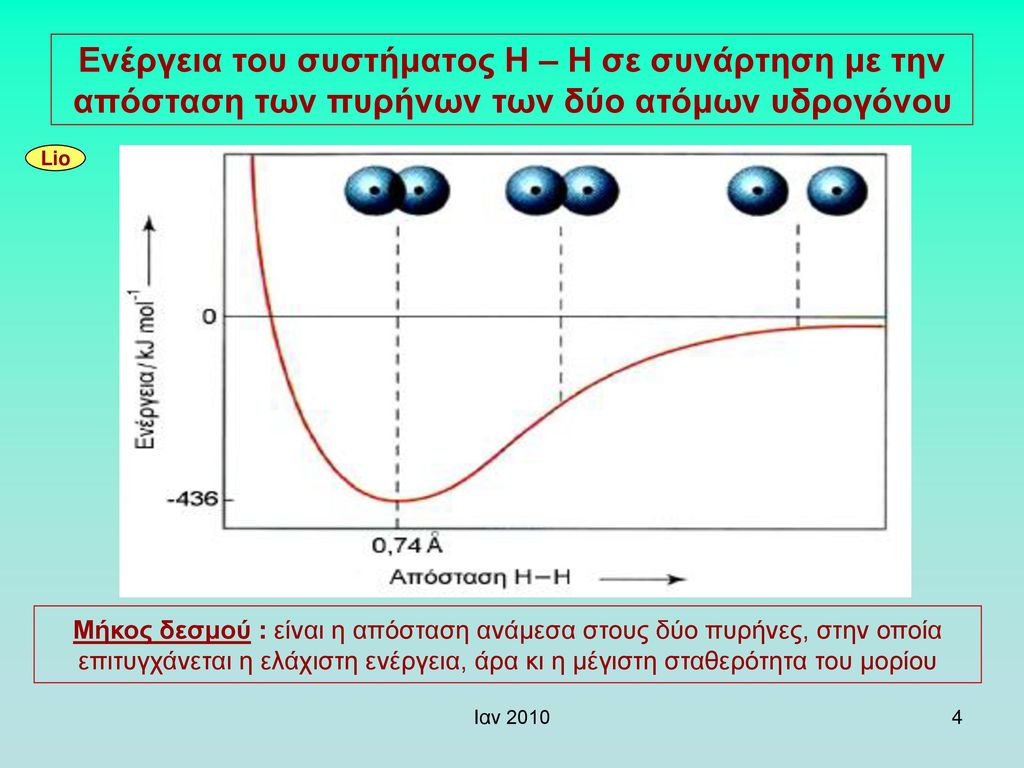
2. Αν υπάρχει στην περιοχή δεύτερο άτομο υδρογόνου, το κάθε ένα από τα μονήρη ηλεκτρόνια με το τροχιακό του έλκεται από τον πυρήνα του άλλου, ώστε η συνολική ενέργεια μειώνεται ώς ένα σημείο. Εάν όμως η προσέγγιση υπερβεί κάποια τιμή τότε αρχίζει να γίνεται αισθητή η άπωση των πυρήνων των δύο ατόμων και η συνολική ενέργεια αυξάνει εκ νέου. Υπάρχει δηλαδή μια απόσταση όπου η συνολική ενέργεια του συστήματος των δύο ατόμων, παίρνει την ελάχιστη τιμή της. Η ελάχιστη αυτή τιμή του συστήματος των δύο ατόμων είναι μικρότρη από το άθροισμα των μεμομωνένων ατόμων κατά 436kj/mol και αυτή είναι η ενέργεια που ελευθερώνεται κατά την δημιουργία ομοιοπολικού
δεσμού.
H απόσταση των δύο πυρήνων είναι τότε 0,74Αο. Αυτή ονομάζεται μήκος δεσμού.
2. Αν θεωρήσουμε ένα άτομο υδρογόνου με το τροχιακό του μοναδικού ηλεκτρονίου και ένα δεύτερο άτομο υδρογόνου σε σχετικά κοντινή απόσταση και το μονήρες ηλεκτρόνιο στην περιοχή από με αντιπαράλληλο spin που δημιουργεί ένα άλλο σύνθετο τροχιακό, δημιουργείται επικάλυψη των δύο απλών ατομικών τροχιακών.
Μοριακά τροχιακά
Αυτό σημαίνει την δημιουργία ενός τροχιακού κοινού και για τα δύο τροχιακού, με διαφορετικό σχήμα (κυλινδρικό περίπου και κατά μήκος του άξονα που συνδέει τους δυο πυρήνες). Είναι τροχιακό μορίου και προσδιορίζει την περιοχή του χώρου όπου τα ηλεκτρόνια των πυρήνων έχουν την μεγαλύτερη πιθανότητα να βρίσκονται
('η αν το πούμε διαφορετικά, η μαθηματική της έκφραση είναι το γινόμενο των συναρτήσεων Schrodinger , Ψ =Ψ(1)·Ψ(2) εκτός)
με την δημιουργία ενός κοινού ζεύγους ηλεκτρονίων όπου η έλξη του κοινού ζεύγους και από τους δύο πυρήνες υδρογόνου οδηγεί στην ανάπτυξη του ομοιοπολικού δεσμού
Επικάλυψη τύπου σ και επικάλυψη τύπου π
Όπως αναφέρεται στο κεφ. 6 ο κύριος κβαντικός αριθμός n που παίρνει τιμές 1, 2, 3, 4, ).. καθορίζει τις στοιβάδες Κ, L, M, N, ..
O δευτερεύων l, ( 0, 1, 2, 3, . καθορίζει το σχήμα του ηλεκτρονιακού νέφους ) s, p, d... Για l=0 έχουμε thn s υποστοιβάδα με σχήμα σφαιρικό, ενώ για l=1 έχουμε την p με διπλό λοβό κ.λ.π.

Ο μαγνητικός αριθμός ml που παίρνει τιμές ανάλογα με το l, δίνει τον προσανατολισμό του τροχιακού. Για l=1 παίρνει 3 τιμές, -1, 0, 1 που δίνουν προσανατολισμό κατα χχ΄, ψψ΄, και ζζ΄. (d τροχιακά. Για l=0 έχουμε μόνο προσανατολισμό κατά χχ΄. (s τροχιακό).
Η επικάλυψη των δυο τροχιακών μπορεί να γίνει κατά δύο τρόπους.
α. Μετωπικά κατά μήκος του άξονα των δύο πυρήνων ο ομοιοπολικός δεσμός είναι ο δεσμός σ.
Εκτός από τα s τροχιακά (n=1,2,3.. και l=0) έχουμε τα d τροχιακά (από n=2, 3,... και l=1)
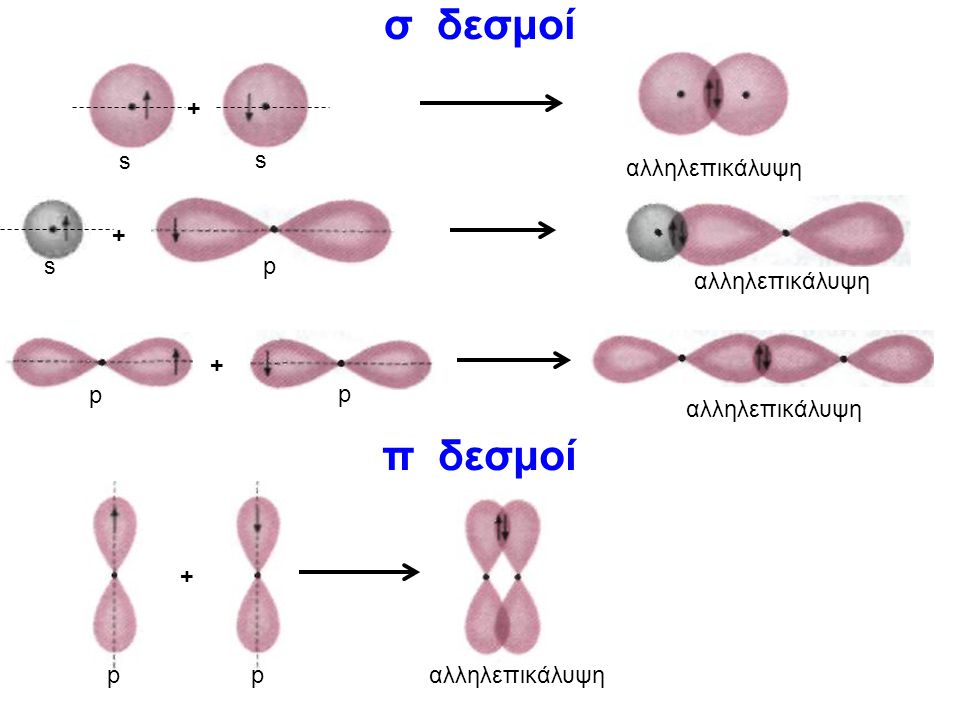
α σ δεσμός Για s-s τροχιακό (σφαιρικό-σφαιρικό = λοβός συμμετρικός) ή s-d (σφαιρικό -λοβός = λοβός με ενισχυμένο το ένα μέρος ή d-d (λοβός- λοβός = δυο λοβοί με επικάλυψη στο ένα άκρο τους κατα μήκος του άξονα χ΄χ) είτε από την Κ -Κ στοιβάδα είτε από την Κ-L ή L-L μπορεί να γίνει με
Απλή επικάλυψη s-s με δεσμό τύπου σ, s-p με δεσμό τύπου και p-p τύπου σ ,
Επικάλυψη p-p με δεσμό τύπου π

Πλευρικές επικαλύψεις δύο τροχιακών στους άξονες ψψ΄και ζζ΄
Ο δεσμός σ είναι ισχυρότερος του π λόγω μεγαλύτερης επικάλυψης
Παρατηρώντας την εξωτερική στοιβάδα δυο ατόμων μπορούμε συνήθως εύκολα να εξηγήσουμε τους δεσμούς που μπορεί να συμβούν ανάμεσα στα μονήρη ηλεκτρόνιά των δύο ατόμων s, p.
Παράδειγμα 1 Η-F Στο Η υπάρχει το 1s ηλεκτρόνιο ενώ στο F έχουμε ένα μονήρες στην εξωτερική στοιβάδα , ο σ δεσμός δημιουργείται με επικάλυψη s-p
Επίσης η ενέργεια δεσμού είναι η αναμενώνενη βάσει υπολογισμών.
Υβριδισμός
Ερμηνεύει περιπτώσεις δεσμών που δεν είναι δυνατόν να ερμηνευτούν με την θεωρία δεσμών των απλών τροχιακών .
Ορισμενα από τα απλά τροχιακά καταργούνται και στην θέση τους συναντάμε ισάριθμα και όμοια μεταξύ τους νέου τύπου τροχιακά, χαμηλότερης ενέργειας από τα απλά και διαφορετικής μορφής προσανατολισμού με σχήμα ομοαξονικών αλλά άνισου μεγέθους λοβών
Ξεκινάμε από την ηλεκτρονιακή δομή των ατόμων με την συμπλήρωση των στοιβάδων τους
Υβριδοποίηση ενός s και ενός p τροχιακού

Παράδειγμα : Στο BeF2 στο βηρύλλιο παρατηρούμε πως δεν υπάρχουν στην εξωτερική στοιβάδα μονήρη ηλεκτρόνια για να δημιουργηθεί ομοιοπολικό δεσμό.

Αυτό που συμβαίνει είναι πως ένα από τα δύο ηλεκτρόνιο της 2s προωθείται σε τροχιακό 2p. 
Τα τροχιακά που βρίσκονται τώρα στις διαφορετικές υποστοιβάδες s και p, υβριδοποιούνται, δηλαδή, αναμιγνύονται κατά ίσο ποσοστό,και δημιουργούν δύο νέα ισότιμα ατομικά τροχιακά τα sp υβριδικά τροχιακά. με προσανατολισμό ευθείας

Στην συνέχεια τα δύο μονήρη ηλεκτρόνια με τα υβριδοποιημένα τροχιακά επικαλύπτουν τα δύο p τροχιακά από 2 άτόμα φθορίου, ώστε σχηματίζουν δύο σ ομοιπολικούς μοριακούς δεσμούς του BeF2 που όμως δεν είναι διαφορετικοί s-p και p-p,
αλλά όμοιοι sp-p και ισότιμοι.
Το φαινόμενο ερμηνεύτικε με τον υβριδισμό των ατομικών τροχιακών (Pauling)
Τα υβριδικά τροχιακά, διαφέρουν ως προς την ενεργεια και τον προσανατολισμό
Υβριδισμός μπορεί να γίνει και μεταξύ τριών ή τεσσάρων τροχιακών s ή p ανάλογα
Υβριδισμός μεταξύ τριών ατομικών τροχιακών, ενός s και δύο p
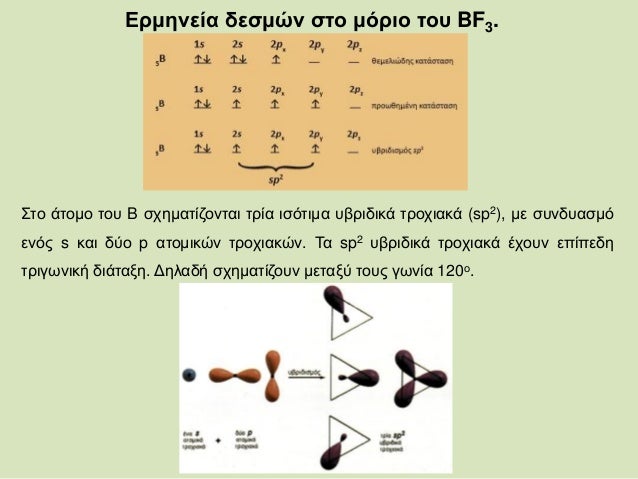
στο βόριο μπορούμε να το μελετήσουμε στην ένωση BF3 την υβριδοποίηση ενό s και δύο p τροχιακών. Στο Βόριο ένα από τα δύο s ηλεκτρόνια προωθείται σε p θέση και τα τρία τροχιακά υβριδοποιούνται sp2 υβριδοποίηση με επίπεδη τριγωνική διάταξη

Ta τρία υβριδοποιημένα τροχιακά sp2 του βορίου επικαλύπτονται από τα p τροχιακά τριών ατόμων
Φθορίου με 3 σ ομοιοπολικούς δεσμούς s-sp2
Υβριδισμός μεταξύ τεσσάρων ατομικών τροχιακών ενός s και τριών p
 Στον άνθρακα μπορούμε να μελετήσουμε την υβριδοποίηση τεσσάρων ατομικών τροχιακών στην ένωση CH4. Eνα ηλεκτρόνιο μεταπίπτει από την s στην p υποστοιβάδα και στην συνέχεια τα τέσσερα ατομικά τροχιακά τροχιακά υβριδοποιούνται με sp3 υβρυδοποίηση.
Στον άνθρακα μπορούμε να μελετήσουμε την υβριδοποίηση τεσσάρων ατομικών τροχιακών στην ένωση CH4. Eνα ηλεκτρόνιο μεταπίπτει από την s στην p υποστοιβάδα και στην συνέχεια τα τέσσερα ατομικά τροχιακά τροχιακά υβριδοποιούνται με sp3 υβρυδοποίηση.
Μοριακά τροχιακά από υβριδοποημένα ατομικά τροχιακά
Αυτό σημαίνει την δημιουργία ενός τροχιακού κοινού και για τα δύο τροχιακού, από τα οποία το ένα τουλάχιστος προέρχεται από υβριδοποίησηα
Στο μεθάνιο CH4 έχουμε την επικάλυψη των τεσσάρων υβριδοποιημένων τροχιακών του άνθρακα με τα s τροχιακά τεσσάρων ατόμων υδρογόνου που έχουν τετραεδρική διάταξη με επικαλύψεις 4 σ , δηλαδή ομοιοπολικούςδεσμούς s-sp3
 Στό αιθάνιο C2H6
Στό αιθάνιο C2H6
ίγο διαφορετική είναι η διάταξη των δεσμών στο αιθάνιο
Η υβριδοποίηση των τεσσάρων τροχιακών του άνθρακα είναι ίδια. Στην συνέχεια δημιουργούνται σε κάθε έναν από τους δύο άνθρακες 3 σ δεσμοί s-sp3 με τρία άτομα υδρογόνου ,και
μια σ sp3-sp3 σ ομοιοπολικός δεσμός με τον δεύτερο άνθρακα κατά μήκος του άξονα σύνδεσης
Γενικά μπορούμε να δούμε σχηματικά τους υβριδοποιημένα ατομικά τροχιακά sp, sp2 , sp3 στο σχήμα που ακολουθεί
Για το διπλό και τριπλό δεσμό μεταξύ των ατόμων του άνθρακα δημιουργούνται επίσης και
ΑΣΚΗΣΕΙΣ ΚΑΤΑΝΟΗΣΗΣ
Μη υβριδοποιημένα τροχιακά
Πως σχηματίζονται τα μόρια της αρσίνης ( AsH3) του φθορίου και του αζώτου
 ΑΡσίνη: AsH3
ΑΡσίνη: AsH3
Τροχιακά του αρσενικου : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
Έτσι η εξωτερική στοιβάβα περιέχει 5 ηλεκτρόνια . Τα δύο είναι στην 4s (συμληρωμένη ) και τα τρία μονήρη ηλεκτρόνια σε p τροχιακα της 4 στοιβάδας.
Τροχιακά του υδρογόνου 1s1
Στην αρσίνη σχηματίζονται 3 sp μοριακά τροχιακά με σ ομοιοπολικόύς δεσμούς
Μόριο Οξυγόνου Ο2
Το μόριο του οξυγόνο στην εξωτερική του στοιβάδα έχει 6 ηλεκτρόνια. Τα 2 ηλεκτρόνια στην υποστοιβάδα 2s (συμπληρωμένη) και 4 στην 2p (τα 2 σχηματίζουν ζευγάρι και τα 2 είναι μονήρη.
Στο μόριο του οξυγόνου, τα δύο άτομα οξυγόνου συνδέονται με επικάλυψη των τροχιακών των δύο μονήρων ηλεκτρονίων του κάθε ενός ατόμου ώστε σχηματίζονται δύο p-p μοριακάτροχιακά . Τό πρώτο με μετωπική σύνδεση σ κατά μήκος του χχ΄ και το δεύτερο με παράλληλη σύνδεση π
Μόριο Αζώτου Ν2
Το μόριο του αζώτου στην εξωτερική του στοιβάδα έχει 5 ηλεκτρόνια. Τα 2 ηλεκτρόνια βρίσκονται στην 2s (συμπληρωμένη) και 3 στην 2p ρι που είναι  μονήρη.
μονήρη.
Στο μόριο του αζώτου, τα δύο άτομα αζ'ωτου, συνδέονται με επικάλυψη των τροχιακών των τριών μονήρων ηλεκτρονίων της 2p υποστοιβάδας του κάθε ενός ατόμου ώστε σχηματίζονται τρία p-p μοριακάτροχιακά . Τό πρώτο με μετωπική σύνδεση σ κατά μήκος του χχ΄ και άλλα δύο με παράλληλη σύνδεση π κατά μήκος του ψψ΄και ζζ΄
Υβριδοποιημένα τροχιακά
Πως σχηματίζονται τα μόρια
Δήμητρα Σπανού
ΠΗΓΕΣ
https://ebooks.edu.gr/new/books-pdf.php?course=DSGL-C135
[PDF]


 )
)