Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
Πως σχηματίζονται τα μακρομόρια στον οργανισμό
Τα μακρομόρια αποτελούνται από μονομερή που έχουν γενικό χαρακτηριστικό Η...ΟΗ
Σε γενικές γραμμές ο αριθμός των μονομερών που συνθέτουν τα πολυμερή είναι περίπου 50. Όμως, οι διαφορετικές διατάξεις στην αλληλουχία τους δίνει μια τεράστια ποικιλία μακρομορίων. Στα βιοπολυμερή, στην ποικιλία αυτή οφείλεται η μονοδικότητα των οργανισμών.
Τα μονομερή αυτά, σχηματίζουν μακρομόρια με βιοσύνθεση μέσω χημικών μηχανισμών συμπύκνωσης κατά την οποία ενώνεται το Η του ενός μονομερούς με το ΟΗ του επόμενου
ΕΠΙΠΕΔΑ ΟΡΓΑΝΩΣΗΣ ΤΩΝ ΒΙΟΠΟΛΥΜΕΡΩΝ ΕΙΝΑΙ:
Η ΠΡΩΤΟΤΑΓΗΣ, ΔΕΥΤΕΡΟΤΑΓΗΣ, ΤΡΙΤΟΤΑΓΗΣ ΚΑΙ ΕΝΙΟΤΕ ΤΕΤΑΡΤΟΤΑΓΗΣ ΔΟΜΗ
ΔΕΥΤΕΡΟΤΑΓΗΣ ΚΑΙ ΤΡΙΤΟΤΑΓΗΣ ΔΟΜΗ ΤΩΝ ΒΙΟΠΟΛΥΜΕΡΩΝ
Η ΔΕΥΤΕΡΟΤΑΓΗΣ KAI ΤΡΙΤΟΤΑΓΗΣ ΔΟΜΗ ΒΙΟΛΟΓΙΚΩΝ ΜΑΚΡΟΜΟΡΙΩΝ
Η δευτεροταγής δομή μακρομορίων (πρωτεϊνών, νουκλεϊκών οξέων κ.α.) είναι η διαμόρφωση της ραχοκκοκαλιάς του μακρομορίου, ανεξάρτητα με τις πλευρικες αλυσίδες
Η τριτοταγής δομή ενός βιολογικού μακρομορίου είναι η χωρική δομή ολοκλήρου του μορίου που αποτελείται από μια ενιαία αλυσίδα
Α. ΟΙ ΠΡΩΤΕΊΝΕΣ
Η ΔΕΥΤΕΡΟΤΑΓΗΣ ΔΟΜΗ ΣΤΙΣ ΠΡΩΤΕΪΝΕΣ
Η δευτεροταγής δομή των πρωτεϊνών είναι αποτέλεσμα της τοποθέτησης των αμινοξέων στον χώρο .
Η δευτεροταγής δομή δημιουργείται βάσει της σειράς των αμινοξέων της πρωτοταγούς δομής
Τα αμινοξέα που συνδέονται με τους πεπτιδικούς δεσμούς ανάλογα με την συγκεκριμένη δομή τους αποκτούν μια γεωμετρία μέσα στον χώρο.
Οι δεσμοί που επικρατούν στην δευτεροταγή δομή είναι οι δεσμοί υδρογόνου. Όμως σε ορισμένες περιπτώσεις συναντάμε και άλλες αλληλεπιδράσεις όπως δεσμούς Van der waals (κολλαγόνο, έλικες πολυπρολίνης)
Κατα την διαμόρφωση της δευτερεύουσας δομής, διακρίνουμε τις τακτικές δευτερεύουσες δομές οι οποίες σχηματίζονται από υπολειμματα αμινοξέων με την ίδια διαμόρφωση της κύριας αλυσίδας, (έλικοειδείς και φύλλα) και τις ακανόνιστες δευτερεύουσες δομές
Τακτικές δευτερεύουσες δομές (ελικοειδείς και φύλλα)
Η δομή αυτή (δευτερεύουσα) δίνει αρκετή ανθεκτικότητα στην πρωτεϊνη, ώστε δεν καταστρέφεται ούτε μετουσιώνεται εύκολα με τις επιδράσεις εξωτερικών συνθηκών όπως το Ph και η θερμοκρασία. Επιρρεάζει επίσης σημαντικές ιδιότητες της πρωτεϊνης, όπως η διαλυτότητα, η σταθερότητα και η δραστηριότητα, όπως η δέσμευση υποστρωμάτων και η κατάλυση.
Το αποτέλεσμα της δευτεροταγούς διαμορφωσης μπορεί να είναι μία έλικα (α έλικα, π έλικα,έλικα πολυπρολίνης) και η β φύλλα.

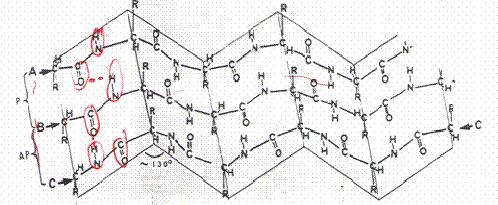
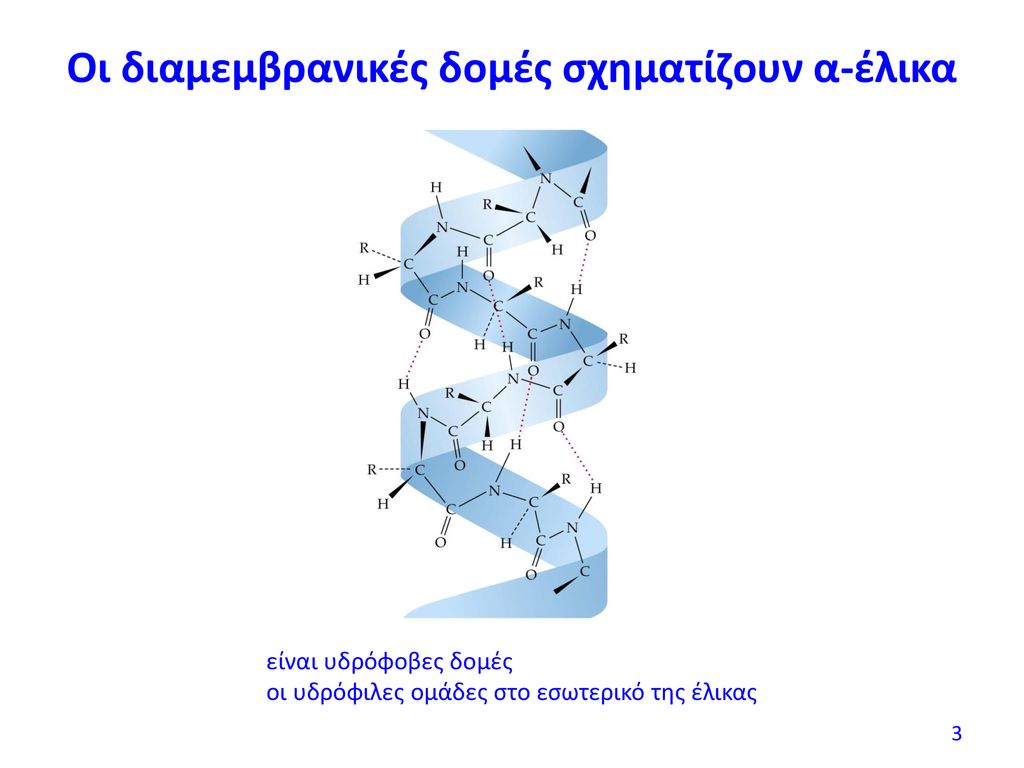 Η ελικοειδής δομή διατηρείται κυρίως με δεσμούς υδρογόνου ανάμεσα στην καρβονυλική ομάδα του υπολείμματος του ενός αμινοξέως και την αμινομάδα του άλλου
Η ελικοειδής δομή διατηρείται κυρίως με δεσμούς υδρογόνου ανάμεσα στην καρβονυλική ομάδα του υπολείμματος του ενός αμινοξέως και την αμινομάδα του άλλου
Στην α έλικα, που είναι η πιο κοινή δευτεροταγής δομή, τα L αμινοξέα από τα οποία αποτελείται και που συνδέθηκαν για να σχηματίσουν πρωτεϊνη, περιτυλίγονται σφικτά γύρω από έναν νοητό άξονα με βήμα 0,54nm.
Είναι δεξιόστροφη ή αριστερόστροφη, (περισσότερο δεξιόστροφη)
Ακόμα υπάρχει η έλικα πολυπρολίνης που σταθεροποιείται κυρίως με δεσμούς van der waals
στην β πτυχή, υπολείμματα αμινοξέων πολυπεπτιδικών αλυσίδων ζικ-ζακ παράλληλων ή αντιπαράλληλων ή διαφορετικών πρωτεϊνικών αλυσίδων περισσότερο απομαρυσμένων που συνδέονται με δεσμούς υδρογόνου.
Ακανόνιστες δευτερεύουσες δομές
Τα υπολείμματα αμινοξέων άχουν διαφορετικές διαμορφώσεις την αλυσίδα όπως στροφές με ακανόνιστα τμήματα, δημιουργία βρόγχων, μισές στροφές ή μεταβάσεις κ.λ.π.
ΑΠΛΕΣ ΠΡΩΤΕΪΝΕΣ ΜΕ ΑΝΩΤΕΡΕΣ ΔΟΜΕΣ
Η ΤΡΙΤΟΤΑΓΗΣ ΔΟΜΗ ΠΡΩΤΕΪΝΩΝ
Βάσει της δευτεροταγούς δομής, διαμορφώνεται στην συνέχεια και η τριτοταγής δομή
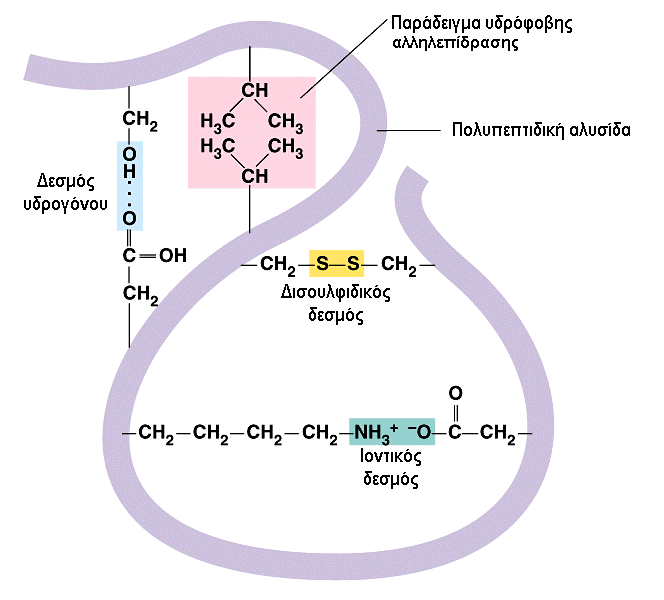
Η τριτοταγής δομή των πρωτεϊνών δημιουργείται λόγω πολυπλόκων αλληλεπιδράσεων μεταξύ διαφορετικών τμημάτων της δευτερεύουσας δομής.
Οι αλληλεπιδράσεις αυτές σε ένα υδατικό περιβάλλον, μπορεί να είναι υδρόφοβες και υδρόφιλες, όπου οι υδρόφοβες ρίζες των αμινοξέων βυθίζονται μέσα στο μόριο της πρωτεϊνης και έλκονται μεταξύ τους ενώ οι υδρόφιλες βρίσκονται στην επιφάνεια και αλληλεπιδρούν με τα μόρια του νερού.
Η τριτοταγής δομή είναι χωρική δομή και περιλαμβάνει τον τρόπο που το πολυμερές είναι διατεταγμένο στο διάστημα.
Δίνει την τελική τοποθέτηση των ατόμων του μορίου μέσα στον χώρο και συνδέεται με την γενικότερη λειτουργία των πρωτεϊνών και την αλληλεπίδρασή τους με άλλα μόρια όπως ένζυμα, ορμόνες και DNA.
Μπορεί να πάρει πολλές μορφές όπως η ελικοειδής α έλικα, η β πτυχή ή σύνθετους συνδυασμούς αυτών, βρόγχους και άλλες περίλοκες δομές.
Σχετίζεται με την ικανότητά της πρωτεϊνης να δεσμεύεται από άλλα μόρια (τεταρτοταγής διαμόρφωση) και να συμμετέχει σε βιολογικές διαδικασίες. Ένζυμα, αντισώματα και υποδοχείς, έχουν μια περίπλοκη τριτοταγή δομή.
Η τριτοταγής δομή είναι ευπαθής σε υψηλές θερμοκρασίες
Λαμβάνουμε υπ όψην ότι η τριτοταγής δομή πρωτεϊνών δεν δημιοργείται μόνο από α έλικες και β δομή αλλά ταυτόχρονα μπορεί να περικλείει δομές σύνθετες. Η τριτοταγής διαμόρφωση μιας πρωτεϊνης μειώνει κατά πολύ το μέγεθός της και το κάνει δεκάδες φορές πιο συμπαγές από την αρχική αλυσίδα.
Σε σχέση με τις πρωτεϊνες, η τριτοταγής δομή περιλαμβάνει τα ινώδη πρωτεϊνοειδή και τα σφαιρικά.
Τα ινώδη πρωτεϊνοειδή
Είναι πρωτεϊνες που περιέχουν αμινοξέα γλυκίνη, προλίνη, κυστίνη συναντώνται σε υποστηρικτικούς ιστούς όπως χόνδρους, οστά, τένοντες, σύνδεσμοι.
Σχηματίζουν ινώδεις δομές λόγω της ικανότητάς τους να βρίσκονται σε τριτοταγείς και τεταρτοταγείς δομές. Είναι αδιάλυτα σε νερό, αλατούχα διαλύματα, αραιά διαλύματα οξέων και βάσεων και ανθεκτικά σε πρωτεολυτικά ένζυμα.
Αποτελούνται από μακρυές αλυσίδες που συνδέονται μεταξύ τους με σταυροσυνδέσμους.
Περιλαμβάνουν το κολλαγόνο, ελαστίνη, κερατίνη, ινώδες μεταξιού.
Το κολλαγόνο: Αποτελείται από τρεις πρωτεϊνικούς κλάδους από 1000 περίπου αμινοξέα στριμένους σε μια έλικα με γλυκίνη , προλίνη και κυρίως υδροξυπρολίνη που όπως φαίνεται παίζει καθοριστικό ρόλο στην σύνδεση των αλυσίδων, καθώς μειώνεται στους ιστούς με την ηλικία ώστε εμφανίζονται δερματικές βλάβες
 Η ελαστίνη: Σχηματίζει πολυπεπτιδική αλυσίδα με διασταυρούμενες συνδέσεις. Μπορεί να τεντώσει αρκετές φορές το αρχικό της μήκος. πάρχει ομως και το αμινοξύ λυσίνη συμπεριλαμβάνεται στις πλευρικές αλυσίδες και προστατεύει την πρωτεϊνη από υπερβολική έκταση και την επεναφέρει στο αρχικό της μήκος
Η ελαστίνη: Σχηματίζει πολυπεπτιδική αλυσίδα με διασταυρούμενες συνδέσεις. Μπορεί να τεντώσει αρκετές φορές το αρχικό της μήκος. πάρχει ομως και το αμινοξύ λυσίνη συμπεριλαμβάνεται στις πλευρικές αλυσίδες και προστατεύει την πρωτεϊνη από υπερβολική έκταση και την επεναφέρει στο αρχικό της μήκος
Οι α κερατίνες
Είναι τρεις α έλικες δύο δεξιόστροφες και μία αριστερόστροφη, μήκους περίπου 0,5nm, που συνδυάζονται για να σχηματίσουν μια υπερέλικα.
 Πρωτεϊνες υψηλού μοριακού βάρους, είναι αδιάλυτες σε διαλύματα οξέων, βάσεων αλάτων πράγμα που οφείλεται στην μεγάλη περιεκτικότητά τους σε υδρόφοβα υπολείμματα αμινοξέων όπως φαινυλαλανίνη, ισολευκίνη, βαλίνη, μεθειονίνη, αλανίνη. Δεν υπάρχει περιοδικότητα την εναλλαγή των αμινοξέων και αυτή είναι που επιρρεάζει τις ιδιότητες κάθε πολυπεπτιδίου καθώς και την υπερμοριακή του δομή και εν τέλει την χρήση τους στον οργανισμό.
Πρωτεϊνες υψηλού μοριακού βάρους, είναι αδιάλυτες σε διαλύματα οξέων, βάσεων αλάτων πράγμα που οφείλεται στην μεγάλη περιεκτικότητά τους σε υδρόφοβα υπολείμματα αμινοξέων όπως φαινυλαλανίνη, ισολευκίνη, βαλίνη, μεθειονίνη, αλανίνη. Δεν υπάρχει περιοδικότητα την εναλλαγή των αμινοξέων και αυτή είναι που επιρρεάζει τις ιδιότητες κάθε πολυπεπτιδίου καθώς και την υπερμοριακή του δομή και εν τέλει την χρήση τους στον οργανισμό.
Χαρακτηρίζονται από μεγάλη περιεκτικότητα στο αμινοξύ κυστεϊνη που περιέχει θείο, ώστε, τα μόρια των α κερατινών προσανατολίζονται παράλληλα και συνδέονται με διασταυρούμενους διασουλφουρικούς δεσμούς
Οι β κερατίνες
Οι γειτονικές αλυσίδες δεν συνδέονται με διασταυρούμενους διασουλφουρικούς δεσμούς αλλά έχουμε αντιπαράλληλες πολυπεπτιδικές αλυσίδες που συνδέονται μεταξύ τους με δεσμούς υδρογόνου. Πρόκειται για δευτεροταγείς δομές που
είναι πιο σκληρές κι έχουν την μορφή αρκετών ζικ-ζακ πολυπεπτιδικών αλυσίδων (β φύλλα). Οι β κερατίνες δεν έχουν διασταυρούμενους δεσμούς μεταξύ γειτονικών πολυπεπτιδικών αλυσίδων. Η γλυκινη που είναι το μικρότερο αμινοξύ και μη ηλεκτρολύτης, βρίσκεται κάθε δύο θέσεις στην πολυπεπτιδική αλυσίδα. Ένα άλλο πολύ μικρό αμινιξύ των β κερατινών είναι η αλανίνη. Η ύπαρξη αυτών των μικρών αμινοξέων οδηγεί στον σχηματισμό πτυχώσεων (φύλλα β) εφόσον το μέγεθος των αμινοξέων αυτών επιτρέπει τον σχηματισμό χωρικά διαταγμένων δεμών υδρογόνου μεταξύ αμίνο και καρβοξυλομάδων.
Η ινοϊνη που είναι μια εκκριτική β κερατίνη σε ορισμένα έντομα, αποτελείται κυρίως από γλυκίνη, αλανίνη, σερίνη, τυροσίνη
Οι σφαιρικές πρωτεϊνες
Αποτελούν πρωτεϊνικούς σχηματισμούς οι οποίοι σχηματίζονται, όταν οι πολυπεπτιδικές αλυσίδες που συμμετέχουν, διπλώνονται σε συμπαγείς μορφές και δημιουργούν σφαιρίδια.
Καθορίζονται από υδρόφιλες και υδρόφοβες αλληλεπιδράσεις : υδρόφιλες στο εξωτερικό όπως δεσμοί υδρογόνου και υδρόφοβες στο εσωτερικό
Στην ομάδα των σφαιρικών πρωτεϊνών κατατάσσονται όλα τα ένζυμα, τα αντισώματα και οι ορμόνες που είναι πρωτεϊνες
Μια τέτοια ομάδα σφαιρικών σχηματίζεται από τις ανωτέρω κερατίνες. Λόγω της δράσης των διασουλφιρικών δεσμών , των α ελίκων και των β πτυχώσεων δημιουργούνται ενεργές σφαιρικές πρωτεϊνες όπως τα ένζυμα.
Άλλες σφαιρικές πρωτεϊνες είναι οι λευκωματίνες
Β. ΤΑ ΝΟΥΚΛΕΊΝΙΚΑ ΟΞΕΑ DNA, RNA
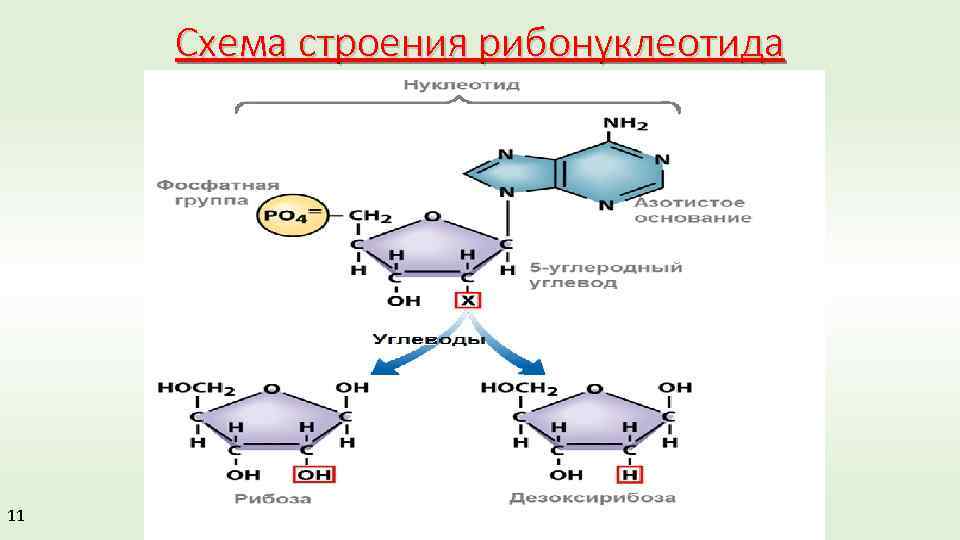
Η ΔΕΥΤΕΡΟΤΑΓΗΣ KAI ΤΡΙΤΟΤΑΓΗΣ ΔΟΜΗ ΤΟΥ DNA. H ΔΙΠΛΗ ΕΛΙΚΑ ΤΟΥ DNA
H δευτεροταγής δομή των δεοξυριβοζονουκλεϊκών οξέων έχουν την αιτία της στην πεντόζη δεοξυριβόζη. Σε αυτήν οφείλεται η δημιουργία της διπλής έλικας. Επιπλέον, με την έλικα αυτή και με τον τρόπο που είναι κατασκευασμένη προστατεύεται ο γενετικός κώδικας μέσα στην έλικα αυτην.
 Την δευτεροταγή δομή σταθεροποιούν οι δεσμοί υδρογόνου μεταξύ των αζωτούχων βάσεων των δεοξυριβοζονουκλεοτιδίων δύο δεσοξυριβοζονουκλεϊδικών αλυσίδων που είναι μία πουρίνη και μια πυριμιδίνη.
Την δευτεροταγή δομή σταθεροποιούν οι δεσμοί υδρογόνου μεταξύ των αζωτούχων βάσεων των δεοξυριβοζονουκλεοτιδίων δύο δεσοξυριβοζονουκλεϊδικών αλυσίδων που είναι μία πουρίνη και μια πυριμιδίνη.
Όμως στην δευτεροταγή δομή του DNA συναντάμε κι άλλους τύπους αλληλεπιδράσεων όπως το στοίβαγμα, τις ηλεκτροστατικές αλληλεπιδράσεις και τις αλληλεπιδράσεις van der waals.
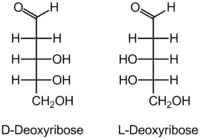
Ανάλογα με τις εξωτερικές συνθήκες και λόγω της διαφοράς στην διαμόρφωση της δεοξυριβόλης το DNA μπορεί να πάρει διαφορετικές μορφές που σχετίζονται με την διαμόρφωση της δευτερεύουσας δομής. Στην φυσική διαμόρφωση έχουμε δύο αλυσίδες,
η μια είναι δεξιόστροφη που περιλαμβάνει την D δεοξυριβόζη και η άλλη, η συμπληρωματική της αριστερόστροφη που περιλαμβάνει την L δεσοξυριβόζη, , που είναι αντιπαράλληλη και τα δύο είναι φυσικά ισομερή
Συνδέονται μέσω των συμπληρωματικών αζωτούχων βάσεων (μιας πυρίνης και μιας πυριμιδίνης) με δεσμούς υδρογόνου
και συγκεκριμένα με τρεις δεσμούς υδρογόνου που αναπτύσονται μεταξύ των συμπληρωματικών αζωτούχων βάσεων κυτοσίνης και γουανίνης που είναι τμήματα των δεοξυριβοζονουκλεοτιδίων των δύο απέναντι αλυσίδων και παρόμοια με δύο δεσμούς υδρογόνου που αναπτύσσονται μεταξύ των αζωτούχων βάσεων αδενίνης και θυμίνης των συμπληρωματικών δεοξυριβοζο νουκλεοτιδίων.
Εδώ να σημειώσουμε ότι στους δεσμούς υδρογόνου μεταξύ των συμπληρωματικών αλυσίδων συμμετέχει το οξυγόνο της κετομάδας της αδενίνης, θυμινης γουανίνης και κυτοσίνης και τα υδρογόνα των αμινομάδων της αδενίνης και κυτοσίνης των δεσοξυριβοζονουκλεοτιδίων και το υδρογόνο του αζώτου της ετεροκυκλικής θυμίνης και γουανίνης
Γενικότερα την δευτεροταγή δομή του DNA
Η ΔΕΥΤΕΡΟΤΑΓΗΣ ΔΟΜΗ ΤΟΥ RNA ΑΝΑΔΙΠΛΩΣΕΙΣ ΚΑΙ ΠΕΡΙΕΡΓΕΣ ΤΡΙΣΔΙΑΣΤΑΤΕΣ ΔΟΜΕΣ TOY RNA
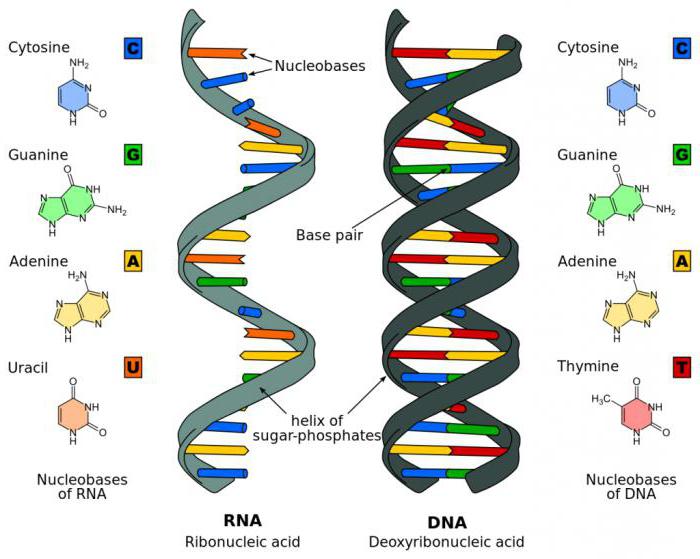
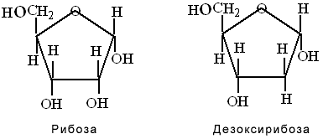
΄Ενα σημαντικό χαρακτηριστίκο του RNA είναι η παρουσία της ριβόζης αντί της δεοξυριβόζης είναι η παρουσία υδροξυλίου στην θέση 2
Μετά την μεταγραφή του σαν mΡΝΑ υφίσταται τροποποιήσης για τον σχηματισμό δευτερογενών και τριτογενών δομών που εκτελούν λειτουργίες ανάλογα με τον τύπο του RNA, όπως το μεταφορικό tRNA και το ριβοσωματιακό rRNA που και τα τρία αυτά συμμετέχουν στην σύνθεση πρωτεϊνών. Κάποιοι τύποι του RNA όπως τα ριβοένζυμα, αποτελούς μέρος κάποιων ενζύμων (τεταρτοταγής δομή)
¨οπως αναφέρθηκε, συμβαίνουν κι εδώ συνδέσεις με δεσμούς υδρογόνου αλλά σε ορισμένες περιπτώσεις και μεταξύ περιοχών της ίδιας αλυσίδας.
Επίσης, είναι δυνατές κι άλλες επιδράσεις, όπως για παράδειγμα, πολλές αδενίνες μπορεί να σχηματίσουν έναν βρόγχο ή κάποιος βρόγχος να αποτελείται από τέσσερα νουκλεοτίδια.
ΔΙΑΜΟΡΦΩΣΕΙΣ ΤΩΝ ΠΟΛΥΣΑΚΧΑΡΙΤΩΝ
ΟΙ ΠΟΛΥΣΑΚΧΑΡΙΤΕΣ (ΥΔΑΤΑΝΘΡΑΚΕΣ)
Οι πολυσακχαρίτες είναι πολυμερείς ουσίες που έχουν γενικό τύπο Cn(H2O)m. Σχηματίζουν καρβονυλομάδες και ομάδες υδροξυλίου, Περιλαμβάνουν εκατοντάδες ή και χιλιάδες μονάδες, ομογενείς (ομοπολυσακχαρίτες που είναι η κυτταρίνη , το άμυλο, η χιτίνη και το γλυκογόνο) ή ετερογενείς (ετεροπολυσακχαρίτες όπως η ηπατίνη). Σε αντίθεση με τους μονοσακχαρίτες (γλυκόζη, φρουκτόζη, γαλακτόζη, ριβόζη κ.α.) και τους ολιγοσακχαρίτες (από 2-10 μονοσακχαρίτες) που είναι γλυκείς και διαλυτοί στο νερό, οι πολυσακχαρίτες είναι πολύπλοκες πολυδομημένες ουσίες που είναι άγλυκοι. και αδιάλυτοι στο νερό
Σε αντίθεση με τις πρωτεϊνες, οι πολυσακχαρίτες δεν μπορούν να χαρακτηριστούν από αυστηρά καθορισμένο μοριακό βάρος. Υπολείματα μονοσακχαριτών μπορούν να διασπαστούν ενζυματικά από αυτούς, ανάλογα με τις μεταβολικές τάσεις του κυτάρου.

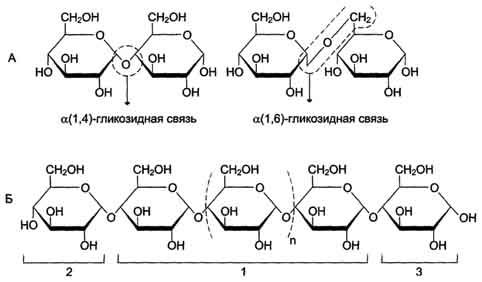
Οι μονοσακχαρίτες των πολυσακχαριτών, ενώνονται σε αλυσίδα, ευθεία ή διακλαδιζόμενη.
Οι υδατάνθρακες διατάσσονται σε γραμμική διάταξη με δεσμούς 1->4 (στην α γλυκάνη αμυλόζη, που περιέχεται στο άμυλο) , σε διακλαδισμένη διάταξη με δεσμούς 1->4 και 1->6 (στην β γλυκάνη αμυλοπηκτίνη περιέχεται στο άμυλο) , β 1->3 γλυκοζιτικούς δεσμούς στην β γλυκάνη ζυμωσάνη,
Με την ένωση ενός μονοσακχαρίτη με έναν γειτονικό του έχουμε ευθεία αλυσίδα, ενώ ένωση με περισσότερους μονοσακχαριτες, (που είναι εφικτό, εφόσον στο μόριό του περιέχονται περισσότερες από μια υδροξυλομάδες) έχουμε:

.jpg)
διακλαδώσεις, διασταυρώσεις πλέγματα, υπερμοριακά συγκροτήματα κ.λ.π.
όπως συμβαίνει
στην κυτταρίνη που το μονομερές είναι β γλυκόζη μετά την πρωτοταγή δομή , οι αλυσίδες διασταυρώνονται σε ισχυρό πλέγμα ή το γλυκογόνο που δημιουργεί πολλές διακλαδώσεις.
.jpg)
Δήμητρα Σπανού
PHGES
https://ru.wikipedia.org/wiki/%D0%93%D0%BB%D0%BE%D0%B1%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5_%D0%B1%D0%B5%D0%BB%D0%BA%D0%B8
Ποια νουκλεοτίδια είναι μονομερή DNA και RNA
Δομή δευτερογενούς και τριτοταγούς πρωτεΐνης - περιγραφή και λειτουργίες
https://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B5%D1%82%D0%B8%D1%87%D0%BD%D0%B0%D1%8F_%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%B0
https://ru.wikipedia.org/wiki/%D0%92%D1%82%D0%BE%D1%80%D0%B8%D1%87%D0%BD%D0%B0%D1%8F_%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%B0
Glycogen structure - Углеводы — Википедия