Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/μιας Εκπ/σης, 1ου Γυμνασίου Δάφνης
ΑΠΛΕΣ ΚΑΙ ΣΥΝΘΕΤΕΣ ΠΡΩΤΕΊΝΕΣ
Διακρίνουμε τις πρωτεϊνες στις απλές όταν αποτελούνται μόνο από μια σειρά αμινοξέων και στις σύνθετες πρωτεϊνες.
Οι απλές πρωτεϊνες διακρίνονται σε αλβουμίνες, σφαιρίνες, πρωταμίνες, ιστόνες, προλαμίνες, γλουτλίνες πρωτεϊνοειδή
Οι σύνθετες πρωτεϊνες είναι σφαιρικές πρωτεϊνες* που έχουν συνδεδεμένο και ένα μη πρωτεϊνικό τμήμα το οποίο αποτελεί την προσθετική τους ομάδα.
Ανάλογα με το μη πρωτεϊνικό μέρος που συνδέεται με την πρωτεϊνη, οι σύνθετες πρωτεϊνες διακρίνονται σε:
Χρωμοπρωτεϊνες , Γλυκοπρωτεϊνες , Νουκλεοπρωτεϊνες , Λιποπρωτεϊνες , Φωσφοπρωτεϊνες, Μεταλλοπρωτεϊνες
ΟΙ ΑΠΛΕΣ ΠΡΩΤΕΪΝΕΣ
Οι απλές πρωτεϊνες αποτελούν την συντριπτική πλειοψηφία των πρωτείνών σε κύτταρα, ιστούς και όργανα οργανισμών, σε ανοσοποιητικά σώματα, πρωτείνες αίματος, ορμόνες και ένζυμα.
Διαφέρουν μεταξύ τους ως προς τον αριθμό και την αλληλουχία υπολειμμάτων αμινοξέων και το μοριακό τους βάρος.
Περιλαμβάνουν τις αλβουμίνες, σφαιρίνες, πρωταμίνες, ιστόνες, προλαμίνες, γλουτίνες πρωτεϊνοειδή
ΕΙΔΗ ΑΠΛΩΝ ΠΡΩΤΕΪΝΩΝ
Αλβουμίνες: Είναι πρωτεϊνες των ιστών όπως και οι σφαιρίνες. Υδατοδιαλυτές και πολύ ενυδατωμένες, με αρκετά όξινο χαρακτήρα. Όταν βράσουν μετουσιώνονται και καθιζάνουν υπό μορφή παχέων νιφάδων ( αφρός στο γάλα, πήξιμο αυγού με το μαγείρεμα, αφρός σε μαγείρεμα φρούτων και λαχανικών)
Λευκωματίνη ορού, γαλακτοαλβουμίνη γάλακτος, ωοαλβουμίνη λευκού του αυγού, μυοαλβουμίνη ζωϊκών μυών, λευκοζίνη σιταριού, σίκαλης και κριθαριού, φαγόπιτο και οσρίνη σόγιας, ρικίνη καστορέλαιου.
Είναι διατροφικές, μεταφορικές (μεταφέρουν ορμόνες, χοληστερόλη, χολερυθρίνη, φάρμακα, ιόντα ασβεστίου) και εξουδετερωτικές πρωτεϊνες (εξουδετερώνουν τοξικές ενώσεις, αλκαλοειδή, βαρέα μέταλλα, χολερυθρίνη) .
Σφαιρίνες: Ομάδα σφαιρικών πρωτεϊνών των ιστών, που συνήθως συνοδεύουν τις αλβουμίνες. Ελαφρώς όξινες ή ουδέτερες, διαλυτές σε αλατούχα διαλύματα, αδιάλυτες σε καθαρό νερό, πήζουν όταν θερμαίνονται. Περιέχονται στον ορό, στο αυγό, στους μυς, στα μπιζέλια (οσπρίνη), σόγια (γλυκιπίνη), σπόροι φασολιών (φασελοίνη), κάνναβη (edestin) .
Στο σώμα εκτελούν λειτουργίες διατροφικές, προστατευτικές, μεταφορικές (χοληστερίνη, φωσφολιπίδια, τριγλυκερίδια, ιόντα σιδήρου, χαλκού, βιταμίνη Β12). Παράγονται από το ήπαρ και το ανοσοποιητικό σύστημα.
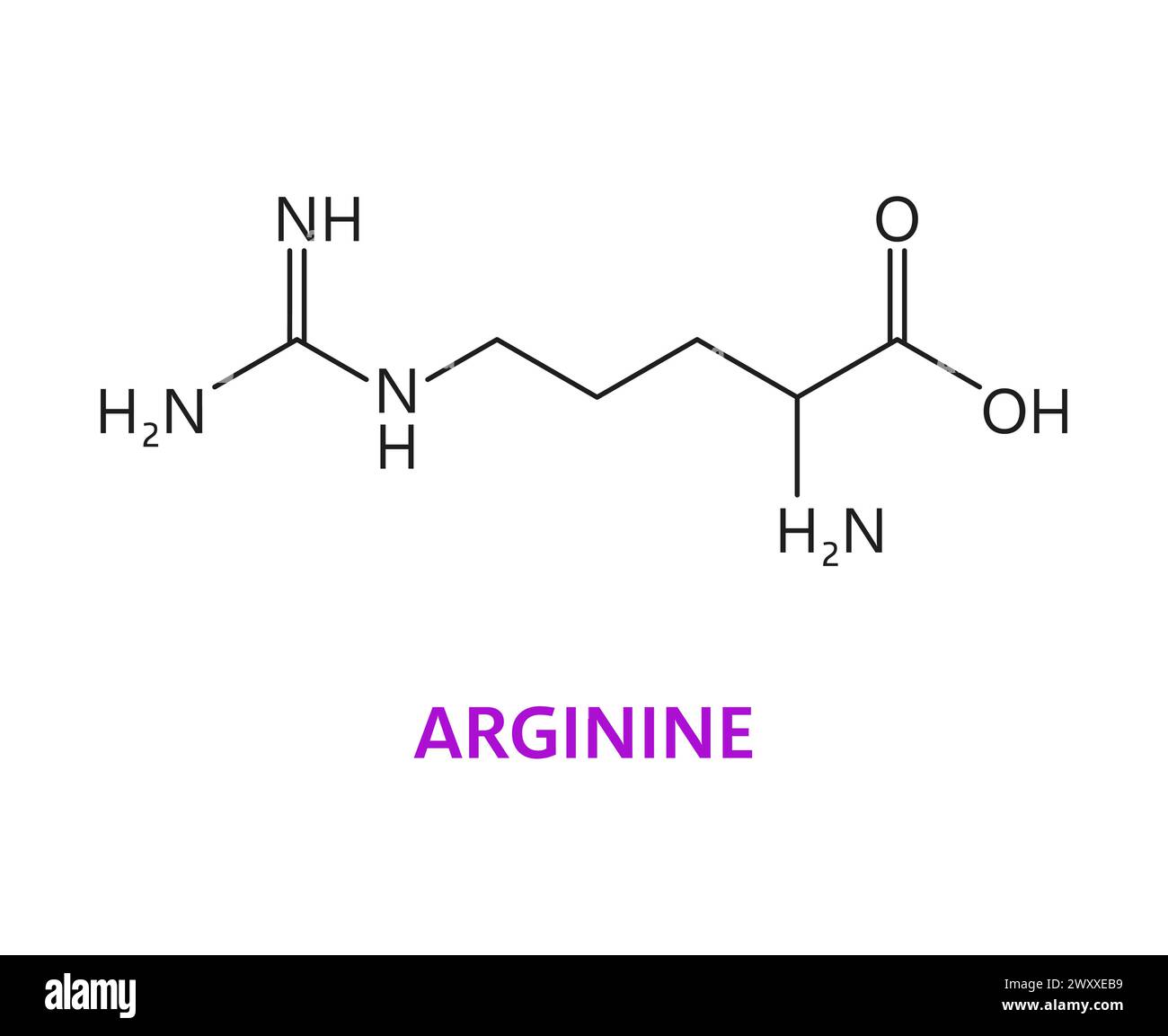
Πρωταμίνες: Θετικά φορτισμένες πυρηνικές πρωτεϊνες με πολικά και πολύ υδρόφιλα μόρια. Πρωτεϊνες χαμηλού μοριακού βάρους, θετικά φορτισμένες, με έντονες βασικές ιδιότητες και μεγάλη περιεκτικότητα σε αργινίνη. Διαλυτές στο νερό, σε όξινα και ουδέτερα περιβάλλοντα δεν καθιζάνουν με τον βρασμό. Είναι μέρος των νουκλεοπρωτεϊνών, (σύνθετες) , στον πυρήνα των κυττάρων βρίσκονται σε ένα σύμπλεγμα DNA. βρίσκονται στα σπερματοζωάρια ορισμένων ψαριών (σολομός, ρέγγα, σκουμπρί). Κυρίως δομικές πρωτεϊνες.
Ιστόνες: Επίσης πυρηνικές πρωτείνες, μικρού μοριακού βάρους, με τριτοταγή δομή και έντονες αλκαλικές ιδιότητες που περιέχουν αργινίνη και λυσίνη. 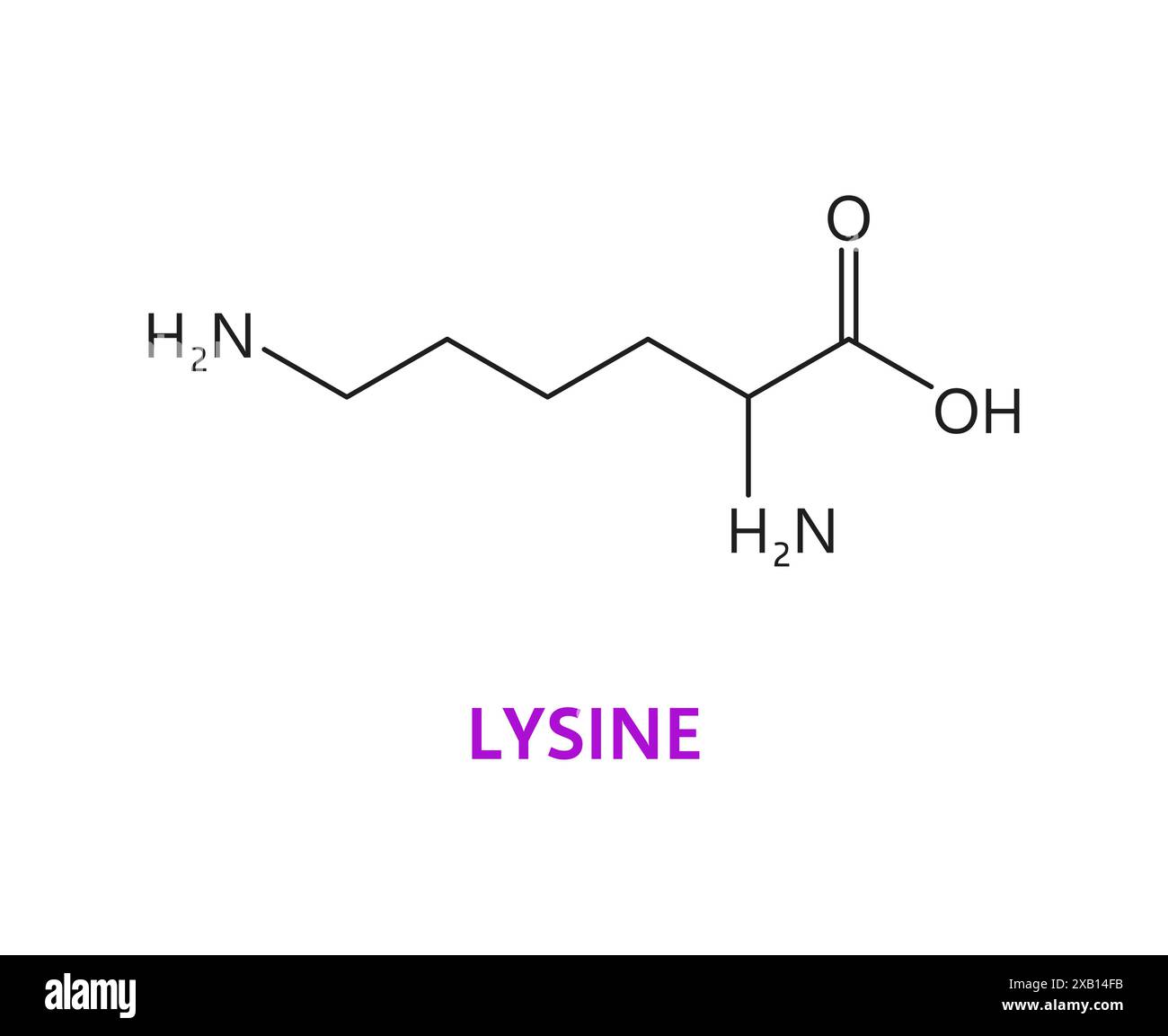
Είναι οι πρωτείνες των χρωμοσωμάτων που σχηματίζουν μια "ραχοκοκαλιά" γύρω από την οποία τυλίγεται το DNA και παίζουν ρόλο στην ρύθμιση της γονιδιακής δραστηριότητας. Αυτή η ρύθμιση συνίσταται στον αποκλεισμό μεταφοράς γενετικών πληροφοριών από το DNA στο RNA.
Σταθερές πρωτεϊνες, έχουν παρόμοιες ιδιότητες με τις πρωταμίνες. Βρίσκονται σε μορφή νουκλεοπρωτεϊνων σε λευκοκύτταρα και σφαιρίδια ερυθρού αίματος
![]()
Προλαμίνες: Φυτικές πρωτεϊνες κυρίως των δημητριακών, εφεδρικής σημασίας και χαμηλής θερμιδικής αξίας, περιέχονται στην γλουτένη των σπόρων των δημητριακών.
Αδιάλυτες σε νερό και πολλά άλλα διαλύματα λόγω της υψηλής περιεκτικότητάς τους σε προλίνη (μη πολικό αμινοξύ)
Προλαμίνες είναι η γλιαδίνη (στο σιτάρι και σίκαλη) η holdrein (κριθάρι), avenin (βρώμη), edestin (κάνναβη).
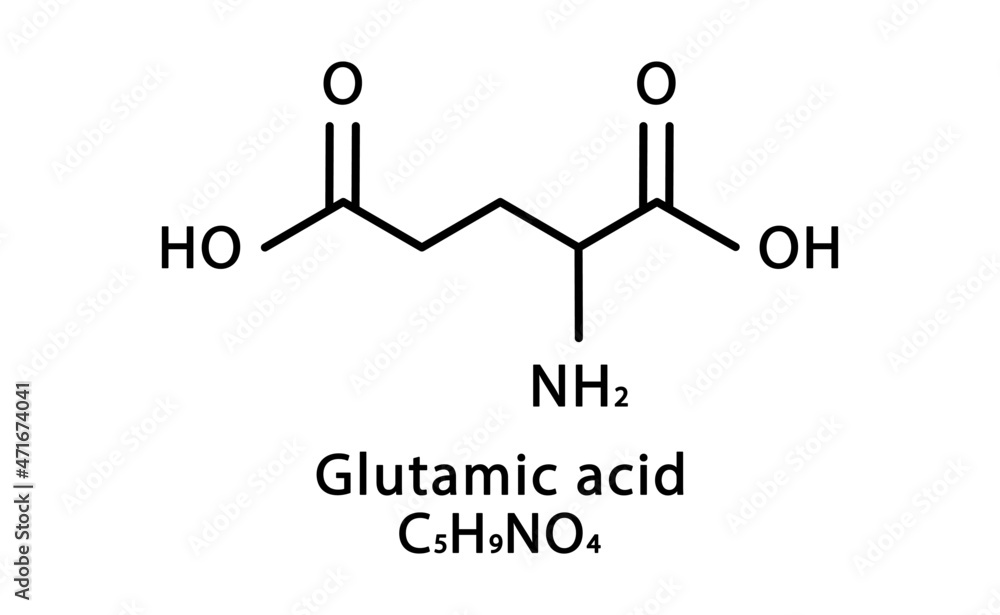 Γλουτελίνες: Είναι φυτικές πρωτεϊνες κυρίως στα όσπρια και στα δημητριακά. υψηλής θρεπτικής αξίας, περιέχουν προλίνη και γλουταμινικό. Αδιάλυτες στο νερό, αλκοόλη αλατούχα διαλύματα, διαλύονται σε αραιά οξέα και αλκάλια, κατέχουν μια ενδιάμεση θέση μεταξύ προλαμινών και σφαιρινών
Γλουτελίνες: Είναι φυτικές πρωτεϊνες κυρίως στα όσπρια και στα δημητριακά. υψηλής θρεπτικής αξίας, περιέχουν προλίνη και γλουταμινικό. Αδιάλυτες στο νερό, αλκοόλη αλατούχα διαλύματα, διαλύονται σε αραιά οξέα και αλκάλια, κατέχουν μια ενδιάμεση θέση μεταξύ προλαμινών και σφαιρινών
Γλουτελίνες είναι η ορισελίνη στο ρύζι, γλουτελίνη στο καλαμπόκι, γλουτένη* στο σιτάρι
ΠΗΓΕΣ
Οργανικές ουσίες του κυττάρου. Πρωτεΐνες – τι είναι, ορισμός και απάντηση
Ταξινόμηση πρωτεϊνών | Χημεία Online
Τι είναι η γλουτένη: γιατί είναι επιβλαβής και πού βρίσκεται | TestoVed
Η σημασία των βιομορίων στον ανθρώπινο οργανισμό. Μέρος Ένατο. Πρωτείνες και ορισμένες ιδιότητές τους

