Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
υπό κατασκευή
ΠΟΙΕΣ ΕΙΝΑΙ ΟΙ ΠΡΩΤΕΪΝΕΣ
Μεταξύ των οργανικών ουσιών του κυττάρου, οι πρωτεϊνες κατέχουν την σημαντικότερη θέση από άποψη σημασίας τους και της ποσότητάς τους στο κύτταρο, όπου αποτελούν το 10-12% της συνολικής μάζας του κυττάρου. Ο ρόλος τους είναι δομικός και μηχανικός, λειτουργούν σαν βιολογικοί καταλύτες, εκτελούν λειτουργίες μεταφοράς και σηματοδότητσης. Για την εκτέλεση αυτών των λειτουργιών έχει σημασία η αναδίπλωση των πρωτεϊνών, δηλαδή η δευτεροταγής και τριτοταγής δομή τους.
Στην κατασκευή των πρωτεϊνών, η πρωτοταγής δομή συνίσταται από την σύνδεση των αμινοξέων (συμπύκνωση ) μέσω πεπτιδικών δεσμών
Τα αμινοξέα είναι χημικές ενώσεις που περιέχουν μια τουλάχιστον αμινομάδα και μια τουλάχιστον αμινομάδα. Από τα αμινοξέα, αυτά που αποτελούν τους δομικούς λίθους των πρωτεϊνών (πρωτεϊνογόνα) είναι τα α αμινοξέα και πιο συγκεκριμένα τα L α-αμινοξέα . Να θυμηθούμε ότι τα L(δεξιόστροφα) και D (αριστερόστροφα) αμινοξέα καθορίζονται με βάση την γλυκεριναλδεϋδη
Ο πεπτιδικός δεσμός
Η σύνδεση των αμινοξέων για την δημιουργία πολυπεπτίδιων τα οποία θα εξελιχθούν σε πρωτεϊνες γίνεται μέσω πεπτιδικών δεσμών.
Οι πεπτιδικοί δεσμοί είναι ομοιοπολικοί δεσμοί μεταξύ του άνθρακα του καρβοξυλίου της α καρβοξυλομάδας του ενός αμινοξέος και του αζώτου της α αμινομάδας του επόμενου αμινοξέος για την κατασκευή της πολυπεπτιδικής αλυσίδας με την ταυτόχρονη αποβολή ενός μόριου νερού (αφυδάτωση και συμπύκνωση).

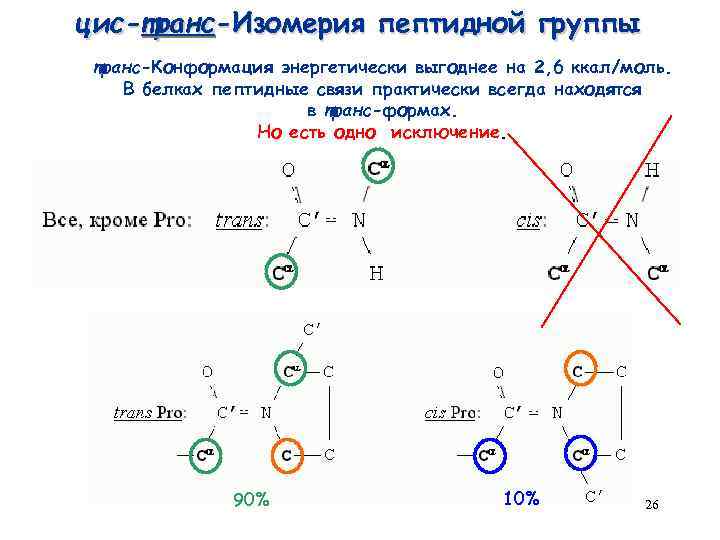
Ο δεσμός άνθρακα και αζώτου εμφανίζει το φαινόμενο της ισομέριας εφόσον η καρβονυλική ομάδα από το οξύ -C=O συντονίζεται με την σύνδεση C-N και ο διπλός δεσμός μεταφέρεται και στην σύνδεση αυτή (-N=C-). Αυτό δε έχει σαν αποτέλεσμα την σταθερότητα του δεσμού με την μείωση της απόστασης της σύνδεσης C-N, από την φυσιολογική . Επίσης τα άτομα αζωτο, άνθρακας, οξυγόνο και υδρογόνο βρίσκονται λόγω του συντονισμού στο ίδιο επίπεδο ενώ οι R στους α άνθρακες βρίσκονται έξω από αυτό το επίπεδο., με αποτέλεσμα να εμφανίζονται cis και trans ισομερείς μορφές για τους άνθρακες των δύο αμινοξέων του πεπτιδικού δεσμού.
Στην δημιουργία της πολυπεπτιδικής αλυσίδας (πρωτοταγής δομή) συμμετέχουν και οι δύο ισομερείς μορφές cis και trans σε κάθε θέση των πεπτιδικών ομάδων
Όμως σε ανώτερες δομές του πολυμερούς δηλαδή όταν οι αλυσίδες διπλώνονται, υιοθετείται ένα μόνο από τα δύο ισομερή σε κάθε θέση και προτιμάται η trans μορφή με πλειοψηφία 1000/1
Οι πρωτεϊνες είναι πολύ μεγάλα μόρια
Πίνακας 4
Μοριακά χαρακτηριστικά ορισμένων πρωτεϊνών
|
Πρωτεΐνη |
Σχετικό μοριακό βάρος |
Αριθμός αλυσίδων |
Αριθμός υπολειμμάτων |
|
Ινσουλίνη |
5733 |
2 |
51 |
|
|
ψψψ |
αμινοξέων |
|
|
Ινσουλίνη |
5733 |
2 |
51 |
|
Ριβονουκλεάση |
13683 |
1 |
124 |
|
Μυοσφαιρίνη |
16890 |
1 |
153 |
|
Χυμοθρυψίνη |
22600 |
3 |
241 |
|
Αιμοσφαιρίνη |
64500 |
4 |
574 |
|
Γλουταμινική αφυδρογονάση |
~1000000 |
~40 |
~8300 |
Τα πρωτεϊνικά μόρια μπορούν να περιέχουν ένα ευρύ φάσμα
Οι πρωτεϊνες είναι ενώσεις σταθερές μόνο υπό ορισμένες συνθήκες. Όταν η θερμοκρασία αυξάνεται εμφανίζεται μη αναστρέψιμη πήξη, εάν όμως βρίσκονται υπό την επίδραση ηλεκτρολυτών εμφανίζεται αναστρέψιμη πήξη.
- Υπό την επίδραση νιτρικού οξέος η πρωτεΪνη πήζει σχηματίζοντας έναν πορτοκαλί θρόμβο
- Υπό την επίδραση υδροξείδιου του χαλκού δίνουν ένα μωβ χρώμα λόγω σχηματισμού συμπλόκου
Σε μεταβατικές καταστάσεις ο διπλός δεσμός του ισομερισμού σπάει με ενέργεια ενεργοποίησης 20kj/mol.
Όμως η ενέργεια ενεργοποίησης της κατάργησης του ισομερισμού του διπλού δεσμού μπορεί να μειωθεί εάν συμβούν αλλαγές που καταργούν την ευνοούν την ενιαία συνδεδεμένη μορφή όπως:
- η τοποθέτηση της ομάδας πεπτιδίου σε υδρόφοβο περιβάλλον (Οι πεπτιδικοί δεσμοί είναι σταθεροί σε υδατικό περιβάλλον)
- ή κάποιες εξωτερικές επιδράσεις όπως η εξωτερική δωρεά δεσμού υδρογόνου στο άτομο του αζώτου του αμινοξέος και αυτό επιτυγχάνεται παρουσία ενζύμων που για τους ζωντανούς οργανισμούς είναι εξειδικευμένα. Ο δεσμός αυτός καταργείται με ενζυματική υδρόλυση με την οποία επιτυγχάνει το σπάσιμο του δεσμού και ελευθερώνει ενέργεια 2-4 kcal/mol
Η εξειδίκευση των πρωτεϊνικών ενζύμων
Τα ένζυμα συνύθως είναι μεγάλες σφαιρικές πρωτεϊνες (μεγαλύτερες από το υπόστρωμα που καταλύουν) που λειτουργούν μειώνοντας την ενέργεια ενεργοποίησης που απαιτείται για την πραγματοποίηση μιας χημικής αντίδρασης. Παρ ότι αποτελούνται από πολλές μονάδες υπολλειμάτων (από μερικές δεκάδες έως 2.500 υπολλείματα αμινοξέων, η περιοχή που συμμετέχει στην κατάλυση είναι μικρή και λέγεται ενεργή θέση που περιέχει μια ή περισσότερες θέσεις δέσμευσης καθώς και μια θέση ενεργοποίησης, μια θέση του μορίου, η οποία μειώνει την ενέργεια .
ι μόνο είναι εξειδικευμένα για την κάθε βιοκατάλυση στην οποία συμμετέχουν αλλά και λειτουργούν διαφορετικα ανάλογα με την πρωτεϊνη (υπόστρωμα) που επιρρεάζουν και την συγκεκριμένη αντίδραση που καταλύουν:
Χαρακτηριστικές περιπτώσεις εξειδικευσης ενζύμων
- Η εξειδίκευση της α χυμοθρυψίνης συνίσταται σε μια ογκώδη υδρόφοβη ρίζα στο μόριο του υποστρώματος
- Η εξειδίκευση της ελαστίνης βασίζεται σε μεθυλομάδα
Ο μηχανισμός σε κάθε μία περίπτωση, οφείλεται σε μικρές διαφορές που έχουν τα δύο ένζυμα στις ενεργές θέσεις τους:
Η α χυμοθρυψίνη έχει έναν πολύ ευρύχωρο υδρόφοβο θύλακα μέσα στον οποίο δεσμεύεται η ογκώδης υδρόφοβη αρωματική ομάδα του μορίου του υποστρώματος
Στην ελαστίνη η ενεργός της θέση έχει μια περιοχή μικρότερη της α χυμοθρυψίνης επιδή τα αμινοξέα που βρίσκονται εκεί είναι μεγαλύτερα αυτών της α χυμοθρυψίνης και "τρώνε" τον χώρο. Έτσι μπορεί να απορροφά μόνο την μεθυλική ομάδα του υποστρώματος κι έτσι αυτό να υδρολύεται
Σχήμα του μορίου της πρωτεϊνης
Σύμφωνα με το σχήμα του μορίου τους οι πρωτεϊνες χωρίζονται σε σφαιρικές και ινώδεις
Σε πρωτεϊνες με σφαιρικό σχήμα
*Σφαιρικές πρωτεϊνες: Οι πολυπεπτιδικές τους αλυσίδες διπλώνονται με συμπαγείς μορφές σφαιριδίων. Η δομή είναι συμπαγής και πυκνή και το σχήμα είναι κοντά σε σφαίρα. Συνήθως είναι διαλυτές στο νερό και διαχέονται
Η ομάδα αυτή περιλαμβάνει όλα τα ένζυμα, τα αντισώματα και τις ορμόνες που είναι πρωτεϊνες.
Η πρώτη ομάδα των σφαιρικών πρωτείνών είναι οι λευκοματίνες που είναι υδροδιαλυτές, αλλά πήζουν με την υψηλή θερμοκρασία. Βρίσκονται στο γάλα, στο αίμα, στα αυγά και πολλά φυτά
Πρωτεϊνες με επίμηκες σχήμα μορίου
Οι ινώδεις πρωτεϊνες με επίμηκες σχήμα μορίου, είναι συνήθως αδιάλυτες στο νερό (κολλαγόνο, κερατίνη, μυοσίνη) και περιλαμβάνουν ινώδεις συσταλτές πρωτεϊνες (ακτίνη, μυοσίνη) πρωτεϊνες μικροσωληνίσκων σε ευκαρυωτικά
Φυσικοχημικές ιδιότητες των πρωτεϊνών .Το Ισοηλεκτρικό Σημείο
Σε κάθε επαμφοτερίζον διάλυμα υπάρχει ένα σημείο του ΡΗ που ο ιονισμός του ως οξύ εξισορροπείται από τον ιονισμό του ως βάση. Εάν πρόκειται για αμυνοξύ, στο σημείο αυτό του ΡΗ το αμινοξύ συμπεριφέται ως ουδέτερο με συνέπεια το καθαρό φορτίο να παρουσιάζεται σαν μηδενικό, οπότε δεν μετακινείται σε ένα ηλεκτρικό πεδίο.
Αντίστοιχο ισοηλεκτρικό σημείο εμφανίζουν και οι πρωτεϊνες, στο οποίο το μόριό τους είναι ηλεκτρικά ουδέτερο και η διαλυτότητά τους η μικρότερη δυνατή, ώστε καθιζάνουν ακριβώς σε αυτό το σημείο
Εδώ όμως υπάρχει μια διαφορά. ο ισοηλεκτρικό σημείο αλλά και γενικά οι ιδιότητες μιας πρωτεϊνης, δεν καθορίζονται από το σύνολο των αμινοξέων της αλλά μόνο από τις ομάδες ριζών των αμινοξέων της που εκτίθενται στην επιφάνεια
ΑΠΛΕΣ ΚΑΙ ΣΥΝΘΕΤΕΣ ΠΡΩΤΕΊΝΕΣ
Διακρίνουμε τις πρωτεϊνες στις απλές όταν αποτελούνται μόνο από μια σειρά αμινοξέων και στις σύνθετες πρωτεϊνες.
Οι απλές πρωτεϊνες διακρίνονται σε αλβουμίνες, σφαιρίνες, πρωταμίνες, ιστόνες, προλαμίνες, γλουτλίνες πρωτεϊνοειδή
Οι σύνθετες πρωτεϊνες είναι σφαιρικές πρωτεϊνες* που έχουν συνδεδεμένο και ένα μη πρωτεϊνικό τμήμα το οποίο αποτελεί την προσθετική τους ομάδα.
Ανάλογα με το μη πρωτεϊνικό μέρος που συνδέεται με την πρωτεϊνη, οι σύνθετες πρωτεϊνες διακρίνονται σε:
Χρωμοπρωτεϊνες , Γλυκοπρωτεϊνες , Νουκλεοπρωτεϊνες , Λιποπρωτεϊνες , Φωσφοπρωτεϊνες, Μεταλλοπρωτεϊνες
ΟΙ ΑΠΛΕΣ ΠΡΩΤΕΪΝΕΣ
Οι απλές πρωτεϊνες αποτελούν την συντριπτική πλειοψηφία των πρωτείνών σε κύτταρα, ιστούς και όργανα οργανισμών, σε ανοσοποιητικά σώματα, πρωτείνες αίματος, ορμόνες και ένζυμα.
Διαφέρουν μεταξύ τους ως προς τον αριθμό και την αλληλουχία υπολειμμάτων αμινοξέων και το μοριακό τους βάρος.
ΟΙ ΣΥΝΘΕΤΕΣ ΠΡΩΤΕΪΝΕΣ
Οι σύνθετες πρωτεϊνες είναι σφαιρικές πρωτεϊνες* που έχουν συνδεδεμένο και ένα μη πρωτεϊνικό τμήμα το οποίο αποτελεί την προσθετική τους ομάδα.
Ανάλογα με το μη πρωτεϊνικό μέρος που συνδέεται με την πρωτεϊνη, οι σύνθετες πρωτεϊνες διακρίνονται σε:
Χρωμοπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι μια έγχρωμη ομάδα
Γλυκοπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι υδατάνθρακες
Νουκλεοπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι νουκλεϊκά οξέα
Λιποπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι λιπίδια
Φωσφοπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι ένα υπόλειμμα φωσφορικού οξέος
Μεταλλοπρωτεϊνες όταν το μη πρωτείνικό τμήμα είναι σύνθετο δεσμευμένο μέταλλο
ΤΑ ΠΡΩΤΕΪΝΟΕΙΔΗ
Είναι πρωτεϊνες που περιέχουν αμινοξέα γλυκίνη, προλίνη, κυστίνη συναντώνται σε υποστηρικτικούς ιστούς όπως χόνδρους, οστά, τένοντες, σύνδεσμοι.
Σχηματίζουν ινώδεις δομές λόγω της ικανότητάς τους να βρίσκονται σε τριτοταγείς και τεταρτοταγείς δομές και είναι αδιάλυτα σε νερό, αλατούχα διαλύματα, αραιά διαλύματα οξέων και βάσεων. Δεν διασπώνται στον πεπτικό ούτε μεταβολίζονται πλην εξαιρέσεων σε ορισμένα αρθρόποδα που τρέφονται με ινώδεις πρωτεϊνες (φτεράά, δέρμα, γούνα, όπως οι σκώροι.
Περιλαμβάνουν το κολλαγόνο, ελαστίνη, κερατίνη, ινώδους μεταξιού
Το κολλαγόνο αποτελεί το ένα τρίτο των πρωτεϊνών στο σώμα, στον συνδρ]ετικό ιστό των οστών, τένοντων, συνδέσμων, χόνδρων. Με θέρμανση σε νερό άνω των 56 βαθμών μετατρέπεται σε διαλυτή κόλα που όταν ψύχεται σχηματίζει ζελέ.
Η ελαστίνη βρίσκεται σε ελαστικούς ιστούς, τένοντες και αρτηρίες.
Οι κερατίνες: Είναι σκληρές και ανθεκτικές πρωτεϊνες, ταξινομούνται σε
α κερατίνες που βρίσκονται σε σπονδυλωτά σε τρεις έλικες δύο δεξιόστροφες και μία αριστερόστροφη, μήκους περίπου 0,5nm, που συνδυάζονται για να σχηματίσουν μια υπερέλικα και αποτελούν τις πρωτεϊνες μαλλιού, τριχών, κέρατων, οπλ, κ.α.
Συναρμολογούνται σε δεσμίδες των 1000 αμινοξέων τα οποία δεν έχουν περιοδικότητα στην εναλλαγή των υπολειμμάτων τους. μΔεν υπάρχει περιοδικότητα την εναλλαγή των αμινοξέων και αυτή είναι που επιρρεάζει τις ιδιότητες κάθε πολυπεπτιδίου καθώς και την υπερμοριακή του δομή και εν τέλει την χρήση τους στον οργανισμό.
β κερατίνες (πρωτεϊνες φτερών, δέρματος, ραμφων, γούνας, λέπια ερπετών, ινώδης μεταξιού που είναι εκκριτική πρωτεϊνη ορισμένων εντόμων). Περιέχουν το αμινοξύ κυστεϊνη
ΠΗΓΕΣ
Οργανικές ουσίες του κυττάρου. Πρωτεΐνες – τι είναι, ορισμός και απάντηση
Πεπτιδικός δεσμός - Βικιπαίδεια
Τι είναι τα ένζυμα και πώς λειτουργούν
Ταξινόμηση πρωτεϊνών | Χημεία Online
Τι είναι η γλουτένη: γιατί είναι επιβλαβής και πού βρίσκεται | TestoVed
Τα πρωτεϊνοειδή
Είναι πρωτεϊνες που περιέχουν αμινοξέα γλυκίνη, προλίνη, κυστίνη συναντώνται σε υποστηρικτικούς ιστούς όπως χόνδρους, οστά, τένοντες, σύνδεσμοι.
Σχηματίζουν ινώδεις δομές λόγω της ικανότητάς τους να βρίσκονται σε τριτοταγείς και τεταρτοταγείς δομές και είναι αδιάλυτα σε νερό, αλατούχα διαλύματα, αραιά διαλύματα οξέων και βάσεων. Δεν διασπώνται στον πεπτικό ούτε μεταβολίζονται πλην εξαιρέσεων σε ορισμένα αρθρόποδα που τρέφονται με ινώδεις πρωτεϊνες (φτεράά, δέρμα, γούνα, όπως οι σκώροι.
Περιλαμβάνουν το κολλαγόνο, ελαστίνη, κερατίνη, ινώδους μεταξιού
Το κολλαγόνο αποτελεί το ένα τρίτο των πρωτεϊνών στο σώμα, στον συνδρ]ετικό ιστό των οστών, τένοντων, συνδέσμων, χόνδρων. Με θέρμανση σε νερό άνω των 56 βαθμών μετατρέπεται σε διαλυτή κόλα που όταν ψύχεται σχηματίζει ζελέ.
Η ελαστίνη βρίσκεται σε ελαστικούς ιστούς, τένοντες και αρτηρίες.
Οι κερατίνες: Είναι σκληρές και ανθεκτικές πρωτεϊνες, ταξινομούνται σε
α κερατίνες που βρίσκονται σε σπονδυλωτά σε τρεις έλικες δύο δεξιόστροφες και μία αριστερόστροφη, μήκους περίπου 0,5nm, που συνδυάζονται για να σχηματίσουν μια υπερέλικα και αποτελούν τις πρωτεϊνες μαλλιού, τριχών, κέρατων, οπλ, κ.α.
Συναρμολογούνται σε δεσμίδες των 1000 αμινοξέων τα οποία δεν έχουν περιοδικότητα στην εναλλαγή των υπολειμμάτων τους. Δεν υπάρχει περιοδικότητα την εναλλαγή των αμινοξέων και αυτή είναι που επιρρεάζει τις ιδιότητες κάθε πολυπεπτιδίου καθώς και την υπερμοριακή του δομή και εν τέλει την χρήση τους στον οργανισμό.
β κερατίνες (πρωτεϊνες φτερών, δέρματος, ραμφων, γούνας, λέπια ερπετών, ινώδης μεταξιού που είναι εκκριτική πρωτεϊνη ορισμένων εντόμων). Περιέχουν το αμινοξύ κυστεϊνη
