Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
υπό κατασκευή
Οι διαμορφώσεις των μακρομορίων
Διαμόρφωση ενός μακρομορίου ονομάζεται η χωρική διάταξη των ατόμων και των ομάδων ατόμων του πολυμερούς η οποία δίνεται από το σύνολο και την ακολουθία της ισομερούς διαμόρφωσης και την θέση τους στην αλυσίδα.
Προκαλείται από την θερμική κίνηση ή από εξωτερικές επιδράσεις στο μακρομόριο
Το μέγεθος του μακρομορίου
Η αλυσίδα ενός πολυμερούς στην διάρκεια της θερμικής κίνησης μπορεί να λάβει μεγάλο αριθμό από διαμορφώσεις ώστε το μέγεθος της αλυσίδας να εξαρτάται από αυτές τις διαμορφώσεις. Ο υπολογισμός του περιέχει την απόσταση των άκρων του h όπου λαμβάνεται συνήθως το 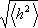 ).και χρησιμοποιείται επίσης και η μέση τετραγωνικής τιμής ρίζας ακτίνα αδράνειας
).και χρησιμοποιείται επίσης και η μέση τετραγωνικής τιμής ρίζας ακτίνα αδράνειας 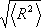 . Το R2 είναι η μέση τιμή του τετράγωνου της απόστασης ri όλων των στοιχείων της μάζας της αλυσίδας από το κέντρο αδράνειάς της.
. Το R2 είναι η μέση τιμή του τετράγωνου της απόστασης ri όλων των στοιχείων της μάζας της αλυσίδας από το κέντρο αδράνειάς της.
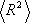 =
=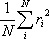
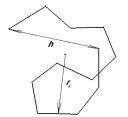
Ισομέρεια στις διαμορφώσεις του πολυμερούς
Κάθε διαμόρφωση της αλυσίδας του πολυμερούς, που προκαλείται από την θερμική κίνηση ή από εξωτερικές επιδράσεις στο μακρομόριο.
Σε κάθε μια δεδομένη διαμόρφωση όμως, το πολυμερές έχει μεγάλο αριθμό βαθμών εσωτερικής ελευθερίας που είναι αποτέλασμα της περιστροφής των απλών δεσμών γύρω από τον άξονα της αλυσίδας ή της ταλάντωσης γύρω από έναν μόνο δεσμό και επομένως το πολυμερές μπορεί να πάρει διάφορες διαμορφώσεις δηλαδή υπάρχει ένας "διαμορφωτικός ισομερισμός"
Δηλαδή, έχουμε το "πέρασμα" από την μια διαμόρφωση με δυναμική ενέργεια U1 σε άλλη με δυναμική ενέργεια U2 χωρίς βέβαια να διακόπτωνται ή να αλλάζουν οι χημικοί δεσμοί και εφόσον βέβαια υπάρχουν στο μόριο εσωτερικοί μηχανισμοί για το πέρασμα αυτό.

 Κατά την περιστροφή ατόμων γύρω από τον απλό δεσμό η χωρική διάταξη των ατόμων αλλάζει συνεχώς και σε κάθε θέση των ατόμων αντιστοιχεί ορισμένη τιμή της δυναμικής ενέργειας των μορίων. Σε κάθε θέση των ατόμων αντιστοιχεί μια ορισμένη της δυναμικής ενέργειας του μορίου και μεταξύ αυτών κάποια αντιστοιχεί στηνελαχίστη και κάποια άλλη στην μεγίστη.
Κατά την περιστροφή ατόμων γύρω από τον απλό δεσμό η χωρική διάταξη των ατόμων αλλάζει συνεχώς και σε κάθε θέση των ατόμων αντιστοιχεί ορισμένη τιμή της δυναμικής ενέργειας των μορίων. Σε κάθε θέση των ατόμων αντιστοιχεί μια ορισμένη της δυναμικής ενέργειας του μορίου και μεταξύ αυτών κάποια αντιστοιχεί στηνελαχίστη και κάποια άλλη στην μεγίστη.
Η διαφορά τους είναι το φράγμα ενεργοποίησης
Κατά την πλήρη περιστροφή (360ο) του μορίου γύρω από ένα χημικό δεσμο, συμβαίνει διαδοχικά ένας αριθμός περιστροφικών ισομερών που πραγματοποιούνται διαδοχικά , με ορισμένη δυνητική ενέργεια ο καθένας από αυτούς που μπορεί να αναπαρασταθεί γραφικά με την μορφή ενός ενεργεικού χάρτη.
 (εικόνα: δυναμική ενέργεια μορίου αιθανίου κατά την περιστροφή της ομάδας μεθυλίου και 1,2 διχλωροαιθάνιο)
(εικόνα: δυναμική ενέργεια μορίου αιθανίου κατά την περιστροφή της ομάδας μεθυλίου και 1,2 διχλωροαιθάνιο)
Μόρια που δεν έχουν την ιδανική συμμετρία που έχει το μόριο του αιθανίου όπως το βουτάνιο ή το διχλωροβουτάνιο κ.α. έχουν το αντίστοιχο διάγραμμα πιο ακανόνιστο από του αιθανίου.
Διαμορφώσεις και ευελιξία του πολυμερούς
Η ύπαρξη αναρίθμητων εξωτερικών διαμορφώσεων των πολυμερών με διαφορετικές δυνητικές ενέργεες έκαστη, καθορίζουν την πιο σημαντική ιδιότητα των πολυμερών: την δυνατότητα αλλαγής τους, δηλαδή την ευελιξία των πολυμερών
Η ευχέρεια στην αλλαγή της διαμόρφωσης αυτής , οφείλεται στην δυνατότητα περιστροφής ενός επόμενου δεσμού σε σχέση με τον προηγούμενο σε μια γωνία όπου ταυτόχρονα παρεμποδίζεται η εσωτερική περιστροφή , οδηγεί στην ευκαμψία των μακρομορίων όπου η διαμόρφωση του μορίου μπορεί να αλλάζει χωρίς να σπάνε οι χημικοί δεσμοί του.
Η ευχέρεια αυτή βασίζεται στο γεγονός ότι η δυναμική ενέργεια των δεσμών αυτών μπορεί να παίρνει περισσότερες από μία τιμές
Αν θεωρήσουμε την απλούστερη περίπτωση όπου ένας χημικός δεσμός του πολυμερούς ή και ένα ολόκληρο τμήμα αυτού, έχει δύο ενεργειακές στάθμες δυναμικής ενέργειας U1 και U2 ώστε μπορεί να μεταβαίνει από την αρχική κατάσταση U1 στην επόμενη U2 . Για να γίνει αυτό πρέπει να υπερβεί τον ενεργειακό φραγμό Uo=U2-U1
H διαφορά μεταξύ των δύο δυναμικών ενεργειών U1 και U2 δηλαδή U2-U1 περιγράφει την δυνατότητα μετάβασης από την μια κατάσταση στην άλλη και είναι ένα μέτρο της θερμοδυναμικής ευελιξίας(ευκαμψίας) και περιγράφει την ικανότητα της αλυσίδας να μεταβαίνει από την μια κατάσταση σε άλλη καθώς και την πιθανότητα αυτών των μεταβάσεων .
Στα πολυμερή η εσωτερική περιστροφή γύρω από απλούς δεσμούς διαφέρει από αυτήν των μικρών ενώσεων για τον λόγο ότι: εάν αντί για τις διαμορφώσεις μιας μικρής ένωσης όπως το διχλωροαιθάνιο CH2ClCH3Cl που οφείλονται στην περιστροφή γύρω από τον απλό δεσμό και διακρίνονται σε ακραίες sic και trans διαμορφώσεις, θεωρήσουμε ένα θραυσμα πολυμερούς όπως -(CHClCHCl-)ν, . Η περιστροφή γύρω από τον δεσμό του θραύσματος σε ένα πολυμερές όπως το πολυδιχλωροαιθάνιο είναι πολύ δυσκολότερη γιατί, αντί του 3ου υδρογόνου έχουμε ογκώδεις προεκτάσεις των ανθρακικών αλυσίδων που δυσκολεύονται να κινηθούν. Αλλά εκείνο που είναι χαρακτηριστικό είναι η δυσκολία περιστροφής των άλλων ατόμων της αλυσύδας του πολυμερούς εάν σε κάποια σημεία το πολυμερές καταφέρνει να πριστρέφεται, η περιστροφή αυτή περιορίζει τον χώρο για την περιστροφή του μορίου του πολυμερούς γύρω από κάποιον επόμενο ή μεθεπόμενο δεσμό. Άρα, μια εκτεταμένη περιστροφή του πολυμερούς γύρω από τους απλούς δεσμούς του αναστέλλεται και περιορίζεται μόνο σε ένα ορισμένο τόξο που εξαρτάται από την θερμοκρασία, την φύση και την πολικότητα του δεσμού, τους υποκαταστάτες κ.α. .
Οι σύνηθεις διαμορφώσεις του μακρομορίου
Η θερμοδυναμική ευκαμψία ενός πολυμερούς καθορίζεται κυρίως από την χημική του δομή.
Ανάλογα με την χημική δομή της αλυσίδας και την ένταση της θερμικής κίνησης τα πολυμερή μακρομόρια λαμβάνουν διαφορετικές διαμορφώσεις
Γνωστότερες είναι η ράβδος, τα στατιστικά συμπλέγματα, η διαμόρφωση έλικας η διαμόρφωση σφαιριδίου η πτυχή και ο στρομφαλοφόρος άξονας. Είναι διαμορφώσεις που πραγματοποιούνται σχετικά εύκολα, εάν εφαρμοστούν εξωτερικά πεδία ή εάν αλλάξει η φύση του διαλύτη
- Η χαλαρά αρθρωτή αλυσίδα είναι μια χαλαρά αρθρωτή αλυσίδα που αποτελείται από η δεσμούς όπου υποτίθεται ότι ο κάθε επόμενος δεσμός κινείται ελεύθερα σε σχέση με τον προηγούμενο. Στατιστικά υπολογίζεται η τελική θέση και οι αναδιπλώεις της αλυσίδας
- Το στατιστικό μπέρδεμα είναι μια περισσότερο ή λιγότερο διπλωμένη διαμόρφωση του μακρομορίου. Σε αυτά η ένταση της εσωτερικής θερμικής κίνησης είναι μεγαλύτερη από αυτήν της εξωτερικής. Πολλά γραμμικά Πολυμερή όπως το πολυαιθυλένιο, πολυπροπυλένιο, πολυβουταδιένιο, πολυισοπρένιο εμφανίζουν τέτοια δομή.
- Διαμόφωση ράβδου. Τέτοια δομή σχηματίζουν πολυμερή των οποίων η αλυσίδα περιλαμβάνει κυκλικές ή αρωματικές ενώσεις, αμιδικές ομάδες, πολλαπλούς δεσμούς που γενικά περιορίζουν την εσωτερική περιστροφή όπως είναι η κυτταρίνη, πολυαιθυλενογλυκόλη, αρωματικά πολυαμίδια κ.α.

- Η έλικα (μακρομοριακό πηνίο) είναι μια διαμόρφωση που συμβαίνει σε μακρομόρια μεγάλης εμβέλειας που η αλυσίδα τους περιέχει κυρίως απλούς δεσμούς και τα οποία σταθεροποιούνται από δεσμούς υδρογόνου. Άτομα του ίδιου τύπου, βρίσκονται στην ίδια ελικοειδή γραμμή
- Είναι σύνηθης διαμόρφωση για τα βιοπολυμερή. Από τα συνθετικά πολυμερή ορισμένα όπως το χλωριούχο πολυβινύλιο
Στην εικόνα έχουμε την ελικοειδή μορφή δύο πεπτιδικών αλυσίδων. Η δεξιά έλικα είναι πιο πλεονεκτική για L αμινοξέα, ενώ η αριστερόστροφη είναι ενεργειακά πλεονεκτική για D αμινοξέα . Τα αλκυλια R είναι κάθετα στο επίπεδο του σχεδίου. Η παρουσία της ελικοειδούς δομής αποδείχθηκε πρώτα από τους Pauling και Corey.
Ο Αμερικάνος χημικός Linus Carl Pauling το 1952 πήρε Νόμπελ Χημείας
- Σφαιρίδιο. Διαμόρφωση πολυμερούς σε μορφή σφαιριδίου βρίσκεται σε μακρομόρια με πολύ ισχυρές ενδομοριακές αλληλεπιδράσεις, όπως πολυμερή που περιέχουν άτομα φθορίου όπως το πολυτετραφθοροαιθυλένιο.
- Είναι σύνηθης διαμόρφωση για τα βιοπολυμερή. Από τα συνθετικά πολυμερή ορισμένα όπως πολυτετρα φθοροαιθυλένιο
Η εσωτερική διαμόρφωση των μορίων πολυμερών σε τριτοταγή και τεταρτοταγή δομή, όοφείλεται στις γωνίες των δεσμών μεταξύ των συνδέσεων τόσο της κύριας αλυσίδας όσο και των διασταυρώσεων και έχει την αιτία της στη δυνατότητα περιστροφής κάθε επόμενου δεσμού σε σχέση με τον προηγούμενο
Ένα μόριο με μικρό απόθεμα κινητικής ενέργειας παραμένει στην χαμηλή ενεργειακή στάθμη και ομάδες μορίων δεν μπορούν να περιστραφούν αλλά έχουν μόνο κίνηση από ταλαντώσεις.
.jpg)
Δήμητρα Σπανού
ΠΗΓΕΣ
Ευελιξία μακρομορίων - ενώσεις υψηλού μοριακού βάρους
Διαμόρφωση μακρομορίων, βασικές διατάξεις διαμορφωτικού ισομερισμού μακρομορίων - ΕΝΏΣΕΙΣ ΥΨΗΛΟΎ ΜΟΡΙΑΚΟΎ ΒΆΡΟΥΣ
ΦΥΣΙΚΗ ΔΟΜΗ ΠΟΛΥΜΕΡΩΝ, Διαμόρφωση μακρομορίων - Πολυμερή νανοσύνθετα υλικά
Δευτερογενής Δομή Πρωτεϊνών - Ελικοειδής Δομή - Χωρική Δομή Πρωτεϊνών - Δομή Πρωτεϊνών
3. Διαμόρφωση μακρομορίων.
| |
Εσωτερική περιστροφή σε μακρομόρια
Ένα μόριο οποιασδήποτε ουσίας χαρακτηρίζεται από μια ορισμένη χωρική διάταξη ατόμων και την παρουσία ορισμένων δεσμών μεταξύ τους. Αυτό καθορίζει τη χημική δομή (δομή, διαμόρφωση) του μορίου. Ως αποτέλεσμα της περιστροφής, της περιστροφής ή της ταλάντωσης γύρω από έναν μόνο δεσμό, εμφανίζονται μετασχηματισμοί διαμόρφωσης. Οι περιστροφές αναστέλλονται, δεν είναι ελεύθερες. Η άπωση ατόμων υδρογόνου του ίδιου τύπου σε γειτονικές μεταλλικές ομάδες καθιστά τις διαφορετικές χωρικές μορφές του μορίου ενεργειακά άνισες.
Πάρτε το μόριο αιθανίου C2N6 (Εικ. 1.1 α). Στο μόριο αιθανίου, τα άτομα άνθρακα συνδέονται με άτομα υδρογόνου και μεταξύ τους με ομοιοπολικούς δεσμούς (c-δεσμοί), οι οποίοι καθορίζουν την τετραεδρική διάταξη των υποκαταστατών και η γωνία μεταξύ των κατευθύνσεων των δεσμών ο (γωνία σθένους) είναι 109°28'.
Η ειδική διαμόρφωση του νέφους ηλεκτρονίων δεσμού l στο αιθυλένιο καθορίζει τη σταθερή κατεύθυνση των υπόλοιπων τεσσάρων ομοιοπολικών δεσμών σε δύο άτομα άνθρακα. Αυτές οι συνδέσεις βρίσκονται στο ίδιο επίπεδο υπό γωνία 120° (Σχήμα 1.16) μεταξύ τους.

Ρύζι. 1.1. Μοντέλα μορίων της βαθμίδας α) και του αιθυλενίου β)
Οι ενώσεις με διπλό δεσμό μπορούν να έχουν τόσο χωρικά cis- όσο και t/?sh/s' ισομερή, δηλαδή υπάρχει ένα στερεοϊσομερές. Σε κορεσμένες ενώσεις, ακόμη και με διαφορετικούς υποκαταστάτες σε ένα άτομο άνθρακα, τα cis- και trans-ισομερή δεν βρέθηκαν στις περισσότερες περιπτώσεις. Η απουσία στερεοϊσομερών εξηγείται από την πολύ ταχεία περιστροφή ορισμένων ομάδων μορίων σε σχέση με άλλες. Αυτός ο τύπος κίνησης ενός μέρους του μορίου σε σχέση με ένα άλλο ονομάζεται εσωτερική περιστροφή.
Στο μόριο αιθανίου, όλα τα άτομα υδρογόνου έχουν ίση αξία και επομένως μπορεί να υποτεθεί ότι ανεξάρτητα από τη θέση τους στο διάστημα, η δυναμική ενέργεια των μορίων πρέπει να είναι η ίδια, δηλαδή ότι η περιστροφή είναι ελεύθερη. Ωστόσο, στην πραγματικότητα, η εσωτερική περιστροφή στο μόριο αιθανίου δεν είναι ελεύθερη λόγω της αλληλεπίδρασης μεταξύ χημικά μη δεσμευμένων γειτονικών ατόμων.
Κατά τη διάρκεια της θερμικής κίνησης, η χωρική διάταξη των ατόμων αλλάζει συνεχώς. Κάθε θέση των ατόμων αντιστοιχεί σε μια ορισμένη τιμή της δυναμικής ενέργειας του μορίου, η οποία καθορίζεται από τις αλληλεπιδράσεις μεταξύ ατόμων, ηλεκτρονίων, πυρήνων και ούτω καθεξής.
Όταν περιστρέφεται μία ομάδα μέσης τάσης,3 μόριο αιθανίου γύρω από τη γραμμή που συνδέει τα άτομα άνθρακα, η δυνητική ενέργεια U αλλάζει, δηλαδή U = f(
Όπως φαίνεται στο Σχ. 1.3, η ελάχιστη δυναμική ενέργεια του μορίου αντιστοιχεί σε μια τέτοια θέση των ομάδων στις οποίες τα άτομα υδρογόνου βρίσκονται στη μέγιστη απόσταση μεταξύ τους (μετασχηματισμός). Οποιαδήποτε περιστροφή γύρω από τον δεσμό C-C οδηγεί σε αύξηση της δυνητικής ενέργειας και φτάνει στο μέγιστο όταν τα άτομα υδρογόνου των γειτονικών ομάδων είναι εξαιρετικά κοντά. Η διαφορά μεταξύ της μέγιστης και της ελάχιστης ενέργειας του μορίου είναι το φράγμα δυναμικού ή ενεργοποίησης της περιστροφής AU.

Ρύζι. 1.2. Μεταβολή του σχήματος ενός πολυμερούς μακρομορίου κατά την περιστροφή γύρω από το δεσμό μεταξύ ατόμων άνθρακα i και (i+1)

Ρύζι. 1.3. Εξάρτηση της δυνητικής ενέργειας του μορίου αιθανίου από τη γωνία περιστροφής της μεθυλικής ομάδας
Η πιο μειονεκτική κατάσταση είναι όταν τα άτομα υδρογόνου των δύο μεθυλομάδων βρίσκονται ακριβώς το ένα πάνω στο άλλο, όπως φαίνεται στο Σχήμα. 1.4 b, επειδή στην περίπτωση αυτή εκδηλώνονται μεταξύ τους απωθητικές δυνάμεις, τείνοντας να μεταφέρουν αυτά τα άτομα στην πιο ενεργειακά πλεονεκτική, σταθερή θέση (trans-), που απεικονίζεται στο σχήμα 1. 1.4 α.
Αν πάρουμε τη δυναμική ενέργεια όταν τα άτομα είναι διατεταγμένα στη μορφή trans να είναι 0, τότε η δυναμική ενέργεια που αντιστοιχεί στο μοντέλο στη θέση cis έχει μέγιστη τιμή.
Η εξάρτηση της δυνητικής ενέργειας του μορίου αιθανίου από τη γωνία περιστροφής της μεθυλικής ομάδας φαίνεται στο Σχήμα. 1.4. Για μόρια με χαμηλότερο βαθμό συμμετρίας σε σύγκριση με ένα μόριο αιθανίου, όπως το n-βουτάνιο ή το διχλωροβουτάνιο, η καμπύλη παίρνει ένα πιο περίπλοκο σχήμα (Σχήμα 1.5).

Ρύζι. 1.4. Χωρική διάταξη ατόμων υδρογόνου στο μόριο αιθανίου (οι προβολές των μορίων φαίνονται παρακάτω): a είναι η trans θέση, b είναι η cis-θέση

|
Ευκαμψία πολυμερών μορίων - ενώσεις υψηλού μοριακού βάρους







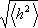
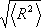 . Το R2 είναι η μέση τιμή του τετράγωνου της απόστασης ri όλων των στοιχείων της μάζας της αλυσίδας από το κέντρο αδράνειάς της.
. Το R2 είναι η μέση τιμή του τετράγωνου της απόστασης ri όλων των στοιχείων της μάζας της αλυσίδας από το κέντρο αδράνειάς της.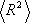 =
=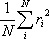


 Κατά την περιστροφή ατόμων γύρω από τον απλό δεσμό η χωρική διάταξη των ατόμων αλλάζει συνεχώς και σε κάθε θέση των ατόμων αντιστοιχεί ορισμένη τιμή της δυναμικής ενέργειας των μορίων. Σε κάθε θέση των ατόμων αντιστοιχεί μια ορισμένη της δυναμικής ενέργειας του μορίου και μεταξύ αυτών κάποια αντιστοιχεί στηνελαχίστη και κάποια άλλη στην μεγίστη.
Κατά την περιστροφή ατόμων γύρω από τον απλό δεσμό η χωρική διάταξη των ατόμων αλλάζει συνεχώς και σε κάθε θέση των ατόμων αντιστοιχεί ορισμένη τιμή της δυναμικής ενέργειας των μορίων. Σε κάθε θέση των ατόμων αντιστοιχεί μια ορισμένη της δυναμικής ενέργειας του μορίου και μεταξύ αυτών κάποια αντιστοιχεί στηνελαχίστη και κάποια άλλη στην μεγίστη.  (εικόνα: δυναμική ενέργεια μορίου αιθανίου κατά την περιστροφή της ομάδας μεθυλίου και 1,2 διχλωροαιθάνιο)
(εικόνα: δυναμική ενέργεια μορίου αιθανίου κατά την περιστροφή της ομάδας μεθυλίου και 1,2 διχλωροαιθάνιο) 
.jpg)