Δήμητρα Σπανού
ΑΤΟΜΟ: Η ΜΙΚΡΟΤΕΡΗ ΠΟΣΟΤΗΤΑ ΤΟΥ ΥΛΙΚΟΥ ΚΟΣΜΟΥ ΜΑΣ
ΤΙ ΕΙΝΑΙ ΥΛΗ ΚΑΙ ΑΠΟ ΤΙ ΑΠΟΤΕΛΕΙΤΑΙ
Τι είναι Ύλη; Υλή θεωρείται οτιδήποτε έχει μάζα και καταλαμβάνει χώρο.
Πόσο μικρή μπορεί να είναι η Ύλη του κόσμου μας; ή Πόσο μπορούμε να διαιρέσουμε την Ύλη και να εξακολουθεί να έχει τις ιδιότητές της
Το μικρότερο κομμάτι ύλης που μπορεί να υπάρχει στον κόσμο μας, είναι το Άτομο του οποίου οι διαστάσεις είναι της τάξης των νανόμετρων δηλαδή 10-9m
Ήδη από τον 19ο αιώνα επανήλθε η αρχαία θεωρία του Λεύκιππου και του Δημόκριτου, που διατυπώθηκε εκ νέου από τον J. Dalton με τον όρο Ατομική θεωρία. Συμφωνα με αυτήν, ο υλικός κόσμος μέσα στον οποίο ζούμε αποτελείται από εξαιρειτικά μικρά σωματίδια, τα άτομα , Τα άτομα που αποτελούν την Ύλη δεν είναι όλα ίδια.
Στη φύση είχαν βρεθεί 98 διαφορετικά από αυτά ως το 2013, όμως άλλα 16 ακόμα μεγαλύτερα, από το Αινστάνιο έως το Κοπέρνικον και επιπλέον το Τενέσιο και το Οργκανέσιο, είχαν κατασκευαστεί σε ειδικά εργαστήριαώστε ο αριθμός τους έφτασε τα 114 . Εως σήμερα έχουν κατασκευαστεί και κάποια άλλα κι αν δεν κάνω λάθος ο αριθμός αυτός έφτασε το 118.
Ο Άγγλος Φυσικός J J Thompson που τιμήθηκε με βραβείο Nobel Φυσικής το 1906, σε πειράματα ηλεκτρικών εκκενώσεων σε λυχνίες, ανακάλυψε ένα είδος μικρότερου σωματιδίου στο άτομο που μάλιστα έφερε αρνητικό ηλεκτρικό φορτίο: το ηλεκτρόνιο
Στις αρχές του 20ου αιώνα επίσης, ο Ernest Rutherford έδειξε ότι στο εσωτερικό κάθε ατόμου υπάρχει μια περιοχή που συγκεντρώνει σχεδόν όλη την μάζα του ατόμου, με διαστάσεις της τάξης 10-14 m η οποία ονομάστηκε πυρήνας και είναι θετικά φορτισμένος.
Σήμερα οι μαθητές από τις μικρές ήδη τάξεις, γνωρίζουν για την περιστροφή των αρνητικά φορτισμένων ηλεκτρονίων γύρω από τον πυρήνα. Όσο όμως κι αν φαίνεται παράξενο, αυτό το τόσο απλό μοντέλο δεν μπορεί πλέον να εξηγηθεί με την κλασσική μηχανική, εφόσον αυτή η διαρκής περιστροφή κινούμενων φορτίων θα είχε σαν αποτέλεσμα την απώλεια ενέργειας που θα πρέπει να εκπέμπεται σαν ηλεκτρομαγνητισμός (θεωρία του Mawell). 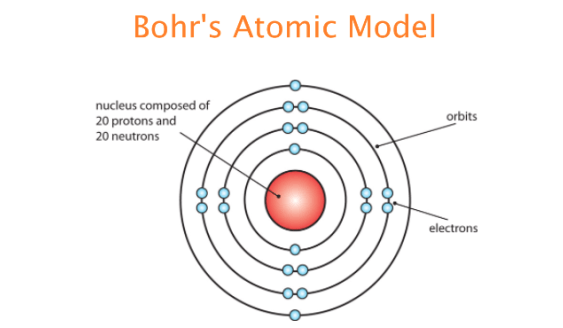
Δανός φυσικός Neils Bohr φτάνει αρκτά κοντά στην εξήγηση των τροχαιών των ηλεκτρονίων εισάγοντας την ιδέα των ευνοϊκών τροχαιών.
. Το φαινόμενο της κίνησης των ηλεκτρονίων σε τροχιακά γύρω από τον πυρήνα ερμηνεύεται πλήρως με την κβαντομηχανική, όταν ο πρίγκιπας Loui de Broglie εισήγαγε την θεωρία της "Κυματικής Φύσης της Ύλης", με την οποία διατυπώνεται η ύπαρξη υλικών κυμάτων, που παρουσιάζουν φαινόμενα ανάλογα με των ενεργειακών κυμάτων (συμβολή , μεγίστα κ.λ.π.)
ΣΥΓΚΕΝΤΡΩΣΗ ΤΗΣ ΥΛΗΣ .
ΔΗΜΙΟΥΡΓΙΑ ΜΟΡΙΩΝ, ΙΟΝΤΙΚΩΝ ΠΛΕΓΜΑΤΩΝ, ΔΙΑΜΟΡΙΑΚΩΝ ΔΕΣΜΩΝ
Όμως, δεν είναι σκόπιμο να συνεχίσω την περιγραφή των φαινομένων αυτών με την κβαντομηχανική και έτσι βλέπουμε τώρα την σχέση των ατόμων και τις δυνάμεις που συμβαίνουν μεταξύ τους, ώστε να αναπτύξουν ύλη με πιο κλασσικές περιγραφές και θεωρίες
Τα άτομα στον υλικό κόσμο, ακολουθώντας νόμους της Φυσικής, προχωρούν σε καταστάσεις ενεργειακά συμφερότερες, ώστε τοποθετούνται το ένα σε σχέση με το άλλο σε θέσεις όπου, το συνολικό ηλεκτρικό δυναμικό που προκύπτει από τα ηλεκτρικά φορτία τους, να είναι το ελάχιστο δυνατό.
Εν συντομία, δημιουργούνται συνδέσεις μεταξύ τους και οι σύνδεση αυτές περιλαμβάνουν: την σύνδεση ατόμων με μοριακούς δεσμούς, την σύνδεση ιόντων με ιοντικούς ή μεταλλικούς δεσμούς και την σύνδεση μορίων ή άλλων πολυατομικών συγκροτημάτων με δεσμούς Υδρογόνου ή δεσμούς Van der Waals
Συγκεκριμένα, οi συνδέσεις αυτές είναι
Ο Ιοντικός δεσμός,(ατόμων, συγκροτηματων ατόμων)
Συνδέει μεταξύ τους φορτισμένα άτομα ή ομάδες ατόμων που δεν μεταβάλλονται στις χημικές αντιδράσεις
 Σε άτομα με λίγα μονήρη ηλεκτρόνια στον ηλεκτρονιακό φλοιό τους, (συνήθως 1η, 2η, 3η ομάδα του περιοδικού πίνακα), ορισμένα εξωτερικά ηλεκτρόνιά τους, λόγω και των απώσεων από τα άλλα κοντινά τους ηλεκτρόνια, δέχονται συνολικά μικρή έλξη από τον πυρήνα τους και έτσι προσχωρούν σε κάποιον άλλον πυρήνα ενός γειτονικού ατόμου (συνήθως 15η, 16η, 17η, ομάδα στον περιοδικό πίνακα) που χρειάζεται για να συμπληρώσει την εξω στοιβάδα του .
Σε άτομα με λίγα μονήρη ηλεκτρόνια στον ηλεκτρονιακό φλοιό τους, (συνήθως 1η, 2η, 3η ομάδα του περιοδικού πίνακα), ορισμένα εξωτερικά ηλεκτρόνιά τους, λόγω και των απώσεων από τα άλλα κοντινά τους ηλεκτρόνια, δέχονται συνολικά μικρή έλξη από τον πυρήνα τους και έτσι προσχωρούν σε κάποιον άλλον πυρήνα ενός γειτονικού ατόμου (συνήθως 15η, 16η, 17η, ομάδα στον περιοδικό πίνακα) που χρειάζεται για να συμπληρώσει την εξω στοιβάδα του .
 Αυτό που προκύπτει είναι, δημιουργία φορτισμένων άτομων που λέγονται ιόντα και αναπτύσσονται μεταξύ τους ηλεκτρικές δυνάμεις ηλεκτροστατικής φύσης.
Αυτό που προκύπτει είναι, δημιουργία φορτισμένων άτομων που λέγονται ιόντα και αναπτύσσονται μεταξύ τους ηλεκτρικές δυνάμεις ηλεκτροστατικής φύσης.
Οι Ιοντικοί δεσμοί δημιουργούν ένα τεράστιο ιοντικό πλέγμα πολλών τέτοιων ιόντων και δίνουν την δομή που συναντάμε και στους ιοντικούς κρυστάλλους όπως οι κρύσταλλοι του χλωριούχου νατρίου, (NaCl)
 Ο Μεταλλικός δεσμός (πολλών ατόμων και ηλεκτρονίων)
Ο Μεταλλικός δεσμός (πολλών ατόμων και ηλεκτρονίων)
Προκύπτει σε μεταλλικά στοιχεία, όταν εξωτερικά ηλεκτρόνια ατόμων τους αποσπώνται από την εξω στοιβάδα τους και δημιουργώντας συνολικά ένα ηλεκτρονιακό νέφος, περιφέρονται ανάμεσα σε μεταλλικά ιόντα που απομένουν, πράγμα που αναπτύσσει ισχυρές δυνάμεις ηλεκτρικές , μεταξύ τους. Η δομή αυτή στο σύνολό της δίνει την εικόνα ενός γιγαντιαίου μορίου και είναι γνωστό σαν μεταλλικό πλέγμα
Ομοιοπολικός δεσμός (ατόμων)
Δημιουργεί μόρια
Συμβαίνει όταν δύο γειτονικά άτομα συνεισφέρουν από ένα ηλεκτρόνιο και με δυνάμεις ηλεκτρομαγνητικής φύσης, δημιουργείται ένα κοινό ζευγάρι ηλεκτρονίων (ανήκει και στα δύο άτομα) το οποίο δημιουργεί σύνδεση μεταξύ τους γιατί έλκεται και από τους δύο πυρήνες
ώστε σχηματίζονται τα μόρια.
 Ομοιοπολικός μη Πολικό Δεσμός
Ομοιοπολικός μη Πολικό Δεσμός
Δημιουργεί μόρια Χημικών Στοιχείων
Εάν οι δύο πυρήνες ανήκουν στο ίδιο στοιχείο, η έλξη δεν διαφέρει και το κοινό ζευγάρι των ηλεκτρονίων μοιράζεται εξ ίσου και παραμένει ίσους χρόνους σε κάθε έναν από τους δύο πυρήνες.
Δημιουργούνται Μόρια από ίδια άτομα στα Χημικά Στοιχεία
Παράδειγμα ο ομοιοπολικός δεσμός που συνδέει τα άτομα ενός διατομικού μορίου όπως Η2, Cl2 κ.α.
 (2).jpg) Ομοιοπολικός πολικός δεσμός (ατόμων)
Ομοιοπολικός πολικός δεσμός (ατόμων)
Δημιουργεί μόρια
Αντίθετα εάν οι πυρήνες είναι διαφορετικοί, η έλξη του το ηλεκτρικού φορτίου του ζεύγους κατανέμεται διαφορετικά και δημιουργείται πόλωση στα άτομα που συνδέονται με αυτόν όπως στον δεσμό μεταξύ Ατόμοων Υδρογόνου και Χλωρίου στο μόριο του Υδροχλωρίου (HCl) , στο μόριο του νερού (Η2Ο) που υπάρχει πολικότητα και στους δύο δεσμούς μεταξύ του Οξυγόνου και των δύο Υδρογόνων του μορίου κ.λ.π. ανάμεσα
Μόρια από άτομα διαφορετικά σε συνδυασμούς δημιουργούνται στις Χημικές Ενώσεις.
Η διάταξη των ατόμων στα μόρια καθορίζεται από τους χημικούς δεσμούς. Παράδειγμα, σε ένα μόριο με τα ίδια ακριβώς άτομα kai χημικό τύπο (C2H6O) μπορεί να προκύπτους δύο ή και περισσότερες χημικές ενώσεις ανάλογα με την διάταξη αυτή. Συντακτικοί τύποι: ο διμεθυλαιθέρας CH3OCH3 και η αιθανόλη CH3CH2OH Αυτές οι ενώσεις λέγονται Ισομερείς μεταξύ τους Ισομέρια υπάρχει ακομα και στην διάταξη στον χώρο (Στερεοισομέρεια)
 Δεσμός Υδρογόνου (μορίων)
Δεσμός Υδρογόνου (μορίων)
Δυναμώνει τις συνδέσεις ορισμένων μορίων μεταξύ τους
Έλξη μεταξύ μορίων ομοίων
 ή διαφορετικών μορίων ένα τουλάχιστος έχει υδρογόνο
ή διαφορετικών μορίων ένα τουλάχιστος έχει υδρογόνο
Είναι διαμοριακός δεσμός, μεταξύ διαφορετικών μορίων που έχουν τις προϋποθέσεις γι αυτό
Ο δεσμός Υδρογόνου είναι ασθενέστερος των ομοιοπολικού και ιοντικού αλλά ο ισχυρότερος από τους διαμοριακούς
Είναι έλξη που αναπτύσσεται μεταξύ μορίων που περιέχουν Υδρογόνο και είναι πολικά . Τα μόρια αυτά, εκτός από το υδρογόνα (που πολώνεται θετικά), πρέπει να έχουν ένα από τα χημικά στοιχεία Οξυγόνο, Άζωτο, ή Φθόριο με ασύζευκτο ζεύγος ηλεκτρονίων που πολώνεται αρνητικά, ώστε το γειτονικό μόριο να προβάλει την πλευρά αυτήν προς το Υδρογόνο. Ο δεσμός Υδρογόνου έχει μεγάλη βιολογική σημασία (διπλή έλικα DNA)
 Δεσμοί Van der Waals (μορίων, ατόμων)
Δεσμοί Van der Waals (μορίων, ατόμων)
Σχηματισμός στερεας, υγρής ή αέρις ύλης
Είναι γενικός όρος που περιλαμβάνει δεσμούς κυρίως μεταξύ ουδέτερων ή διπόλων μορίων με άλλα μόρια ή ελεύθερα άτομα για τον σχηματισμό στερεας, υγρής ή αέριας ύλης για τα φυσικά αέρια ανάλογα με τον τύπο των δεσμών αυτών και την θερμοκρασία. (ο δεσμός Υδρογόνου συμπεριλαμβάνεται)
Είναι διαφορετικές από τους ομοιοπολικούς και ιοντικούς δεσμούς επειδή προκύπτουν από τις διακυμάνσεις στην πυκνότητα του φορτίου των σωματιδίων εφόσον τα ηλεκτρόνιά τους βρίσκονται πάντα σε κίνηση έτσι ώστε περιοχές με προσκαιρη την συγκέντρωση αρνητικού φορτίου, ασκούν ελκτικές δυνάμεις σε άλλες με συγκέντρωση θετικού φορτίου ή απωστικές σε αυτές που συγκεντρώνουν στην δεδομένη στιγμή επίσης αρνητικό. Οι δυνάμεις αυτές μπορούν να δράσουν και επαγωγικά, πολώνοντας ένα ουδέτερο μόριο ή ακόμα και άτομο. Δηλαδή έχουμε:
Δεσμούς μεταξύ μορίων με μόνιμη διπόλική ροπή λόγω ανομοιόμορφης κατανομής φορτίου ονομάζονται Δυνάμεις Kisom kai εδώ εντάσονται και οι δεσμοί Υδρογόνου
Δεσμούς μεταξύ διπόλων μορίων και άλλων που γίνονται δίπολα από επαγωγή, και ονομάζονται Δυνάμεις Debye
Στις δυνάμεις διασποράς μεταξύ οποιουδήποτε ζεύγους μορίων λόγω στιγμιαίας πόλωσης και λέγονται Δυνάμεις London
Οι δυνάμεις Van der waals δρουν μόνο σε μικρές αποστάσεις μικρότερες από 6nm.
Όταν οι αποστάσεις γίνουν μικρότερες από 4 nm αυτές οι δυνάμεις γίνονται απωστικές
 Oi δυνάμεις Van der Waals, παίζουν σημαντικό ρόλο σε αλληλεπιράσεις στρωμάτων στρωματοποιημένων κρυστάλλων (πχ γραφίτης). στην κίνηση των εντόμων, στους δακτυλίους του Κρόνου, στην επεξεργασία του γονιδιώματος εφόσον κάποια αμινοξέα δεσμεύονται στο νουκλεοτίδιο με δυνάμεις Van der Walls
Oi δυνάμεις Van der Waals, παίζουν σημαντικό ρόλο σε αλληλεπιράσεις στρωμάτων στρωματοποιημένων κρυστάλλων (πχ γραφίτης). στην κίνηση των εντόμων, στους δακτυλίους του Κρόνου, στην επεξεργασία του γονιδιώματος εφόσον κάποια αμινοξέα δεσμεύονται στο νουκλεοτίδιο με δυνάμεις Van der Walls
στις εσωτερικές δυνάμεις συνοχής των ευγενών αερίων κ.α.
ΚΑΤΑΣΤΑΣΗ ΣΥΣΣΩΜΑΤΩΣΗΣ ΤΗΣ ΥΛΗΣ
Η φυσική κατάσταση της ϋλης είναι αποτέλεσμα της αλληλοεπιδράσεων των μορίων της (ή άλλων δομικών σωματιδίων της όπως μονοατομικών ή πολυατομικών ιόντων κ.α. ) Ανάλογα με την Θερμοκρασία και την Πίεση, τα δομικά σωματίδια οδηγούνται σε κατάσταση συσσωμάτωσης που εξαρτώνται από τον συνδυασμό της Θερμοκρασίας και της Πίεσης.
Οι τρεις καταστάσεις "συσσωμάτωσης" των σωματιδίων μιας ουσίας είναι η αέρια, η υγρή και η στερεά κατάσταση
Συνοδεύονται με πολύ μεγάλες αλλαγές- άλματα σε φυσικές παραμέτρους τους όπως η εντροπία, η ελεύθερη ενέργεια, η πυκνότητα κ.α.
Κάθε μια από τις καταστάσεις αυτές περιγράφεται με ιδιαίτερες φυσικοχημικές ιδιότητες όπως δομή , ιξώδες, συμπεριφορά ως προς το φως, την θερμότητα τον ηλεκτρισμό. Σε ορισμένες περιπτώσεις κάποιες από αυτές, συγχέονται μεταξύ δύο φάσεων και έτσι οι ορισμοί των τριών καταστάσεων δεν είναι πάντα αυστηροί.
Το κυριότερο σημάδι της μετάβασης από την μια κατάσταση συσσωμάτωσης σε άλλη είναι είναι η απαίτηση ενός ενεργειακού ποσού για να επιτευχθεί αυτή η μετάβαση. Όπως η θερμότητα εξάτμισης, η θερμότητα τήξης κ.λ.π.
Η ισορρόπηση μιας ουσίας στην αέρια, υγρή ή στερεά κατάσταση καθορίζεται από την "μέση ελεύθερη διαδρομή των μορίων" δηλαδή το μέσο μήκος της ευθύγραμης τροχαιάς τους μεταξύ δύο συγκρούσεων και είναι μεγάλη στα αέρια, μικρή στα υγρά και μηδενική στα στερεά. Εξαρτάται δε από την Θερμοκρασία και την Πίεση.
Οι στερεές και οι υγρές ουσίες χαρακτηρίζονται σαν καταστάσεις συμπυκνωμένης ύλης. Τα υγρά η ύλη είναι λίγο πιο "αραιή" όχι όμως πολύ αφού, η μέση απόσταση των δομικών σωματιδίων μιας υγρής ουσίας δεν είναι κατά πολύ μεγαλύτερη από αυτή μιας στερεής .
ακόμη
Οι υγρές και οι αέριες ουσίες ονομάζονται ρευστά γιατί δεν έχουν μόνιμο σχήμα αλλά αυτό εξαρτάται από το δοχείο που περιέχονται

Δήμητρα Σπανού
ΠΗΓΕΣ
https://ebooks.edu.gr/ebooks/v/html/8547/2756/Chimeia_A-Lykeiou_html-empl/index2_3.html
https://esperia.iesl.forth.gr/~kafesaki/Modern-Physics/lectures/modern_physics7.html
ΦΥΣΙΚΗ ΧΗΜΕΙΑ ΚΑΤΑΣΤΑΣΕΩΝ ΤΗΣ ΥΛΗΣ ΚΑΙ ΘΕΡΜΟΔΥΝΑΜΙΚΗ Δ Α ΓΙΑΝΝΑΚΟΥΔΑΚΗ
https://de.wikipedia.org/wiki/Materie_(Physik)
https://studref.com/411017/tovarovedenie/steklyannye_tovary
https://www.wikiwand.com/el/%CE%94%CE%B5%CF%83%CE%BC%CF%8C%CF%82_%CF%85%CE%B4%CF%81%CE%BF%CE%B3%CF%8C%CE%BD%CE%BF%CF%85
Астронет > Закрученное ядро Крабовидной туманности (astronet.ru)
Ιοντικός (Ετεροπολικός) δεσμός (slideshare.net)
Силы Ван-дер-Ваальса - Wikiwand
Τι είναι οι δυνάμεις van der Waals; (greelane.com)
Κατάσταση συνάθροισης - Βικιπαίδεια (wikipedia.org)Κατάσταση συνάθροισης - Βικιπαίδεια (wikipedia.org)
PPT - Covalent Bonds PowerPoint Presentation, free download - ID:6647183 (slideserve.com)
Τύποι χημικών δεσμών (chemie.schule)
ο γυαλί είναι μια κατάσταση μιας άμορφης ουσίας που λαμβάνεται όταν ένα υπερψυγμένο υγρό στερεοποιείται. Το γυαλί είναι μη ισορροπία σε σχέση με την κρυσταλλική κατάσταση, η οποία μπορεί να πραγματοποιηθεί με την ίδια σύνθεση και υπό τις ίδιες εξωτερικές συνθήκες. Η διαφορά από τους κρυστάλλους είναι η απουσία περιοδικότητας της δομής.
Η τεχνολογική διαδικασία παραγωγής προϊόντων γυαλιού χωρίζεται στα ακόλουθα κύρια στάδια: προετοιμασία τήξης γυαλιού, τήξη τήγματος γυαλιού, παραγωγή προϊόντων, ανόπτηση, επεξεργασία και διακόσμηση προϊόντων γυαλιού.
Πρώτες ύλες για την παραγωγή γυαλιού. Τα υλικά για την παραγωγή γυαλιού χωρίζονται σε βασικά και βοηθητικά.

