Δήμητρα Σπανού, χημικός, συνταξιούχος καθηγήτρια Μέσης Εκπαίδευσης από 30-6-2025
Η ΙΖΗΜΑΤΟΓΕΝΕΣΗ ΣΑΝ ΤΡΠΟΠΟΣ ΑΠΟΜΟΝΩΣΗΣ ΕΝΟΣ ΣΥΣΤΑΤΙΚΟΥ ΑΠΟ ΤΟ ΔΙΑΛΥΜΑ
Η απομόνωση ενός συστατικού που βρίσκεται σε διάλυμα είτε υπό μορφή ιόντος ή χημικής ένωσης είναι ο σχηματισμός στερεού ιζήματος μέσω
μιας χημικής αντίδρασης, που συμβαίνει όταν προστίθενται το κατάληλο αντιδραστήριο (κατακρημνηστής)
Ο κατακρημνηστής αντιδρά επιλεκτικά με ένα από τα συστατικά της εν διαλύσει ουσίας (ιόντα) για να σχηματίσει την λιγότερο διαλυτή ένωση.
Η απομόνωση ενός συστατικού που βρίσκεται σε διάλυμα είτε υπό μορφή ιόντος ή χημικής ένωσης είναι ο σχηματισμός στερεού ιζήματος μέσω
μιας χημικής αντίδρασης, που συμβαίνει όταν προστίθενται το κατάληλο αντιδραστήριο (κατακρημνηστής)
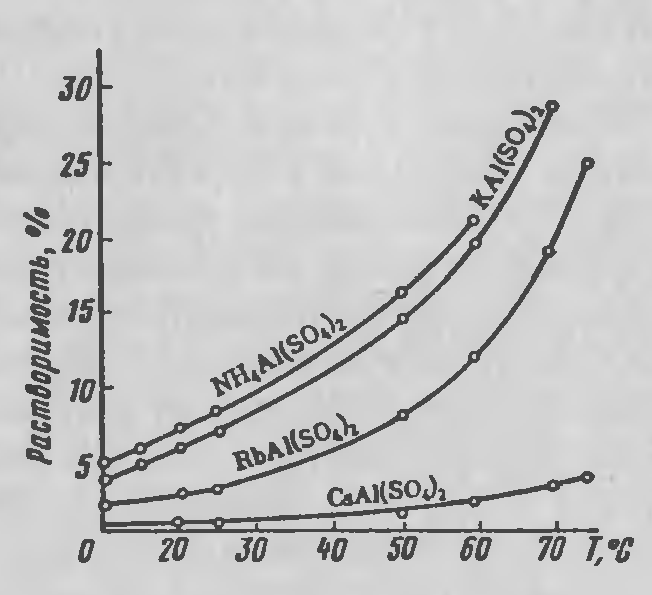
- Γνωρίζουμε ότι μια ουσία από ένα διάλυμα πέφτει σαν ίζημα όταν το διάλυμα υπέρκορεστεί στην ουσία αυτή και αυτό εξαρτάται επίσης και από την θερμοκρασία στο διάλυμα
Μετά την εισαγωγή του κατακρημνηστή οι χημικές αντιδράσεις που θα προκαλέσουν την Ιζηματοποίηση είναι πιθανόν να προκαλέσουν αλλαγή της θερμοκρασία. Αυτό παράλληλα μπορεί να επιρρεάσει την διαλυτότητα της ουσίας που απομονώνουμε και επομένως και την ιζηματοποίησή της. Συνήθως η αύξηση της θερμοκρασίας αυξάνει την διαλυτότητα κ ,
Παράδειγμα:H διαλυτότητα του υδροξειδίου του αργιλίου αυξάνει με την θερμοκρασία
|
στους | 20°C και 25ο | Ksp=3×10-34 και 1.3×10-33 |
- Η καθίζηση διευκολύνεται με την πυρήνωση του διαλύματος δηλαδή την τοποθέτηση ενός στερεού σώματος (εναπόθεση) που θα δημιουργήσει μια επιφάνεια διεπαφής και θα διευκολύνει την απόθεση της ουσίας που καθιζάνει. Διαφορετικά δημιουργούνται υπέρκορα διαλύματα και η καθίζηση αργεί να ξεκινήσει
- Καθίζηση μπορεί επίσης να μεταβληθεί με την εισαγωγή κάποιας ουσίας στο διάλυμα που μπορεί να αυξήσει την διαλυτότητα του ήδη εναποτιθέμενου ιζήματος ώστε αυτό να βρεθεί ξανά εν διαλύσει,
Αναφέρεται το ίζημα του επαμφοτερίζοντος υδροξειδίου του ψευδαργύρου το οποίο διαλύεται σε περίσσεια αλκαλίων αλλά και σε διάλυμα υδροξείδιου του αμμωνίου λόγω σχηματισμού σύμπλοκου ιόντος αμμωνίας - ψευδαργύρου, γιατί έτσι μειώνεται η συγκέντρωση ιόντων ψευδαργύρου στο διάλυμα που δεσμεύονται στο σύμπλοκο.
Αντίστοιχη αύξηση της διαλυτότητας παρατηρείται σε βρωμιούχο άργυρο όταν εισάγεται διάλυμα αλνμμωνίας.Τότε σχηματίζεται ευδιάλυτο σύμπλοκο ιόν αμμωνιακού αργύρου [Ag(NH3)2]+ και η διαλυτότητα του βρωμιούχου αργύρου αυξάνεται.
Το φαινόμενο της αύξησης της διαλυτότητας λόγω δημιουργίας ευδιάλυτου συνθετου ιόντος μπορεί να συμβεί σε ακόρεστο, κορεσμένο ή υπέρκορο διάλυμα.
εάν με κάποιον τρόπο μειώσουμε την περιεκτικότητα του διαλύτη στο διάλυμα με την προσθήκη ενός αντιδιαλύτη που μειώνειι την περιεκτικότητα σε νερό του επιθυμητού προϊόντος
|
Πολύ δυσδιάλυτες ετεροπολικές ενώσεις (δυσδιάλυτα τα άλατα και υδροξείδια) με πολύ μικρές Ksp
|
|||||||
|
στους | 20°C 25ο C |
Ksp=3×10-34· Κsp=1.3×10-33 | ||||
| Υδροξείδιο του αργιλίου, τριένυδρο | Αl(ΟΗ)3 | στους 20°C | Ksp=4×10-13 |
| Φωσφορικό αργίλιο | AlPO4 στους | 25°C | Ksp=9.84×10-21; 6.3×10-19 |
| Ο θειούχος Χαλκός CuS |
|
| Θειώδες βάριο | BaSO3 | στους 25°C | Ksp=5.0×10-10 |
| Υδροξείδιο του Μαγνησίου Mg(OH)2 στους 25οC | Ksp=7.1 × 10 -12 |
| Χλωριούχος μόλυβδος | PbCl2 | στους 25.2°C | Ksp=1.0×10-4 |
| Φθοριούχο κάδμιο | CDF2 | στους 25°C | Ksp=6.44×10-3 |
Θειϊκό ασβέστιο CaSO 4 στους 25ο C Ksp= 2,4 × 10 -5
|
.jpg)

