Δήμητρα Σπανού Χημικός, Καθηγήτρια Δ/θμιας Εκπ/σης, συνταξιοδοτούμενη από το 1ο Γυμνάσιο Δάφνης
υπό κατασκευή
Συγκεντρώσεις διαλυμάτων
Η μοριακή συγκέντρωση ενός διαλύματος Μ molarity
Είναι ο αριθμός των γραμμομορίων moles της διαλυμένης ουσίας σε ένα λίτρο lt διαλύματος. Εάν η συγκεντρωση είναι 1Μ τότε έχω 1 mol διαλυμένης ουσίας στο λίτρο του διαλύματος. Εάν όμως το δούμε διαφορετικό η ποσότητα αυτή αντιστοιχεί σε έναν πολύ μεγάλο αριθμό σωματιδίων της διαλυμένης ουσίας. 6,022 . 1023 δομικών σωματιδίων.
Η μοριακή μάζα του ενός γραμμομορίου μιας ουσίας προσδιορίζεται από το μοριακό βάρος της ουσίας αυτής που το υπολογίζουμε αθροίζοντας τα ατομικά βάρη των στοιχείων.
Η διαλυμένη ουσία όταν αραιώνεται είναι ηλεκτρολύτης αποδεικνύεται πως η ηλεκτροστατική αλληλεπίδραση μεταξύ των ιόντων του μειώνεται και συμβαίνει καταστροφή των ιοντικών ατμοσφαιρών τους που το έργο τους είναι ισοδύναμο με το έργο της άπειρης αραίωσής τους.
Χρησιμεύει σαν μέτρο της διαφοράς μεταξύ μιας πραγματικής και μιας ιδανικής λύσης
Απεριόριστα αραιωμένα διαλύματα
Απεριόριστα αραιωμένα διαλύματα θεωρούνται αυτά που έχουν αραιωθεί από 10-10 έως και 10-20 αλλά και 10-25 mol/lt
Αυτό μπορεί να γίνει μετά από διαδοχικές αραιώσεις επιλεγμένων όγκων
Σε ένα απεριόριστα αραιωμένο διάλυμα, το μοριακό κλάσμα του διαλύτη τείνει στην μονάδα (όλον) ενώ το μοριακό κλάσμα της διαλυμένης ουσίας στο μηδέν, χωρίς όμως το διάλυμα αυτό να θεωρηθεί σαν καθαρός διαλύτης.
Λόγω της μεγάλης αραίωσης τα σωματίδια (μόρια) του διαλύτη δεν αλληλοεπιδρούν το ένα με το άλλο.
Αντίθετα υπάρχουν αλληλεπιδράσεις μεταξύ των μορίων της διαλυμένης ουσίας αλλά μόνο μεταξύ μορίων διαλύτη και μεταξύ των μορίων της διαλυμένης και άπειρα αραιωμένης ουσίας με τα μόρια του διαλύτη.
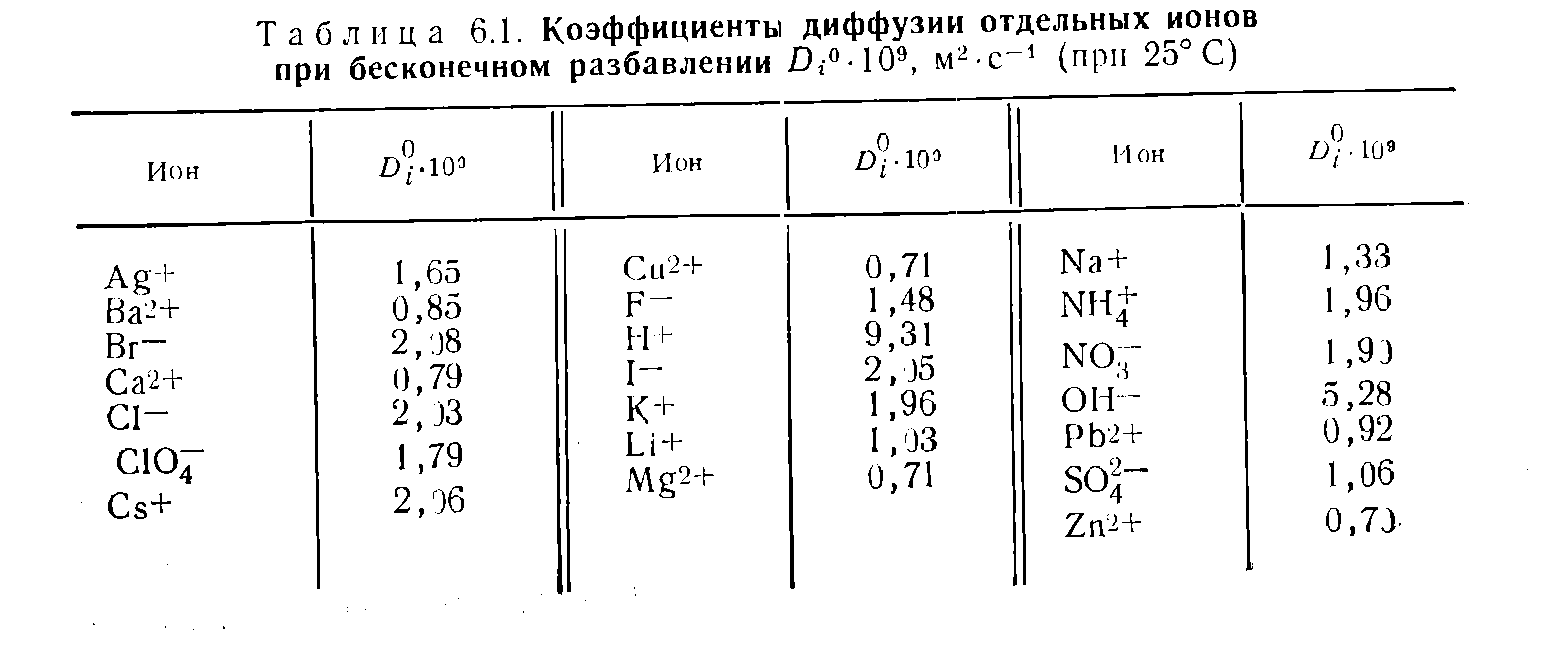
Οι αλληλεπιδράσεις μορίων καθορίζονται από ένα μέγεθος που λέγεται χημικό δυναμικό το οποίο είναι η ενέργεια που απορροφάται ή που απελευθερώνεται και εξαρτάται από τον αριθμό των σωματιδίων
ΠΗΓΕΣ
Συντελεστής διάχυσης μεμονωμένων ιόντων - Εγχειρίδιο Χημικού 21
Разбавление - раствор - электролит - Большая Энциклопедия Нефти и Газа, статья, страница 2
