Δήμητρα Σπανού, χημικός, μόνιμη καθηγήτρια 1ου Γυμνασίου Δάφνης (έως 30-06-2025)
υπό κατασκευή
συνέχεια,
από το κεφάλαιο,
Η ΔΙΕΎΘΥΝΣΗ ΚΑΙ Η ΕΝΕΡΓΕΙΑ ΤΩΝ ΜΟΡΙΑΚΩΝ ΤΡΟΧΙΑΚΩΝ
Η ΔΙΕΥΘΥΝΣΗ ΤΩΝ ΜΟΡΙΑΚΩΝ ΤΡΟΧΙΑΚΩΝ
Από την σύνδεση των ατομικών ή υβριδοποιημένων ατομικών τροχιακών από τη γεωμετρία της επικάλυψης προκύπτουν οι σ και π ομοιοπολικοί δεσμοί
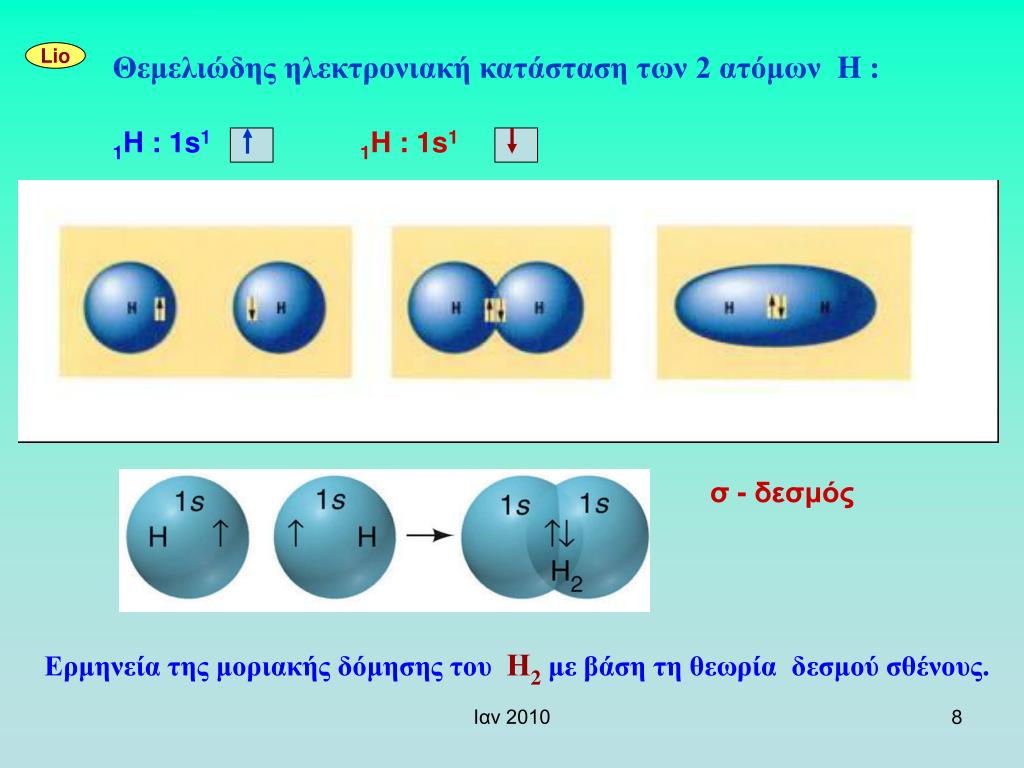 ο σ ομοιπολικός δεσμός
ο σ ομοιπολικός δεσμός
Είναι η αλληλοεπικάλυψη των ατομικών τροχιακών ή υβριδικών ατομικών τροχιακών μεταξύ δύο ατόμων ( ομοιπολικός δεσμός) που γίνεται κατά μήκος του άξονα που συνδέει τους πυρήνες των δύο ατόμων
Συμβαίνει μεταξύ δύο s τροχιακών (s-s επικάλυψη) ο δεσμός χαρακτηρίζεται σ δεσμός και έχει σφαιρική συμμετρία και είναι ο ισχυρότερος όλων των ομοιοπολικών
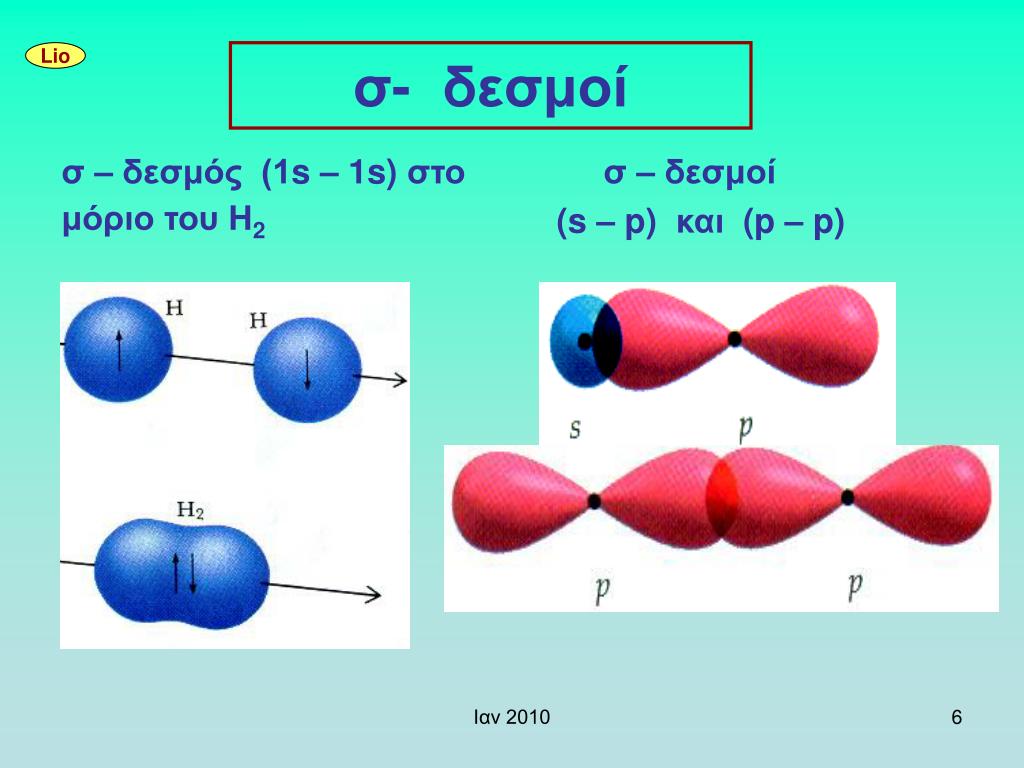 Όμως έχουμε κι άλλους σ δεσμούς (αρκεί οι επικάλυψεις να γίνονται κατά μήκος του άξονα που συνδέει τους πυρήνες των δύο ατόμων) όπως
Όμως έχουμε κι άλλους σ δεσμούς (αρκεί οι επικάλυψεις να γίνονται κατά μήκος του άξονα που συνδέει τους πυρήνες των δύο ατόμων) όπως
είναι ο ομοιπολικός δεσμός συμβαίνει μεταξύ ενός s τροχιακών και ενός p (s-p επικάλυψη) και ο ομοιπολικός %20Hybridization.webp) δεσμός συμβαίνει μεταξύ δύο p τροχιακών (p-p επικάλυψη)
δεσμός συμβαίνει μεταξύ δύο p τροχιακών (p-p επικάλυψη)
Ενίοτε, αντί των συνήθων μοριακών τροχιακών έχουμε τα
Μοριακά υβριδικά τροχιακά Τα μοριακά υβριδικά προκύπτουν από ανάμειξη ατομικών τροχιακών και σχηματισμό νέων υβριδικών μοριακών τροχιακών
Ο σ δεσμός γίνεται και μεταξύ υβριδικών και ατομικών τροχιακών όπως στο μεθάνιο (s-sp3 επικάλυψη)
ακόμα και μεταξύ υβριδικού- υβριδικού
ο π ομοιοπολικός δεσμός
 Είναι η αλληλοεπικάλυψη των μεταξύ p-p τροχιακών ατομικών τροχιακών μεταξύ δύο ατόμων ( ομοιπολικός δεσμός) στον οποίο επικαλύπτονται πλευρικά οι δύο λοβοί σε ένα επίπεδο κάθετο στο επίπεδο του μορίου. Τα δύο αυτά ατομικά τροχιακά των δύο ατόμων είναι παράλληλα . Οι δεσμοί π δεν συμβαίνουν σε s τροχιακά
Είναι η αλληλοεπικάλυψη των μεταξύ p-p τροχιακών ατομικών τροχιακών μεταξύ δύο ατόμων ( ομοιπολικός δεσμός) στον οποίο επικαλύπτονται πλευρικά οι δύο λοβοί σε ένα επίπεδο κάθετο στο επίπεδο του μορίου. Τα δύο αυτά ατομικά τροχιακά των δύο ατόμων είναι παράλληλα . Οι δεσμοί π δεν συμβαίνουν σε s τροχιακά
Ετσι, οι δεσμοί π είναι πιο διάχυτοι σε σχέση με τους σ και τα μοριακά τμήματα που ενώνονται με δεσμούς π δεν μπορούν να περιστραφούν γύρω από τον δεσμό χωρίς την διάσπαση του δεσμού π
Απλοί δεσμοί μεταξύ των ατόμων του μορίου είναι δεσμοί σ. 
Εάν έχουμε διπλό δεσμό ή τριπλό δεσμό, ο σ δεσμός προηγείται και ο επόμενο δεσμός είναι π. Στο οξυγόνο με συντακτικό τύπο Ο=Ο έχουμε έναν σ και έναν π δεσμό.
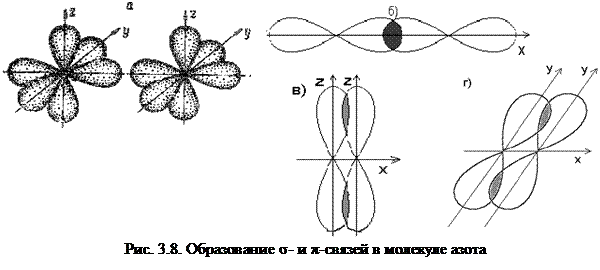 Εάν έχουμε τριπλό δεσμό, ο σ δεσμός προηγείται μετά έρχονται οι δύο π με τα δύο κάθετα δεσμικά επίπεδά τους που περιέχουν τον δεσμικό άξονα
Εάν έχουμε τριπλό δεσμό, ο σ δεσμός προηγείται μετά έρχονται οι δύο π με τα δύο κάθετα δεσμικά επίπεδά τους που περιέχουν τον δεσμικό άξονα
Η ενέργεια του δεσμού είναι η ενέργεια που απαιτείται για να σπάσει ο δεσμός. Η ενέργεια των δεσμών κυμαίνεται από 125-1050 kj/mol
Οι δεσμοί π είναι συνήθως ασθενέσθεροι των δεσμών σ ( η ενέργεια ένός δεσμού π σε μια σύνδεση διπλού δεσμού άνθρακα με άνθρακα, είναι σχεδόν διπλάσια από την ενέργεια του δεσμού σ)
Όμως ο συνδυασμός ενός σ και ενός π δεσμού είναι ο ισχυρότερος από όλους.
και η επικάλυψη των δύο ατομικών τροχιακών του π δεσμού είναι σημαντικά μικρότερη από τον σ δεσμό. Στο αιθάνιο CH3-CH3 ο δεσμός μεταξύ των ανθράκων είναι σ και έχει ενέργεια 348kj/mol.
Η απόσταση των πυρήνων μειώνεται όταν αυξηθούν οι δεσμοί μεταξύ τους. Στο αιθάνιο (CH3-CH3) η απόσταση C-C είναι 154pm στο αιθένιο(CH2-=H2) η απόσταση C=C είναι 134pm, στο αιθίνιο(CH=-CH) η απόσταση αυτή είναι 120pm
Η ΕΝΕΡΓΕΙΑ ΤΩΝ ΜΟΡΙΑΚΩΝ ΤΡΟΧΙΑΚΩΝ
Εντοπισμένες και αποκεντρωμένες συνδέσεις
Κάθε μοριακό τροχιακό έχει συγκεκριμένη ενέργεια, που χαρακτηρίζεται περίπου από το αντίστοιχο δυναμικό ιονισμού.
Ανάλογα με τοην ισχύ του δεσμού , υπάρχουν τριών ειδών μοριακά τροχιακά: Δεσμού ή σύνδεσης που ενισχύουν τον δεσμο, χαλάρωσης που αποσταθεροποιούν τον δεσμό και αδιάφορα που δεν συμμετέχουν σε μοριακό δεσμο. Ένα μόριο είναι σταθερό όταν τα μοριακά τροχιακά σύνδεσης υπερτερούν των μοριακών τροχιακών χαλάρωσης.
 Στο σχήμα διακρίνουμε τα δύο τροχιακά , το ένα ενεργειακά πιο πλεονεκτικό (δεσμικό) και το άλλο ενεργιακά ασύμφορο (αντιδεσμικο ή μη δεσμευτικό). Αυτό οφείλεται στην σχετική θέση των ηλεκτρονίων των τροχιακών όταν ευθυγραμμίζονται με τους πυρήνες τους τα ηλεκτρόνια βρίσκονται σε πλαϊνές ή σε αντιδιαμετρικές θέσεις
Στο σχήμα διακρίνουμε τα δύο τροχιακά , το ένα ενεργειακά πιο πλεονεκτικό (δεσμικό) και το άλλο ενεργιακά ασύμφορο (αντιδεσμικο ή μη δεσμευτικό). Αυτό οφείλεται στην σχετική θέση των ηλεκτρονίων των τροχιακών όταν ευθυγραμμίζονται με τους πυρήνες τους τα ηλεκτρόνια βρίσκονται σε πλαϊνές ή σε αντιδιαμετρικές θέσεις
έχουμε λοιπόν,
Δεσμευτικά μοριακά τροχιακά (SMO) Η ενέργεια του μοριακόυ είναι χαμηλότερη του ατομικού τοχιακού
Μη δεσμευτικά μοριακά τροχιακά (NMO) Η ενέργεια του μοριακόυ είναι ίση με του ατομικού τοχιακού.
Εδώ μπορούν επίσης να τοποθετηθούν ζεύγη μοναχικών ηλεκτρονίων (π ηλεκτρόνια) και μη συζευγμένα ηλεκτρόνια σε ελεύθερες ρίζες
Χαλαρωμένα (απεντοπισμένα)μοριακά τροχιακά (RMO) Η ενέργεια του μοριακόυ είναι υψηλότερη του ατομικού τοχιακού. α τροχιακά αυτά στην μη διεγερμένη κατάσταση είναι κενά. Μπορούν όμως να δεχθούν ηλεκτρόνια κατά τη διάρκεια μιας χημικής αντίδρασης
Ένας ομοιοπολικός δεσμός θεωρείται εντοπισμένος αν το ζεύγος ηλεκτρονίων βρίσκεται στο πεδίο των πυρήνων και δεσμεύει μόνο δύο άτομα
Ο σ ομοιοπολικός δεσμός για παράδειγμα, είναι δεσμός εντοπισμένος
Σε χαλαρωμένα μοριακά τροχιακά, ο δεσμός είναι αποκεντρωμένος ή απεντοπισμένος) και το ζεύγος ηλεκτρονίων είναι διασκορπισμένο μεταξύ πολλών (περισσότερων από δύο) πυρήνων ατόμων (σαν ένα είδος μεταλλικού δεσμού)
Χαλαρωμένα μοριακά τροχιακά
Συζευγμένα συστήματα διασποράς ηλεκτρονίων
Η σύζευξη είναι δυνατή αν τα άτομα που εμπλέκονται σε αυτή την διαδικασία βρίσκονται στο ίδιο επίπεδο
Θεωρητικά, όλοι οι ομοιοπολικοί δεσμοί μπορεί να είναι απεντοπισμένοι
αλλά,
- Απεντοπισμένα ηλεκτρόνια δεν έχουμε σε μόρια δύο ατόμων
- Τα αλκένια με έναν διπλό δεσμό δεν περιλαμβάνονται γιατί ο δεσμός π εδώ είναι εντοπισμένος .
- Τα συζευγμένα συστήματα διασποράς ηλεκτρονίων δημιουργούνται κυρίως σε κάποιες περιπτώσεις μορίων:
Μοριακοί δεσμοί στους οποίους κυρίως συναντάται σύζευξη μπορεί να είναι:
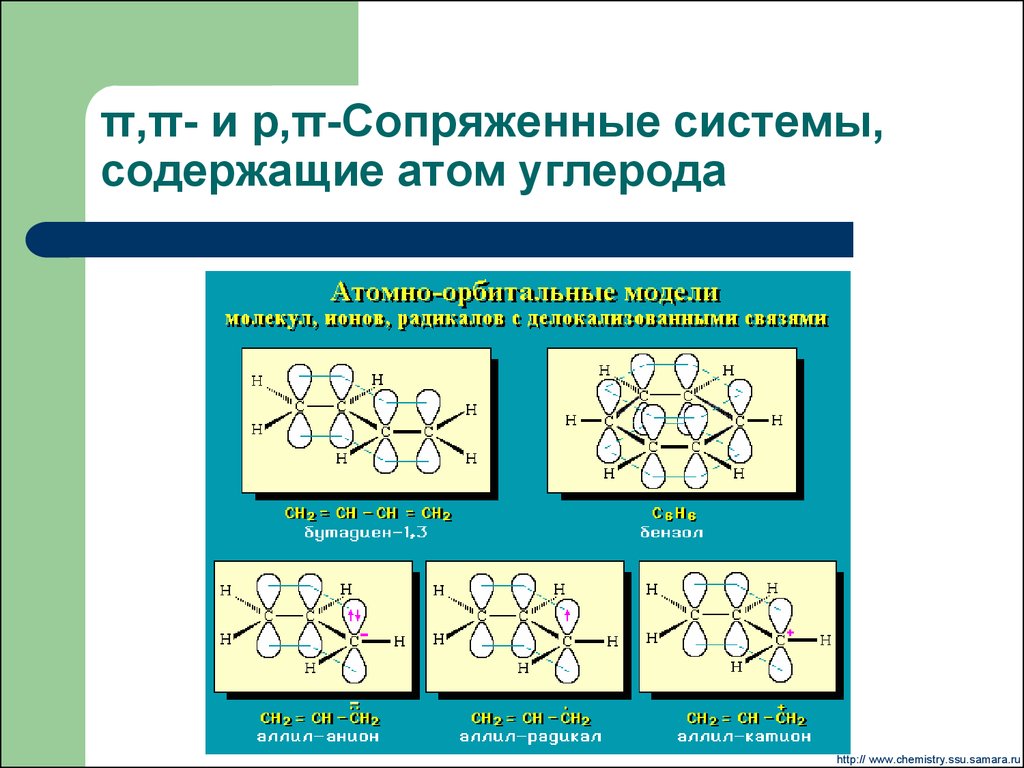
Είναι συστήματα p τροχιακών που συνδέονται με απεντοπισμένα ηλεκτρόνια. Δημιουργούνται από πολλαπλούς δεσμούς, από μεμομωμένα ζεύγη, ρίζες ή ιόντα καρβενίου και καθένας από τους οποίους διαχωρίζεται από απλούς δεσμούς με σύνδεση άκυκλη, κυκλική γραμμική ή μικτή.
Α. Ομοσύνδεση: (Συζυγιακά συστήματα)
Σε μόρια όπου έχουμε συζευγμένους δεσμούς π όπου πολλαπλές συνδέσεις εναλλάσσονται με μονές δεσμών σ
Αυτή είναι η π-π σύνδεση
Δημιουργείται υπέρθεση ενός p τροχιακού σε ένα άλλο p, μέσω ενός δεσμού σ (ή μονού δεσμού) που βρίσκεται ενδιάμεσα.(π.χ. βουταδιένιο1,3, βενζόλιο) .
(CH2=CH—CH=CH2
Β. ( Σε μεγάλα άτομα, σε συζευγμένο σύστημα, μπορεί να συμβάλλουν και d τροχιακά που δεν τα αναφέρουμε στο παρόν ).
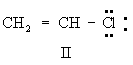
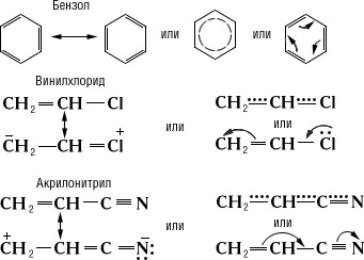
- Γ. Στην περίπτωση όπου πολλαπλοί ή και απλοί δεσμοί, συνδυάζεται με άτομο που έχει ένα μοναχικό ζεύγος ηλεκτρονίων p, π- σύζευξη.
- (π.χ. βινυλιχλωρίδιο και ακρυλονιτρίλιο)
Παρόμοια σύζευξη έχουμε και στο ετεροκυκλικό μόριο του φουράνιου
Σαν επέκταση της συζευγμένη σύνδεση θεωρούμε επίσης την περίπτωση που υπάρχει ή ατομικό κέντρο που έχει ένα ηλεκτρόνιο ή μοναχικό ζεύγος ηλεκτρονίων και ένα κέντρο με κενό τροχιακό
Σύζευξη σε κλειστα συστήματα
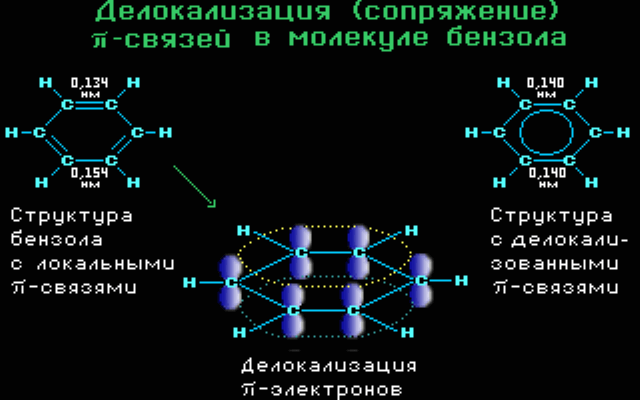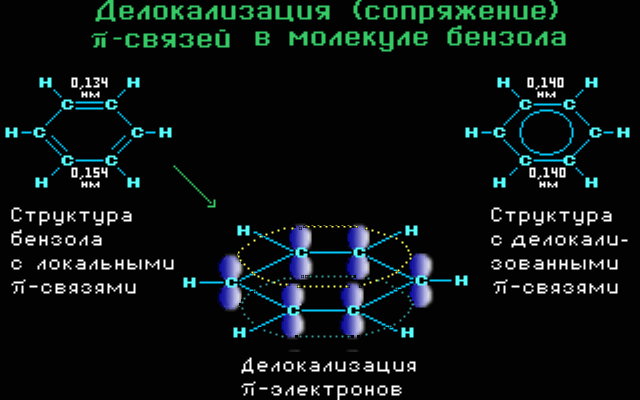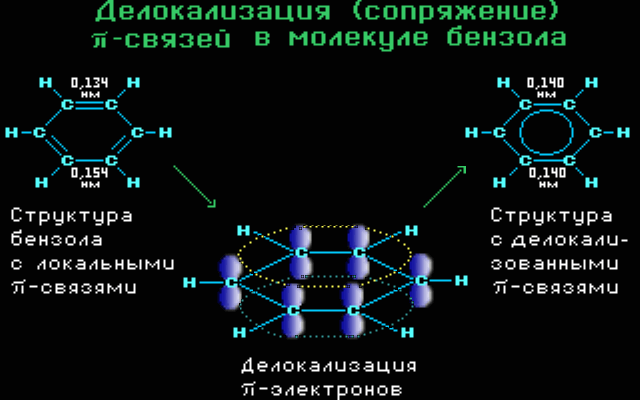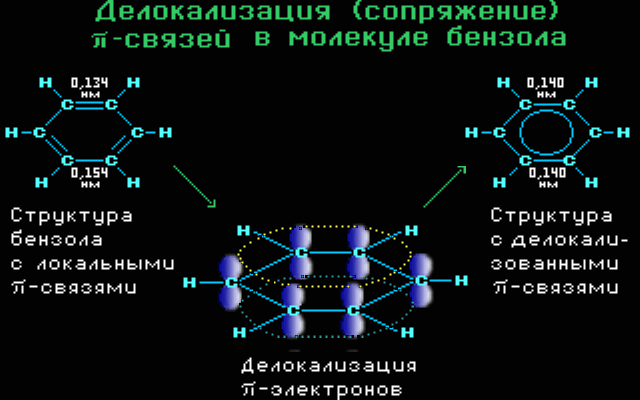
Ομοκυκλικός δακτύλιος Σύζευξη π-π. Το βενζόλιο είναι ένα χαρακτηριστικό παράδειγμα όπου μέσα στον εξαμελή δακτύλιο (με τρεις απλούς και τρεις διπλούς δεσμούς) όμως , με υβριδοποιησμένα τα s και p τροχιακά όπου κάθε p τροχιακό επικαλύπτεται με δύο γειτονικά και το μη εντοπισμένο σύστημα π κατανέμεται ομοιόμορφα σε όλο το κυκλικό σύστημα.
ΙΔΙΟΤΗΤΕΣ ΣΥΖΕΥΓΜΕΝΩΝ ΣΥΣΤΗΜΑΤΩΝ
Με αυτόν το τρόπο της σύζευξη συνδέσεων, οι συνδέσεις μεταξύ των ατόμων αποκτούν ενδιάμεσες τιμές (ούτε απλές ούτε διπλές) όπως και το μήκος των δεσμών παίρνει τιμές ανάμεσα σε απλό και διπλό
Τα συζευγμένα συστήματα έχουν ιδιαίτερες ιδιότητες μπορούν να μειώσουν την ενέργεια ενός μορίου και να αυξήσουν την σταθερότητά του
Η εξασφάλιση αυτής της επιπλέον θερμοδυναμικής σταθερότητα, που μπορεί να εκτιμηθεί σαν η διαφορά μεταξύ ενώσεων με συζευγμένους διπλούς δεσμούς και ενώσεων με απομονωμένους διπλούς δεσμούς. Η σταθερότητα αυξάνεται με το μήκος του συζυγούς κυκλώματος όπως για παράδειγμα στα καροτενοειδή
ΠΗΓΕΣ
Θεωρητικές έννοιες στην οργανική χημεία
Χημικοί δεσμοί Τύποι χημικών δεσμών και τα χαρακτηριστικά τους
Σύζευξη. Συζευγμένα Συστήματα Ανοικτού Κυκλώματος
индуктивный эффект -I в гликопротеинах
Θεωρητικές έννοιες στην οργανική χημεία
- Читайте подробнее на FB.ru: https://fb.ru/article/547240/2023-induktivnyiy-i-mezomernyiy-effektyi-opisanie-i-primeryi
Αποκεντρωμένες συνδέσεις π. Σύζευξη
ΣΧΗΜΑΤΙΣΜΟΣ ΜΟΡΙΑΚΩΝ ΤΡΟΧΙΑΚΩΝ, ΔΕΣΜΙΚΑ ΚΑΙ ΑΝΤΙΔΕΣΜΙΚΑ ΤΡΟΧΙΑΚΑ ΜΟΡΙΑΚΟΥ ΔΕΣΜΟΥ
