Δήμητρα Σπανού, Χημικός, συνταξιούχος καθηγήτρια Β/θμιας Εκπαίδευσης
Σε Μέταλλα ευκολότερη η απομάκρυνση
Na (g) - e-→ Na+ (g) με ΔΗ = 496 Kcal/mole,
ενώ σε άλλα δυσκολότερη (αμέταλλα)
F (g) - e-→ F+ (g) με ΔΗ = 1680 Kcal/mole,
στα ευγενή αέρια είναι ακόμα πιο δύσκολο
Ne (g) - e-→ Ne+ (g) με ΔΗ = 2080 Kcal/mole,
- ΜΕΤΑΤΡΟΠΗ ΑΤΟΜΩΝ ΣΕ ΚΑΤΙΟΝΤΑ
- Η μετατροπή ατόμων σε ιόντα και η δημιουργία ιοντικού δεσμού εξαρτάται
- Από το μέγεθος της Ενέργειας Ιοντισμού ( I E) που είναι η Ελεύθερη Ενθαλπία Ιονισμού που περιγράφει την ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα ουδέτερο άτομο ή μερικώς ιονισμένο. Για ηλεκτρόνια δίνεται σε eV/ άτομο A + I E → A + + e - .
- Σημείωση: Άτομα με ένα ηλεκτρόνιο στο κελύφους σθένους και συμπληρωμένες τις εσωτερικές στοιβάδες, είναι τα περισσότερο δραστικά, επειδή έχουν μικρή ενέργεια πρώτου ιοντισμού, έτσι, μπορούν σχετικά εύκολα να απομακρύνουν το μοναδικό ηλεκτρόνιο της εξωτερικής τους στοιβάδας και να μείνουν με τις εσωτερικές που είναι συμπληρωμένες που σημαίνει ότι μετατρέπονται σε θετικά ιόντα
-
Αλλά εκφράζεται και σε kj/mol και είναι αντίθετη σε πρόσημο με την ενέργεια ιονισμού
Cl (a) + e-→ Cl– (a) +83,2 kcal/mol με ΔΗ = –83,32 Kcal/mole,
-
Ο (a) + e- → Ο– (a) + 53,8 kcal/mol με ΔΗ = –53,8 Kcal/mole
Γενικά υπάρχει σχέση μεταξύ της ενέργειας ιονισμού και της ηλεκτροσυγγένειας. Όσο η ενέργεια ιονισμού αυξάνεται (και η δυσκολία να απομακρυνθεί ηλεκτρόνιο) συνήθως αυξάνεται και η ηλεκτροσυγγένεια (ικανότητα να δεσμεύει ηλεκτρ;oνεια το άτομο)
Αυτό όμως δεν είναι απόλυτο γιατί υπάρχουν διαφορές στους παράγοντες που επιρρεάζουν την ενέργεια ιοντισμού και την ηλεκτροσυγγένεια
Στον πίνακα που ακολουθεί βλέπουμε τις τιμές της ηλεκτροσυγγένειας ε σε eV / atomo. Έχουμε και θετικές τιμές αλλά και αρνητικές τιμές που σημαίνει ότι η αντίδραση πρόσληψης ηλεκτρονίου από το άτομο είναι ενδοενεργειακή ή εξωενεργειακή δηλαδή το αρνητικό ιόν είναι σταθερότερο του ατόμου (Cl, O, Br, Si...) και αντίστροφα το αρνητικό ιόν είναι ασταθέστερο του ατόμου (Ηe, N, Mg, Ca, Cr,...)
Ενέργεια συγγένειας ορισμένων ατόμων για ηλεκτρόνιο, eV
| Элемент | ε | Элемент | ε | Элемент | ε |
|---|---|---|---|---|---|
| H | 0,7542 | Na | 0,548 | K | 0,502 |
| He | -0,54 | Mg | -0,4 | Ca | -0,3 |
| Li | 0,618 | Al | 0,441 | Sc | 0,14 |
| Be | -0,5 | Si | 1,385 | Ti | -0,40 |
| B | 0,277 | P | 0,747 | V | -0,94 |
| C | 1,263 | S | 2,077 | Cr | -0,98 |
| N | -0,07 | Cl | 3,617 | Mn | 1,07 |
| О | 1,461 | Br | 3,365 | Fe | -0,58 |
| F | 3,399 | I | 3,06 | Co | -0,94 |
| Ne | -1,2(2) | Ni | -1,28 | ||
| Cu | -1,80 |
Η ηλεκτραρνητικότητα εξάγονται λαμβάνοντας υπ όψην την ενέργεια ιοντισμού των ατόμων, την συγγένειά τους με το ηλεκτρόνιο, την μέση τιμή της ενέργειας δέσμευσης των εξωτερικών ηλεκτρονίων κ.α.
Υπάρχουν και άλλες κλίμακες ηλεκτραρνητικότητας που χρησιμοποιούν την μονάδα ενέργειας (eV) για την ηλεκτραρνητικότητα
ΣΥΝΔΕΣΗ ΑΤΟΜΩΝ ΠΡΟΣ ΔΗΜΙΟΥΡΓΙΑ ΧΗΜΙΚΩΝ ΕΝΩΣΕΩΝ ΜΕ ΒΑΣΗ ΤΗΝ ΗΛΕΚΤΡΑΡΝΗΤΙΚΟΤΗΤΑ ΤΟΥΣ
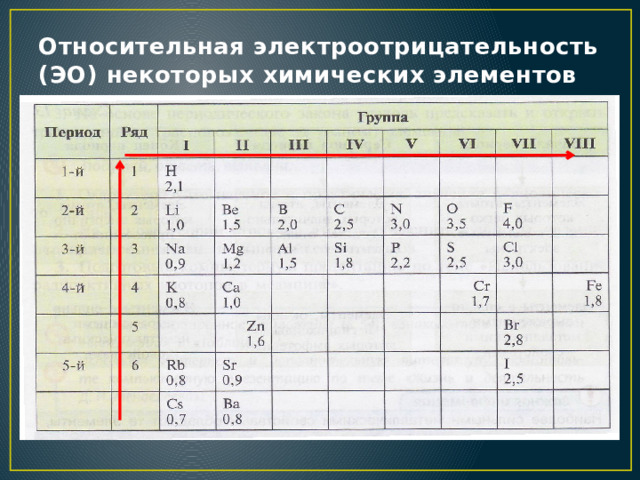 Αν δυο χημικά στοιχεία βρεθούν σε κατάλληλες συνθήκες και υπάρχει διαφορά ηλεκτραρνητικότητας είναι πιθανόν αυτό με την μικρότερη ηλεκτραρνητικότητα να απομακρύνει ή να αποβάλλει ηλεκτρόνια τα οποία θα προσλάβει το άλλο με την μεγαλύτερη σχετικά ηλεκτραρνητικότητα
Αν δυο χημικά στοιχεία βρεθούν σε κατάλληλες συνθήκες και υπάρχει διαφορά ηλεκτραρνητικότητας είναι πιθανόν αυτό με την μικρότερη ηλεκτραρνητικότητα να απομακρύνει ή να αποβάλλει ηλεκτρόνια τα οποία θα προσλάβει το άλλο με την μεγαλύτερη σχετικά ηλεκτραρνητικότητα
Αν δυο άτομα διαφορετικής ηλεκτραρνητικότητας συνδεθούν με ομοιοπολικό δεσμό έχουμε ομοιοπολικό πολικό όπου τα ηλεκτρόνια έλκονται περισσότερο από το ηλεκτραρνητικότερο άτομο και το μόριο δημιουργεί δίπολο
εδώ έχουμε το υδρογόνο με ηλεκτραρνητικότητα 2,1 και το χλώριο με ηλεκτραρνητικότητα 3,0. Τα ηλεκτρόνια έλκονται προς το μέρος του χλωρίου. Το μόριο υδροχλώριο παρουσιάζει διπολική ροπή
H2(g) + Cl2 (g) --> 2 Η+δCl-δ ( +δ και -δ δείχνει την πυκνότητα φορτίου σε κάθε άτομο)
Όσο μεγαλύτερη η διαφορά ηλεκτραρνητικότητα τόσο πολικότερος είναι ο ομοιοπολικός δεσμός
Σε πολύ μεγάλη διαφορά στην ηλεκτραρνητικότητα όπως το χλώριο και το νάτριο, έχουμε πλήρη απομάκρυνση του ηλεκτρονίου, και σχηματισμό ιόντων και ιοντικού δεσμού
Ηλεκτραρνητικότητα Νατρίου είναι 0,9 και χλωρίου είναι 3,0
Na(s) + Cl (g) --> Na+ + Cl-
Αν δυο άτομα ιδιας ηλεκτραρνητικότητας συνδεθούν με ομοιοπολικό δεσμό έχουμ ομοιοπολικό μη πολικό δεσμοε ο
όπως η δημιουργία μορίου υδρογόνου από δύο άτομα υδρογόνου Η-Η > Η2
ΠΗΓΕΣ
Ενέργεια ιονισμού και συγγένεια ηλεκτρονίων - τι είναι: ορισμός, χαρακτηριστικά και τύποι
