Δήμητρα Σπανού χημικός καθηγήτρια α Βθμιας Εκπαίδευσης οργσνικη θέση στο 1ο γυμν. Δάφνης εως 30-6-2025
ΕΙΣΑΓΩΓΗ ΚΑΙ ΑΙΤΙΟΛΟΓΗΣΗ ΑΥΤΟΥ ΤΟΥ ΤΟΜΕΑ
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΕΣΩΤΕΡΙΚΗ ΔΟΜΗ ΥΛΙΚΩΝ ΣΩΜΑΤΩΝ.
Εδώ προσπαθώ να ανασύρω τα χημικά στοιχεία μαζύ με τις φυσικές , χημικές και φυσικοχημικές ιδιότητές τους συσχετίζοντας αυτές, στα μέτρα του δυνατού, με την εσωτερική τους δομή και σαν υλικά σώματα (παράδειγμα οι διαφορές μεταξύ άμορφων και κρυσταλλικών σωμάτων) αλλά και να δώσω την ιδέα για το πως και πόσο οι ιδιότητες αυτές επιρρεάζονται από τις εξωτερικές συνθήκες (παράδειγμα οι αλλοτροπικές μορφές σχετικά με την θερμοκρασία ή οι δυνάμεις που έχουν άλλα αποτελέσματα στα απλάυλικά σώματα ανάλογα με την εσωτερική δομή τους) κ.λ.π.
Λεπτομερέστερη και πιο εξειδικευμένη πληροφορία για τα χαρακτηριστικά και τις φυσικές ιδιότητες των χημικών στοιχείων υπάρχουν σε περιοχές του διαδικτύου όπως για παράδειγμα στην σελίδα
υπό κατασκευή
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ

Λεπτομερέστερη και πιο εξειδικευμένη πληροφορία για τα χαρακτηριστικά και τις φυσικές ιδιότητες των χημικών στοιχείων υπάρχουν σε περιοχές του διαδικτύου όπως για παράδειγμα στην σελίδα
Η ΚΡΥΣΤΑΛΛΙΚΗ ΔΟΜΗ ΤΩΝ ΜΕΤΑΛΛΩΝ
- Οι δομικές μονάδες ενός στερεού μπορεί να διατάσσονται τυχαία (άμορφο) ή σε συγκεκριμένες θέσεις στον χώρο με μια διατεταγμένη διάταξη ώστε να σχηματίζουν μια επαναλαμβανόμενη τρισδιάστατη δομή (κρυσταλλική)
 Το κρυσταλλικό πλέγμα είναι γεωμετρικό μοντέλο που χαρακτηρίζεται από τις αποστάσεις μεταξυ γειτονικών μορίων ενός κρυσταλλικού στερεού, τον τύπο, στερεομετρία του πλέγματος (κυβικό, εξαγωνικό κ.α.) και την πυκνότητα συσκευασίας (αριθμός συντονισμού) και την ύπαρξη ή μη ατελειών λόγω προσμίξεων
Το κρυσταλλικό πλέγμα είναι γεωμετρικό μοντέλο που χαρακτηρίζεται από τις αποστάσεις μεταξυ γειτονικών μορίων ενός κρυσταλλικού στερεού, τον τύπο, στερεομετρία του πλέγματος (κυβικό, εξαγωνικό κ.α.) και την πυκνότητα συσκευασίας (αριθμός συντονισμού) και την ύπαρξη ή μη ατελειών λόγω προσμίξεων
Τύποι Κρυσταλλικών δομών μετάλλων
Οι κρυσταλλικές δομές των πλεγμάτων μπορεί να είναι μοριακές, ατομικές, ιοντικές και μεταλλικές ανάλογα με το είδος των δομικών του μονάδων
- Όλα τα μέταλλα έχουν κρυσταλλική δομή, δηλαδή οργανώνονται σε κανονικά κρυσταλλικά πλέγματα. Τα πλέγματα αυτά αποτελούνται από στοιχειώδεις μονάδες που λέγονται "κύτταρα" ή κυψελίδες που βρίσκονται σε συγκεκριμένες αποστάσεις μεταξύ τους και συγκροτούνται από ιόντα μετάλλων που τοποθετούνται σε συγκεκριμένες θέσεις ώστε να σχηματίζεται ένα γεωμετρικό σχήμα στον χώρο. Οι θέσεις των μεταλλικών ιόντων καθορίζονται από την αλληλεπίδραση από τα ηλεκτρόνια σθένους.
- Η δομή του πλέγματος μπορεί να είναι ιοντική (σε πολλές περιπτώσεις αλκαλικών μετάλλων) ή
- Μεταλλική όπου δημιουργείται το μεταλλικό πλέγμα που αποτελεί έναν ιδιαίτερο τύπο κρυσταλλικής δομής που λέγεται μεταλλική δομή και η οποία παίρνει διάφορες μορφές

Συγκεκριμένα, για το κρυσταλλικό μεταλλικό πλέγμα ( που είναι διαφόρων τύπων), αυτό αποτελείται από θετικά μεταλλικα ιόντα στους κόμβους του και μεταξύ αυτών υπάρχουν τα ηλεκτρόνια σθένους των μετάλλων τα οποία ξεφεύγουν από την ασθενού έλξη με τον πυρήνα και κινουνται ανάμεσα στα θετικά ιόντα (ηλεκτρόνια αγωγιμότητας).
- Βέβαια υπάρχουν και τα ημιμέταλλα όπου δημιουργούναι δεσμοί ομοιοπολικοί . Έτσι,
Οι δυνάμεις που συγκρατούν τα άτομα των μετάλλων στο πλέγμα καθορίζονται από τις απωστικές δυνάμεις και τις ελκτικές είναι: ιοντικής φύσης μεταλλικής φύσεως και ομοιοπολικής
- Η κρυσταλλική δομή επιρρεάζει την φυσική συμπεριφορά και τις χημικές ιδιότητες των ατόμων
Σε αυτήν την συγκεκριμένη οργάνωση των ατόμων σε μεταλλικά πλέγματα οφείλεται η ηλεκτρική και θερμική αγωγιμότητα
Από τον τύπο του πλέγματος, εξαρτάται η ολκιμότητα και ελατότητά τους . Ακόμα επιρρεάζεται τις μαγνητικές τους ικανότητες αλλά και η ικανότητά τους να αντιδρούν με άλλες ουσίες.
ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΜΕΤΑΛΛΙΚΩΝ ΠΛΕΓΜΑΤΑ
1. Δομή του μεταλλικού πλέγματος: Το γεωμετρικό σχήμα της κυψελίδας
Οι κύριοι τύποι δομής του μεταλλικού πλέγματος είναι η κυβική, η εξαγωνική και η τετραγωνική
Στην κυβική δομή έχουμε την βάση της στοιχειώδους δομής (κύτταρο) οκτώ άτομα να σχηματίζουν έναν κύβο . Διακρίνουμε:
κυβική δομή με επίκεντρο τον όγκο (BCC) στην οποία το άτομο του κύβου βρίσκεται στο κέντρο του άλλου κύβου (Mo, V, Mn, Cr, αFe, ,Κ, Να..) O κύβος περιλαμβάνει εννέα άτομα. Η διατομική απόσταση είναι περίπου 0,414nm. Χαρακτηρίζεται από υψηλό βαθμό πλαστικότητας, ολκιμότητα, σκληρότητα, αντοχή στην παραμόρφωση

και την προσωποκεντρική κυβική δομή (GCC) όπου το άτομο βρίσκεται στο κέντρο του κυττάρου και στο κέντρο κάθε όψης του (Al, Cu, Pb, Ni, Au...) Ο κύβος του πλέγματος περιλαμβάνει 14 άτομα. Οκτώ στις κορυφές του κύβου και έξη στις πλευρές του.
Η διατομική απόσταση είναι περίπου 0,356nm
Αυτός ο τύπος χαρακτηρίζεται από Λάμψη, χρώματα, ελαφρότητα, αντοχή στη διάβρωση, δύναμη, υψηλή πλαστικότητα, ολκιμότητα, καλή αγωγιμότητα
Την εξαγωγική δομή έχουμε τα πυκνότερο από τα γνωστά πλέγματα
το εξαγωνικό πυκνά συσκευασμέο (GPU) είναι ένα εξαγωνικό πρίσμα με κεντραρισμένες βάσεις και μεταξύ τους υπάρχουν τρία ακόμα άτομα (Mg, Zn, Bi ...) Η διατομική απόσταση είναι περίπου 0,260nm
Το πρίσμα περιλαμβάνει 17 άτομα Χαρακτηρίζεται από υψηλή αντοχή, υψηλή πυκνότητα, ισχυρή ασημένια λάμψη.
η προσωποκεντρική εξαγωνική δομή είναι ένα εξαγωνικό πρίσμα με 14 άτομα.
Ανάλογα με την δομή του πλέγματος αλλάζουν μηχανικά και θερμικά χαρακτηριστικά. Το σχήμα του μεταλλικού πλέγματος επιρρεάζει τα κελύφη των ηλεκτρονιων των ατόμων επιρρεάζοντας την ελευθερία της κίνησης των εξωτερικών ηλεκτρονίων πράγμα που συμβάλει στις ηλεκτρικές και μαγνητικές ιδιότητες
2. Πυκνότητα συσκευασίας DVN.
Η επιθυμία των ιόντων να πλησιάσουν όσο είναι δυνατόν το ένα κοντά στο άλλο καθορίζει την πυκνότητα συσκευασίας του πλέγματος σε διάφορους τύπους πλεγμάτων
Στην πραγματικότητα εξάγεται αν θεωρήσουμε τον αριθμό των ατόμων ανά στοιχειώδες κύτταρο .
Υπολογίζεται από το ποιλίκο του συνολικού όγκου προς τον όγκο της μονάδας όγκου
Η αύξηση της πυκνότητας συσκευασίας οδηγεί στην αύξηση των ατόμων που βρίσκονται στην μονάδα του όγκου και τελικά στην αύξηση της πυκνότητας του υλικού. Η κοντινότερη απόσταση των ηλεκτρονίων του μεταλλικού δεσμού ευνοεί την ευκολότερη κίνηση των ηλεκτρονίων και συνεπώς διευκολύνει την ηλεκτρική και θερμική αγωγιμότητα.
Ευνοεί επίσης η κοντινότερη διατομική απόσταση την ισχύ των διατομικών δεσμών
Παράδειγμα ο χαλκός (πυκνότητα 8,94 kgr/m3) Δομή κυβική προσωποκεντρική, θερμική αγωγιμότητα 401w(νΚ)και το αργίλιο ( Πυκνότητα 2,7kgr/m3) Δομή κυβική προσωποκεντρική, θερμική αγωγιμότητα 237W/mK
Αντίθετα το τιτάνιο με χαμηλή πυκνότητα συσκευασίας όπως το τιτάνιο, έχουν χαμηλότερη πυκνότητα αλλά εξακολουθούν να έχουν αντοχή στη διάβρωση
Στην κυβική με επίκεντρο το πρόσωπο η πυκνότητα συσκευασίας είναι 4 Στην κυβική με επίκεντρο τον όγκο η πυκνότητα συσκευασίας είναι 2 . Ένα άτομο για την κορυφή και ένα στο κέντρο. Η πυκνότητα συσκευασίας σε εξαγωνικό πυκνής συσκευασίας είναι 6
3.Η απόσταση μεταξύ των κυψελίδων
Ακόμα σημασία στην κρυσταλλική δομή έχει η απόσταση μεταξύ των κυψελίδων που διαφοροποιεί τις κρυσταλλικές δομές. Αξίζει να αναφερθεί η εξαγωνική πυκνή συσκευασία ατόμων (GPUA) που συναντάμε σε μέταλλα όπως ζιρκόνιο, τιτάνιο κ.α.)
4. Η παράμετρος πλέγματος (απόσταση μεταξύ γειτονικών ιόντων) ή
Είναι η απόσταση ατόμων κατά μήκος της άκρης της κυψελίδας (διατομική απόσταση). Μετριούνται σε Angstroms.
Στο κυβικό πλέγμα (όγκου και προσωποκεντρικό) η απόσταση αυτή είναι μια (ίδια και στις τρεις κατευθύνσεις) και ορίζονται με το γράμμα a.
5. Περίοδος του μοναδιαίου κελιου κρυσταλλικού πλέγματος
Έναι η απόσταση μεταξύ δύο γειτονικών επιπέδων σε έναν κρύσταλλο.
Οι παράμετροι του εξαγωνικού πυκνά συσκευασμένου είναι δύο, a και c όπου a μεταξύ των ατόμων της βάσης εξαγώνου και c η απόσταση μεταξύ των βάσεων.
Οι παράμετροι των μεταλλικών πλεγμάτων κυμαίνονται από 0,2 έως 0,7 nm
6. η ίοντική και ατομική ακτίνα των
6. ο αριθμός των ατόμων ανά κυψελίδα
7. ο αριθμός συντονισμού Kp
( των γειτονικών ατόμων που περιβάλλουν κάθε άτομο του πλέγματος)
Αριθμός συντονισμού, είναι ο αριθμός των γειτονικών ατόμων σε κάθε άτομο του πλέγματος. Στην κυβική δομή με επίκεντρο τον όγκο είναι 8 ενώ στην κυβική με επίκεντρο το πρόσωπο είναι 12.
ΔΟΜΗ ΣΤΕΡΕΑΣ ΚΑΤΑΣΤΑΣΗΣ ΣΕ ΥΠΟΟΜΑΔΕΣ ΤΟΥ ΠΕΡΙΟΔΙΚΟΥ ΠΙΝΑΚΑ
1. Δομή στερεάς κατάστασης σε μέταλλα της ΙΑ ομάδας (αλκαλιμέταλλα)
Σε αλκαλικά μέταλλα έχουμε κυρίως ιοντικούς δεσμούς στις κυψελίδες
Η ζώνη σθένους ενός μονοσθενούς μετάλλου όπως τα Αλκάλι που είναι η ns1 και είναι μερικώς κατελημένη με 1 ηλεκτρόνιο. Στο κρυσταλλικό πλέγμα του κατασκευάζεται, κάθε άτομο συνεισφέρει ένα ηλεκτρόνιο σθένους στον χημικό ιοντικό δεσμό.
Έτσι, η ζώνη σθένους γίνεται ενεργειακά πανομοιότυπη με την ζώνη αγωγιμότητας και το μονοσθενές μέταλλο που δημιουργεί κρυστάλλους γίνεται ηλεκτρικά αγώγιμο
Αντί για το ατομικό τροχιακό του ηλεκτρονίου του ατόμου των Αλκαλίων, αυτό επεκτείνεται σε μοριακά τροχιακά που δημιουργείται συγκεκριμένα στην νέα κατάσταση ύπαρξης του ηλεκτρονίου, αυτήν του κρυσταλλικού πλέγματος,
Κάθε μοριακό τροχιακό έχει μια ορισμένη ενέργεια που είναι πολύ κοντά στην ενέργεια ιοντισμού
( Κάθε μοριακό τροχιακό έχει μια ορισμένη ενέργεια, που χαρακτηρίζεται περίπου από ένα αντίστοιχο δυναμικό ιονισμού.)
Ταυτόχρονα δημιουργο και μεταλλικούς δεσμούς, υπάρχει δηλαδή,
συνύπαρξη μεταλλικών και ιοντικών δεσμών στα Αλκάλια
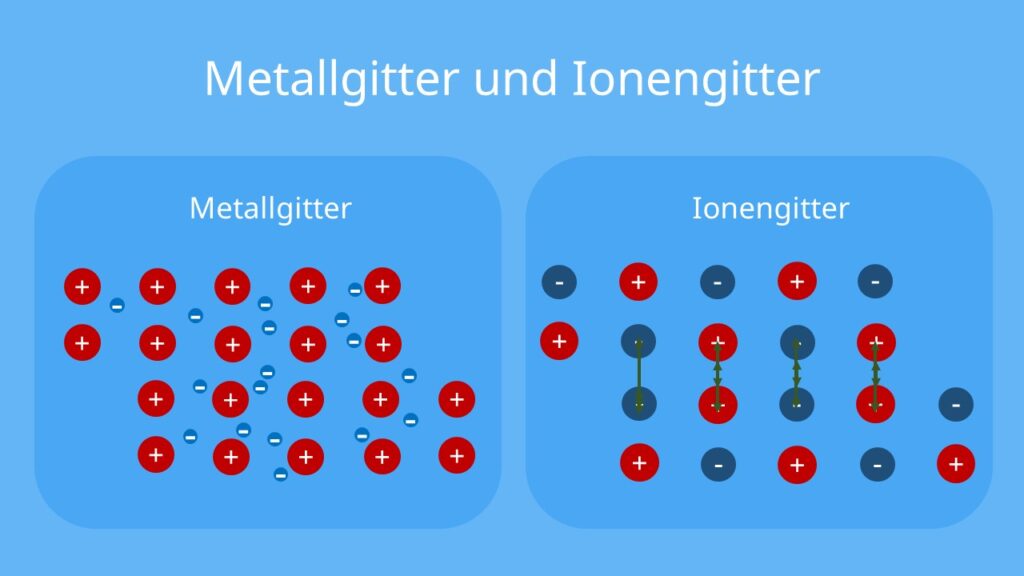 Στα αλκάλια, υπερτερούν οι ιοντικοί δεσμού και για τον λόγο αυτό οι μεταλλικες ιδιότητες φαίνονται μειωμένες (σκληρότητα, πυκνότητα, ολκιμότητα, ελατότητα κ.λ.π.)
Στα αλκάλια, υπερτερούν οι ιοντικοί δεσμού και για τον λόγο αυτό οι μεταλλικες ιδιότητες φαίνονται μειωμένες (σκληρότητα, πυκνότητα, ολκιμότητα, ελατότητα κ.λ.π.)
Όσο μεγαλύτερη είναι η αναλογια μεταλλικών δεσμού στο πλέγμα τόσο εντονότερες είναι οι μεταλλικές ιδιότητες
Όλα τα αλκαλιμέταλλα της 1ης ομάδας του περιοδικού συστήματος, κρυσταλλώνονται σε κυβική δομή επικεντρωμένη
Εξαίρεση, το λίθιο και το Νάτριο σε χαμηλές θερμοκρασίες κρυσταλλώνονται σε εξαγωνική πυκνή συσκευασία κυψελίδων
Αυτό το κρυσταλλικό πλέγμα των μετάλλων της 1ης ομάδας, έχει μεγάλη ενδιάμεση διατομική απόσταση και μικρό αριθμό επιφανειών διεπαφής
και για αυτό παρουσιάζει απαλότητα και παραμορφωσιμότητα
Η ακτίνα των ατόμων ή των ιόντων αυξάνεται από πάνω προς τα κάτω.
Έτσι από πάνω προς τα κάτω μειώνεται η σκληρότητά τους
Μειώνεται επίσης το σημείο τήξης, η ενέργεια ιοντισμού. Η πυκνότητά τους αυξάνεται
| Στοιχείο | Λίθιο | Νάτριο | Κάλιο | Ρουβίδιο | Καίσιο | Φράγκιο |
|---|---|---|---|---|---|---|
| Σημείο τήξης (1013 hPa)[3] | 453,69 Κ (180,54 βαθμοί) |
370,87 Κ (97,72 βαθμοί Κελσίου) |
336,53 Κ (63,38 βαθμοί) |
312,46 Κ (39,31 βαθμοί) |
301,59 Κ (28,44 βαθμοί) |
298 Κ (25 °C) |
| Σημείο βρασμού (1013 hPa)[3] | 1603 Κ (1330 βαθμοί ) |
1163 Κ (890 βαθμοί) |
1047 Κ (774 βαθμοί) |
961,2 Κ (688 βαθμοί) |
963,2 Κ (690 βαθμοί) |
950 Κ (677 °C) |
| Κρίσιμο σημείο[3] |
|
|
|
|
|
|
| Πυκνότητα (20 °C, 1013 hPa)[3] | 0,534 γρ./εκ.3 | 0,968 γρ./εκ.3 | 0,856 γρ./εκ.3 | 1.532 g/cm3 | 1,90 γρ./εκ.3 | 2,48 γρ./εκ3 |
| Σκληρότητα Mohs | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | |
| Αγωγιμότητα | 10,6 · 106 Τ/μ | 21 · 106 Τ/μ | 14,3 · 106 Τ/μ | 7,52 · 106 Τ/μ | 4,76 · 106 Τ/μ | |
| Ατομική μάζα | 6,94 μ. | 22.990 μ. | 39.098 U | 85.468 μ. | 132.905 μ. | 223.020 U |
| Ηλεκτραρνητικότητα | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
| Δομή |  |
 |
 |
 |
 |
 |
| Κρυσταλλικό σύστημα | κυβικό χωροκεντρικό | κυβικό χωροκεντρικό | κυβικό χωροκεντρικό | κυβικό χωροκεντρικό | κυβικό χωροκεντρικό | κυβικό χωροκεντρικό |
Παράδειγμα: 3η περίοδος Το Νάτριο με κυβική κεντρωμένη κρυσταλλική δομή
Η ατομική ακτίνα είναι 190.10-12m
, η ιοντική ακτίνα Na+ είναι 97.10-12m
η ομοιοπολική ακτίνα Na είναι 154.10-12m
σε συνηθισμένη θερμοκρασία, κρυσταλλώνεται σε κυβικό σωματοκεντρικό πλέγμα, a = 4,28 Å.
Πυκνότητα 0,968 g/cm3 (19,7 °C)
2. Δομή στερεάς κατάστασης μέταλλα της ΙΙΑ ομάδας
Εξ αυτών τα Ασβέστιο(Ca), Στρόντιο(Sr) Βάριο(Ba) , Ράδιο(Ra) λέγονται και αλκαλικές γαίες
Τα μέταλλα των της ΙΙΒ ομάδας είναι τα Βηρύλλιο(Be) Μαγνήσιο(Mg), Ασβέστιο(Ca), Στρόντιο(Sr) Βάριο(Ba) , Ράδιο(Ra)
Διατηρούν 2 ηλεκτρόνια στην εξωτερική s υποστοιβάδα τα οποία χάνουν εύκολα και σχηματίζουν δισθενή κατιόντα. Έτσι έχουν υψηλότερα σημεία τήξης και βρασμού από τα αλκάλια που σχηματίζουν μονοσθενή ιόντα.
Στο κρυσταλλικό πλέγμα των μετάλλων αυτών έχουμε μαγνητικούς και ιοντικής φύσης δεσμούς με υπεροχή των ιοντικών,
Εξαίρεση αποτελεί το Βυρήλλιο που σχηματίζει δεσμούς ομοιοπολικόυς
Στα μέταλλα των αλκαλικών γαιών είναι γκρίζες στερεές ουσίες σε θερμοκρασία περιβάλλοντος. Το κρυσταλλικό πλέγμα που αποτελείται από μονάδες που ονομάζονται κυψελίδες ή κύτταρα και σε αυτές τα μέταλλα των αλκαλικών γαιών καταλαμβάνουν ειδικές θέσεις.
Μια κοινή μεταλλική δομή όπως και στα αλκάλια είναι η δομή στην οποία η κυψελίδα έχει ένα τέτοιο άτομο στο κέντρο και τα υπόλοιπα άτομα βρίσκονται σε ειδικες θέσεις στον χώρο. Η δομή είναι κυβική ή εξαγωνική, συνήθης δομή του πλέγματος είναι κυβική
Η ιοντική τους ακτίνα αυξάνεται από πάνω προς τα κάτω στην ομάδα (μεγαλύτερη περίοδος) ενώ στην ατομική ακτίνα αυξάνεται από πάνω έως το Sr και ελλατώνεται στα δύο επόμενα Ba, Ra .
Η πυκνότητα αντίστοιχα ελλατώνεται από πάνω έως και το Ca και αυξάνεται στη συνέχεια (αύξηση και του πυρηνικού φορτίου) έως το τέλος της ομάδας στο Ra.
Και εδώ η κρυσταλλική δομή επιρρεάζει την φυσική συμπεριφορά και τις χημικές ιδιότητες των ατόμων

 1oΠαράδειγμα
1oΠαράδειγμα
3η περίοδος : Το μαγνήσιο με κλειστά συσκευασμένη εξαγωνική δομή
με ατομική μεταλλική ακτίνα 160.10-12m
με ομοιοπολική ακτίνα Ca+2 είναι 147.10-12m
Ακτίνα wan der waals 173 10-12m
με ιοντική ακτίνα Mg+2 είναι 66.10-12m
Το κρυσταλλικό πλέγμα του μαγνήσιου είναι εξαγωνικής πυκνή δομής
παράμετροι πλέγματος μαγνησίου a = 0,32029 nm, c = 0,52000 nm, Z = 2.
παράμετροι πλέγματος μαγνησίου a = 0,32029 nm, c = 0,52000 nm, Z = 2.
Πυκνότητα 1,738 g/cm3 (19,7 °C)
Mαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs 2,5
Ηλεκτρική αντίσταση : 43,9 nΩ.m
2ο Παράδειγμα
4η περίοδος : Το ασβέστιο με χωροκεντρομένη κυβική δομή
με ατομική μεταλλική ακτίναι 197.10-12m
με ιοντική ακτίναCa +2 είναι 66.10-12m
Πυκνότητα 1,55 g/cm3 (19,7 °C)
Σκληρότητα Mohs: 1,75
Μέτρο ελαστικότητας:20GPa
Μαγνητική συμπεριφορά: παραμαγνητικό
3. Δομή στερεάς κατάστασης σε
υποομάδα του Σκάνδιου της ΙΙΙΒ με1 ηλεκτρόνιο στην υποστοιβάδα
Ανήκει στον τομέα d όπου έχουμε τα μέταλλα μεταπτώσεως χωρίς όμως το σκάνδιο να συμπεριλαμβάνεται σε αυτά διότι το Sc+3 ιόν δεν έχει πλέον ηλεκτρόνια στην υποστοιβάδα d
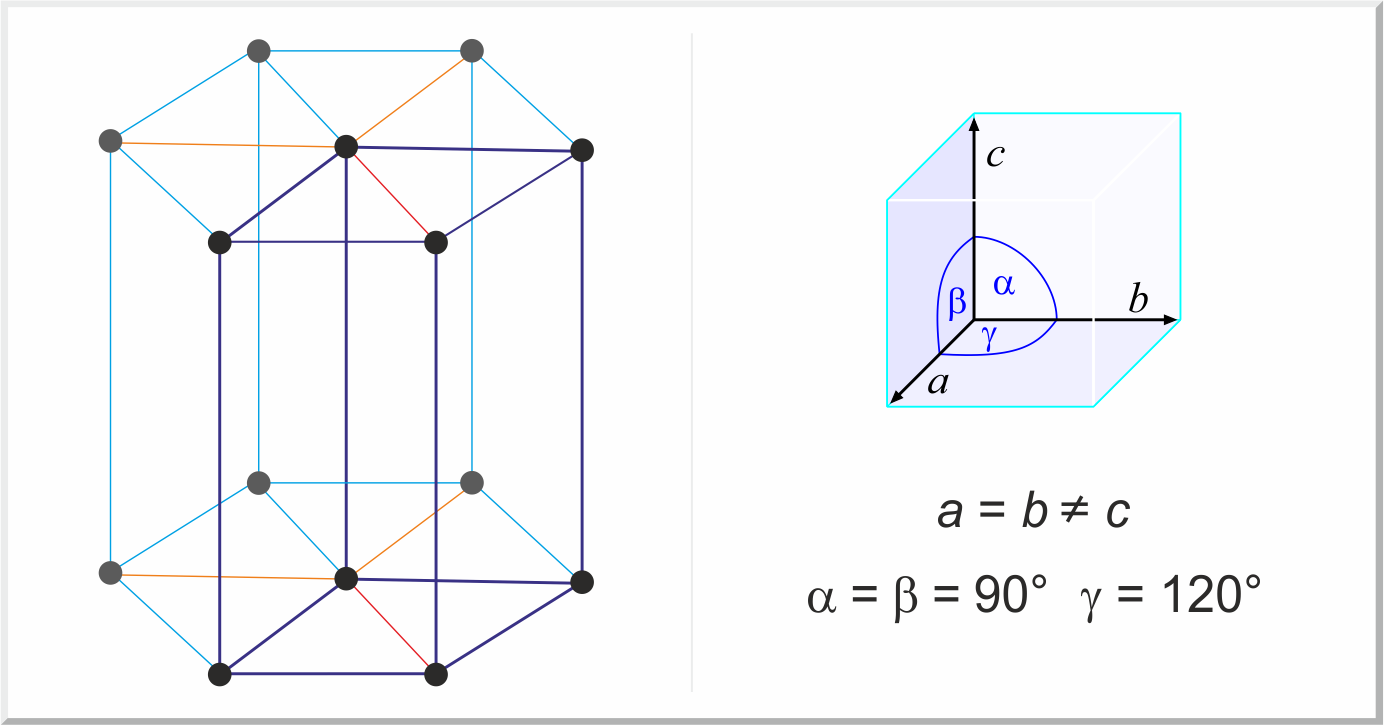 Το μεταλλικό πλέγμα του: 4η περίοδος - Σκάνδιο : ηλεκτρονική διαμόρφωση: 3d1 4s2
Το μεταλλικό πλέγμα του: 4η περίοδος - Σκάνδιο : ηλεκτρονική διαμόρφωση: 3d1 4s2
Υπάρχει σε δύο κρυσταλλικές τροποποιήσεις αναλογία γ/α= 1,592
α-Σκάνδιο (σε συνηθισμένη θερμορασία κρυσταλλώνεται σε
Δομή κλειστά συσκευασμένη εξαγωνική που δεν διαφέρει από την δομή του προηγούμενου Μαγνησίου a = 3,309 Å. c= 5,268 Å
β- Σκάνδιο
Δομή κυβικά επικεντρωμένη μεταβαίνει σε θερμοκρασία 1336Co
Η ατομική ακτίνα είναι 162.10-12m
, η Ομοιοπολική ακτίνα του Sc είναι 144.10-12m
4. Δομή στερεάς κατάστασης σε
υποομάδα του ψευδάργυρου της ΙΙΒ με10 ηλεκτρόνιο στην υποστοιβάδα
 Παράδειγμα: 4η περίοδος Ο ψευδάργυρος: ηλεκτρονική διαμόρφωση: [Ar]3d10 4s2
Παράδειγμα: 4η περίοδος Ο ψευδάργυρος: ηλεκτρονική διαμόρφωση: [Ar]3d10 4s2
κρυσταλλική δομή. εξαγωνική κλειστά συσκευασμένη
Η ατομική ακτίνα είναι 134.10-12m
Η ιοντική ακτίνα είνα (+2e) 74.10-12m
ακτίνα wan der walls Zn του είναι 139.10-12m
σε συνηθισμένη θερμοκρασία, κρυσταλλώνεται στους 419,6 C o σε εξαγωνικό πλέγμα, a = 2.6648 Å. c= 4,6448 Å
αναλογία γ/α 1,856
5. Δομή στερεάς κατάστασης σε στοιχεία μεταπτώσεως τομέα d
Στα μέταλλα των τομέων p και d έχουμε μεταλλικούς δεσμούς στο πλέγμα.
Όσο μεγαλύτερη είναι η αναλογια μεταλλικών δεσμού στο πλέγμα τόσο εντονότερες είναι οι μεταλλικές ιδιότητες
Τα στοιχεία μεταπτώσεως παλαιότερα συνήθιζαν να περιλαμβάνουν στοιχεία του d και f τομέα που έχουν συνήθως 2 ηλεκτρόνια στο εξωτερικό επίπεδο (σπανίως ένα) τα οποία είναι αασθενώς συνδεδεμένα με τον πυρήνα και εξ αυτού όλα τα μεταβατικά στοιχεία είναι μέταλλα.
Σήμερα στοιχεία μεταπτώσεως λογίζονται μόνο τα στοιχεία του τομέα d
Εδώ ανήκουν οι υποστοιβάδες του IVB (TITANIOY), VB (BANADIO) VI (ΧΡΩΜΙΟ) , VΙΙ(ΜΑΓΓΑΝΙΟ) , VIII 9ΣΙΔΗΡΟΣ), IX (ΚΟΒΑΛΤΙΟ) , X (ΝΙΚΕΛΙΟ) XI (ΧΑΛΚΟΣ) στην πρώτη σειρά, 4η περίοδος, ενώ αντίστοιχα στην δεύτερη , 5η περίοδος το Ζιρκόνιο, το νιόβιο, το μολυβδένιο, το τεχνήτιο, το ρουθήνιο, το ρόδιο, το παλλάδιο και ο άργυρος
1ο Παράδειγμα 4η περίοδος Το Τιτάνιο Ti ηλεκτρονική διαμόρφωση [Ar] 3d2 4s2
Η ατομική ακτίνα είναι 147.10-12m
Η ομοιοπολική ακτίνα είνα (+2e) 160.10-12m
Kρυσταλλικό σύστημα: Εξαγωνικό
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs : 6,0:
Μέτρο ελαστικότητας: 116GPa
2ο Παράδειγμα 4η περίοδος Το Βανάδιο
ηλεκτρονική διαμόρφωση:[Ar]4s23d3
Η ατομική ακτίνα είναι 147.10-12m
Η ομοιοπολική ακτίνα είνα (+2e) 160.10-12m
Kρυσταλλικό σύστημα: κυβικό επικεντρωμένο
Μαγνητική συμπεριφορά:
Ανθεκτικό στη δάβρωση
Ατομική ακτίνα 132,1 pm
πυκνότητα 6,11g/cm3
3o Παράδειγμα: 4η περίοδος Ο χρώμιο: ηλεκτρονική διαμόρφωση: [ Ar ] 3d5 4s1
Κρυσταλλικό σύστημα: κυβική επικεντρωμένη κρυσταλλική δομή.
Η ατομική ακτίνα είναι 128.10-12m
Η ομοιοπολική ακτίνα είνα (+2e) 74.10-12m
ακτίνα wan der walls Zn του είναι 139.10-12m
4ο Παράδειγμα 4η περίοδος Το Μαγγάνιο
ηλεκτρονική διαμόρφωση: [ Ar ] 3d5 4s2
Η ατομική ακτίνα είναι 127.10-12m
Η ομοιοπολική ακτίνα είνα (+2e) 139.10-12m
Kρυσταλλικό σύστημα: κυβικό επικεντρωμένο
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: 4,9 Gpa
μέτρο ελαστικότητας 132,1 pm
3ο Παράδειγμα 6η περίοδος Το Λουτήτιο
ηλεκτρονική διαμόρφωση: 4f14, 5d1, 6s2
Η ατομική ακτίνα είναι 174.10-12m
Η ομοιοπολική ακτίνα είναi 187 .10-12m
Kρυσταλλικό σύστημα: πυκνό εξαγωνικό a = 266,48.10-12m c= 464,48.10-12m
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: Gpa
μέτρο ελαστικότητας: pm
πυκνότητα: 9,84g/cm3
Δομή στερεάς κατάστασης σε στοιχεία (μεταπτώσεως) τομέα f
Στα μέταλλα των τομέων p και d έχουμε μεταλλικούς δεσμούς στο πλέγμα.
Όσο μεγαλύτερη είναι η αναλογια μεταλλικών δεσμού στο πλέγμα τόσο εντονότερες είναι οι μεταλλικές ιδιότητες
Τα στοιχεία μεταπτώσεως παλαιότερα συνήθιζαν να περιλαμβάνουν στοιχεία του d και f τομέα που έχουν συνήθως 2 ηλεκτρόνια στο εξωτερικό επίπεδο (σπανίως ένα) τα οποία είναι αασθενώς συνδεδεμένα με τον πυρήνα και εξ αυτού όλα τα μεταβατικά στοιχεία είναι μέταλλα και τα τελευταία ηλεκτρόνιά τους τοποθετούνται στην στοιβάδα d και f αντίστοιχα.
Σήμερα στοιχεία μεταπτώσεως λογίζονται μόνο τα στοιχεία του τομέα d.
Περιλαμβάνει στην 6η περίοδο τις λανθανίες με ατομικό αριθμό από 58 έως 71 που συμπληρώνουν την 4f και ακτινίδες στην 7η περίοδο με ατομικό αριθμό από 90 έως 103 που συμπληρώνουν την 5f Τα στοιχεία του τομέα f περιλαμβάνουν:
1ο Παράδειγμα 6η περίοδος Το Λανθάνιο
ηλεκτρονική διαμόρφωση: [ Xe ] 5d1 6s2
Η ατομική ακτίνα είναι 187.10-12m
Η ομοιοπολική ακτίνα είνα 128.10-12m
Kρυσταλλικό σύστημα: εξαγωνικό
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: 2,5 Gpa
μέτρο ελαστικότητας 27,9 pm
2ο Παράδειγμα 6η περίοδος Το Δημήτριο
ηλεκτρονική διαμόρφωση: [ Xe ] 5d1 6s2
Η ατομική ακτίνα είναι 181,8.10-12m
Η ομοιοπολική ακτίνα είνα 204.10-12m
Kρυσταλλικό σύστημα: κυβικό επικεντρωμένο
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: 2,5 Gpa
μέτρο ελαστικότητας: 21,5 pm
πυκνότητα: 6,77g/cm3
3ο Παράδειγμα 6η περίοδος Το Υττέρβιο
ηλεκτρονική διαμόρφωση: [Xe] 4f14 6s2
Η ατομική ακτίνα είναι 176.10-12m
Η ομοιοπολική ακτίνα είναi 187 .10-12m
Kρυσταλλικό σύστημα: κυβικό προσωποκεντρικό a = 266,48.10-12m c= 464,48.10-12m
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: Gpa
μέτρο ελαστικότητας: pm
πυκνότητα: 6,965g/cm3
4ο Παράδειγμα 6η περίοδος Το Ακτίνιο
ηλεκτρονική διαμόρφωση: [Rn] 6d1 7s2
Η ατομική ακτίνα
Η ομοιοπολική ακτίνα είναι 215 .10-12m
Kρυσταλλικό σύστημα: κυβικό επικεντρωμένο
Μαγνητική συμπεριφορά: παραμαγνητικό
Σκληρότητα Mohs: 2,5 Gpa
μέτρο ελαστικότητας: 21,5 pm
πυκνότητα: 10g/cm3
5ο Παράδειγμα 6η περίοδος Το Θόριο
ηλεκτρονική διαμόρφωση:
Η ατομική ακτίνα: 179 10-12m
Η ομοιοπολική ακτίνα είναι 206 .10-12m
Kρυσταλλικό σύστημα: μονοκλινές
Μαγνητική συμπεριφορά: παραμαγνητικό
πυκνότητα: 11,7g/cm3
6ο Παράδειγμα 7η περίοδος Το Νομπέλιο
ηλεκτρονική διαμόρφωση:[Rn] 5f14 7s2
Η ατομική ακτίνα είναι
Η ομοιοπολική ακτίνα είνα
Kρυσταλλικό σύστημα:
Μαγνητική συμπεριφορά:
Σκληρότητα Mohs:
μέτρο ελαστικότητας:
πυκνότητα:
Οι κρύσταλλοι των μετάλλων σχηματίζονται όταν περνά από την υγρή στην στερεά κατάσταση και αναπτύσσονται σε μεγαλύτερο μέγεθος όταν η κρυστάλλωση γίνεται αργά.
ΟΙ ΠΡΟΣΜΙΞΕΙΣ ΣΤΟ ΜΕΤΑΛΛΙΚΟ ΠΛΕΓΜΑ
Επισης είναι συνηθισμένο στο μεταλλικό πλέγμα να εγκλωβίζονται διάφορες άλλες ουσίες, είτε ανάμεσα στα μεταλλικά ιόντα,
σε κενά του πλέγματος εάν τα άτομα της ξένης ουσίας είναι μικρά άτομα
ή αντικαθιστώντας μεταλλικά ιόντα στο πλέγμα αν πρόκειται για πρόσμειξη με άτομα παραπλήσιου μεγέθους και δομής.
Και στις δύο περιπτώσεις έχουμε παραμόρφωση του πλέγματος που φέρνει και μεταβολή των ιδιοτήτων του.
Ένας από τους τύπους ελαττωμάτων είναι τα ελαττώματα σημείου που δημιουργούν αποκλίσεις από την ιδανική κανονικότητα στην κρυσταλλική δομή. Τα ελαττώματα σημείου μπορεί να είναι αρνητικά ή ελαττώματα κενού που σημαίνει την απουσία κάποιου ατόμου στην κανονική του θέση στο πλέγμα, ή ελαττώματα τύπου ακαθαρσίας δηλαδή η παρουσία ατόμων άλλου χημικού στοιχείου στο πλέγμα.
Ια ελαττώματα αλλάζουν τις ιδιότητες των μετάλλων. Τα κενά αυξάνουν την ατομική κινητικότητα και την διάχυση σε ένα μεταλλικό υλικό. Οι ακαθαρσίες μπορούν να αλλάξουν τις ηλεκτρικές ιδιότητες του μετάλλου.
Ακόμα, η παρουσία προσμίξεων στο μεταλλικό πλέγμα αυξάνει την δυνατότητα διάχυση ξένων ατόμων στο εσωτερικό του μεταλλικού πλέγματος καθώς και την διάβρωση
.jpg)
Δήμητρα Σπανού
ΠΗΓΕΣ
Μέταλλα - Βικιπαίδεια (wikipedia.org)
Κρυσταλλικά πλέγματα μετάλλων: δομή, ιδιότητες και εφαρμογή (fb.ru)
Δομή του κρυσταλλικού πλέγματος μετάλλων αλκαλικών γαιών (yourknives.ru)
https://tm.spbstu.ru/%D0%9A%D1%83%D0%B1%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%BA%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%80%D0%B5%D1%88%D0%B5%D1%82%D0%BA%D0%B0
Лекция №1 - Кристаллическое строение металлов. (mpei.ac.ru)
Όλα τα μέταλλα έχουν κρυσταλλική δομή: οι κύριες απαντήσεις (yourknives.ru)
https://foxford.ru/wiki/himiya/osobennosti-stroeniya-perehodnyh-metallov?utm_referrer=https%3A%2F%2Fwww.google.com%2F
https://chemicalstudy.ru/skandiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/#kristallicheskaya-reshetka
https://www.himsnab-spb.ru/article/ps/zn/
Scandium - EniG. Periodic Table of the Elements
Виды химической связи. Типы кристаллических реше
Δομή του κρυσταλλικού πλέγματος αλκαλικών μετάλλων: χαρακτηριστικά και ιδιότητες (yourknives.ru)
Δομή του κρυσταλλικού πλέγματος μετάλλων αλκαλικών γαιών (yourknives.ru)

Electrical Resistivity | The Elements Handbook at KnowledgeDoor

