Δήμητρα Σπανού χημικός καθηγήτρια α Βθμιας Εκπαίδευση ς οργσνικη θέση στο 1ο γυμν. Δάφνης
ΕΙΣΑΓΩΓΗ ΚΑΙ ΑΙΤΙΟΛΟΓΗΣΗ ΑΥΤΟΥ ΤΟΥ ΤΟΜΕΑ
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΕΣΩΤΕΡΙΚΗ ΔΟΜΗ ΥΛΙΚΩΝ ΣΩΜΑΤΩΝ.
Εδώ προσπαθώ να ανασύρω τα χημικά στοιχεία μαζύ με τις φυσικές , χημικές και φυσικοχημικές ιδιότητές τους συσχετίζοντας αυτές, στα μέτρα του δυνατού, με την εσωτερική τους δομή και σαν υλικά σώματα (παράδειγμα οι διαφορές μεταξύ άμορφων και κρυσταλλικών σωμάτων) αλλά και να δώσω την ιδέα για το πως και πόσο οι ιδιότητες αυτές επιρρεάζονται από τις εξωτερικές συνθήκες (παράδειγμα οι αλλοτροπικές μορφές σχετικά με την θερμοκρασία ή οι δυνάμεις που έχουν άλλα αποτελέσματα στα απλάυλικά σώματα ανάλογα με την εσωτερική δομή τους) κ.λ.π.
Λεπτομερέστερη και πιο εξειδικευμένη πληροφορία για τα χαρακτηριστικά και τις φυσικές ιδιότητες των χημικών στοιχείων υπάρχουν σε περιοχές του διαδικτύου όπως για παράδειγμα στην σελίδα
υπό κατασκευή
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ

ΤΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΟΥ ΜΕΤΑΛΛΙΚΟΥ ΚΡΥΣΤΑΛΛΙΚΟΥ ΠΛΕΓΜΑΤΟΣ
Ένα κρυσταλλικό μεταλλικό πλέγμα είναι μια διάταξη των ιόντων του μετάλλου μέσα στον χώρο η οποία έχει ορισμένα χαρακτηριστικά που ονομάζονται παραμέτροι του μοναδιαίου κελιού (κυττάρου του πλέγματος). Αυτά είναι :
τον τύπο (δομή) του πλέγματος (κυβικό, εξαγωνικό κ.λ.π.) την πυκνότητα συσκευασίας (αριθμό των ατόμων ανά στοιχειώδες κύτταρο) την απόσταση μεταξύ των κυψελίδων,
Η γνώση των παραμέτρων του πλέγματος εξηγεί πολλές ιδιότητες των μετάλλων όπως
 η μηχανική αντοχή: η μηχανική αντοχή των μετάλλων εξαρτάται από την πυκνότητα συσκευασίας των ατόμων στο κρυσταλλικό πλέγμα
η μηχανική αντοχή: η μηχανική αντοχή των μετάλλων εξαρτάται από την πυκνότητα συσκευασίας των ατόμων στο κρυσταλλικό πλέγμα
Τα πλέγματα με κέντρο όγκου (α σίδηρος) και πυκνα συσκευασμένο εξαγωνικό έχουν μεγαλύτερη πυκνότητα συσκευασίας από το κυβικό με κέντρο πρόσωπο (αλουμίνιο, χαλκός, νικέλιο)
Η σκληρότητα των μετάλλων καθορίζεται από την αντοχή στην παραμόρφωση. Μέταλλα με πυκνά συσκευασμένα πλέγματα είναι πιο σκληρά γιατί τα άτομα είναι πιο κοντά μεταξύ τους.
Μείωση της διατομικής απόστασης στο πλέγμα αυξάνει την μηχανική αντοχή.
Επίσης την αντοχή επιρρεάζει και η παρουσία ελλατωμάτων στο πλέγμα.
Η πλαστικότητα, ελαστικότητα εξαρτάται από την δυνατότητα μετατόπισης των ατομικών επιπέδων. Στα εξαγωνικά πλέγματα όπως το μαγνήσιο που είναι διατεταγμένα σε εξαγωνικά στρώματα, η πλαστικότητα είναι περιορισμένη. Αντίθετα μέταλλα με κυβικό προσωποκεντρικό πλέγμα, με ομοιόμορφη κατανομή των τάσεων μεταξύ των ατόμων, υπάρχει μεγαλύτερη ελαστικότητα
η θερμική αγωγιμότητα: Τα ηλεκτρόνια των μετάλλων μεταφέρουν θερμότητα και φορτίο
Έτσι η θερμική αγωγιμότητα, εξαρτάται από την κινητικότητα των ηλεκτρονίων που επιρρεάζεται από πυκνότητα συσκευασίας του πλέγματος και την τελειότητα κατασκεύής του. Ελλατώματα στο πλέγμα μειώνουν την θερμική αγωγιμότητα
η ηλεκτρική αγωγιμότητα: Εξαρτάται από την κινητικότητα των ηλεκτρονίων που επιρρεάζεται από πυκνότητα συσκευασίας του πλέγματος και την τελειότητα κατασκευής του. Ελλατώματα στο πλέγμα μειώνουν την αγωγιμότητα
Η θερμική και ηλεκτρική αγωγιμότητα μειώνονται με την άνοδο της θερμοκρασίας
το σημείο τήξης: Εξαρτάται από τις δυνάμεις μεταξύ των ιόντων του πλέγματος και από την πυκνότητα συσκευασίας του
η ευθραυστότητα: η ευθραυστότητα είναι αυξημένη κατά μήκος των επιπέδων του πλέγματος
Τα ελαττώματα του πλέγματος: Τα ελαττώματα αλλάζουν τις ιδιότητες των μετάλλων. Τα κενά αυξάνουν την ατομική κινητικότητα και την διάχυση σε ένα μεταλλικό υλικό. Οι ακαθαρσίες μπορούν να αλλάξουν τις ηλεκτρικές ιδιότητες του μετάλλου.
Είναι σημαντικό να γνωρίζουμε ότι οι παράμετροι του μεταλλικού κρυσταλλικού πλέγματος μπορούν να αλλάξουν υπό ιδάφορες συνθήκες (θερμοκρασία , πίεση κ.α.) με αποτέλεσμα είναι να επιρρεάζονται και οι ιδιότητές τους. Και αντίθετα με την γνώση των παραμέτρων μπορούμε να προβλέψουμε τις ιδιότητες των υλικών
Η μελέτη της κρυσταλλικής δομής των υλικών μας δίνει επίσης πληροφορίες
για την συμπεριφορά των υλικών υπό διαφορετικές συνθήκες λειτουργίας
ΕΠΙΔΡΑΣΗ ΤΗΣ ΘΕΡΜΟΚΡΑΣΙΑΣ ΣΤΙΣ ΠΑΡΑΜΕΤΡΟΥΣ ΤΟΥ ΜΕΤΑΛΛΙΚΟΥ ΠΛΕΓΜΑΤΟΣ
ΚΑΙ ΓΙΑΤΙ ΣΧΕΤΙΖΕΤΑΙ ΜΕ ΤΗΝ ΔΙΑΣΤΟΛΗ ΚΑΙ ΣΥΣΤΟΛΗ ΤΩΝ ΜΕΤΑΛΛΩΝ
α. Η διατομική απόσταση ro
H ro μεταξύ των ατόμων ή ιόντων του πλέγματος διαμορφώνεται με την εξισορρόπηση των ελκτικών δυνάμεων (κατιόντων και ελεύθερων ηλεκτρονίων) και των απωστικών (μεταξύ ομονύμων φορτισμένων σωματιδίων)
Η ατομική ακτίνα ro θεωρείται το μισό αυτής της απόστασης.
η ro σχετίζεται με την θερμοκρασία
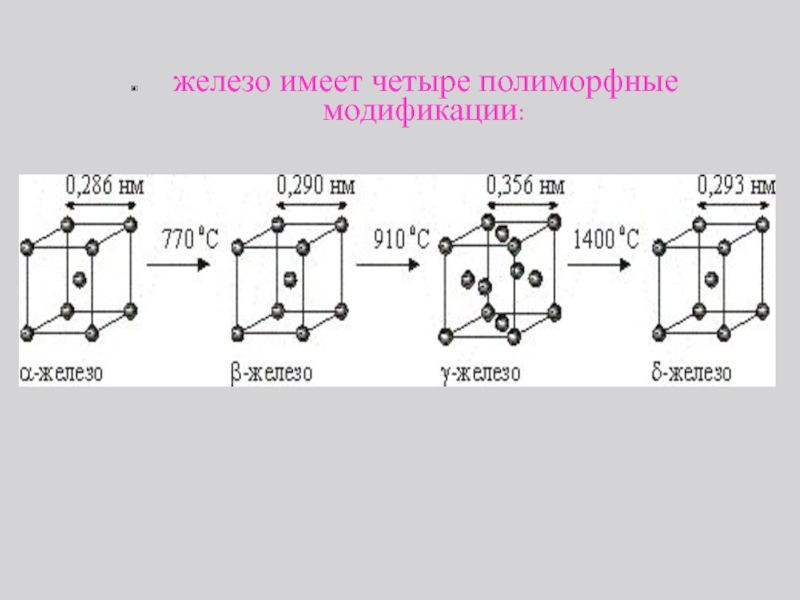
Ένας σημαντικός παράγοντας που επιρρεάζει αυτήν την απόσταση είναι η θερμοκρασία. Αυτή επιρρεάζει το πλάτος των ατομικών ταλαντώσεων και με την άνοδό της το πλάτος αυτό αυξάνει κι αυτό οδηγεί σε μετατόπιση της κεντρικής θέσης αυτού του πλάτους και εν τέλει αύξηση του όγκου της κυψελίδας (χωρίς απαρέτητα να αλλάζει η δομή του πλέγματος) και διαστολή του υλικού. Παράδειγμα ο σίδηρος: ο σίδηρος έως την θερμοκρασία των 770οC έχει πλέγμα κυβικό κεντρωμένο με παραμέτρους α=0,286nm και μαγνητικές ιδιότητες. Πάνω από αυτήν οι διαστάσεις του πλέγματος αυξάνονται έως τους 910ο C με α=0,290nm
ro ως προς τις εξωτερικές δυνάμεις
η συμπεριφορά της ro ως προς τις εξωτερικές δυνάμεις σχετίζεται με την ελαστικότητα του σώματος
Εάν με την επίδραση εξωτερικών δυμάμεων διάφορων τύπων (διαφορετικοί τύποι δεσμών ή διαφορετικά άτομα που εισέργονται στο πλέγμα κ.α.) το ro μπορεί να αλλάξει και η απόσταση μεταξύ των ατόμων να μεταβληθεί από αυτήν στην κατάσταση ηρεμίας, τότε το σώμα έχει αυξημένη ελαστικότητα.
Η μετατόπιση του κέντρου ηρεμίας σχετίζεται με την διαστολή του μετάλλου με την αύξηση της θερμοκρασίας
Πειραματικά αποδεικνύεται ότι η μετατόπιση της θέσης του κέντρου ηρεμίας τείνει προς την κατεύθυνση της έλξης ενώ προς την κατεύθυνση της πίεσης προβάλει μεγαλύτερη αντίσταση. Εάν δεν υπήρχε αυτή η διαφορά η θέση του κέντρου ισορροπίας θα ήταν σταθερή με την μεταβολή της θερμοκρασίας (άτακτες οι θερμικές κινήσεις των σωματιδίων) αλλά τελικά υπάρχει μετατόπιση του κέντρου αυτόυ και προσδιορίζεται ένας συντελεστής διαστολής α 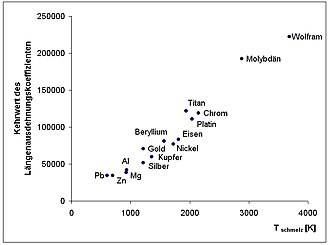
Εδώ, η θερμοκρασία τήξης και το αντίστροφο των α
από τα πιο σημαντικά μέταλλα απεικονίζονται μεταξύ τους.
Ο συντελεστής διαστολής για όλα τα μέταλλα από το απόλυτο μηδέν έως την θερμοκρασία τήξης τους είναι από 1,6% έως 2,4% και αποδεικνύεται ότι σχετίζεται με κάποια σχέση με την θερμοκρασία τήξης.
Ακόμα, υπάρχει εξάρτηση της θερμοκρασίας τήξης και του συντελεστή ελαστικότητας α
στο διάγραμμα βλέπουμε σχέση του 1/α και της θερμοκρασίας τήξης
ΤΟ ΜΟΝΤΕΛΟ ΤΟΥ ΜΕΤΑΛΛΙΚΟΥ ΠΛΕΓΜΑΤΟΣ ΤΩΝ ΜΕΤΑΛΛΙΚΩΝ ΚΑΤΙΟΝΤΩΝ ΚΑΙ ΤΩΝ ΕΛΕΥΘΕΡΩΝ ΗΛΕΚΤΡΟΝΊΩΝ
Το μεταλλικό πλέγμα δημιουργείται από τα μεταλλικά κατιόντα που απομένουν όταν ένα ή περισσότερα ηλεκτρόνια σθένους αποσπαστούν από τα άτομα και κινηθούν ελεύθερα μεταξύ των μεταλλικών αυτών κατιόντων
Όπως προηγουμένως αναφέρθηκε, η απόσταση μεταξύ των κατιόντων του μεταλλικού πλέγματος διαμορφώνεται με την εξισορρόπηση των ελκτικών και απωστικών δυνάμεων μεταξύ φορτισμένων σωματιδίων
Η κίνηση αυτή των ηλεκτρονίων
α. δημιουργεί μια ισχυρή σύνδεση ανάμεσα στα μεταλλικά ιόντα και ταυτόχρονα τα ηλεκτρόνια συγκρατούνται από τα μεταλλικά ιόντα μέσα στο μεταλλικό πλέγμα.
β. Οι δυνάμεις όμως που συγκρατούν ιόντα και ηλεκτρόνια στο πλέγμα δεν είναι εντοπισμένες ή κατευθυνόμενες, όμως συγκρατούν τα ιόντα με τρόπο ώστε αν το μέταλλο παίρνει σχήμα ή τεντώνεται τα ιόντα μετατοπίζονται σχετικά εύκολα το ένα προς το άλλο.
Τα περισσότερα μέταλλα είναι όλκιμα δηλαδή ένα μεταλλικό σύρμα μπορεί να λυγίσει χωρίς να σπάσει κι αυτό εξηγείται από την ιδιότητα των ατόμων στα μέταλλα να αντέχουν την μετατόπιση στρωμάτων ατόμων χωρίς να σπάνε. Στον χρυσό για παράδειγμα κατασκευάζονται λεπτά στρώματα.
γ. η κίνηση των ηλεκτρονίων επιτρέπει την μεταφορά θερμότητας και ηλεκτρισμού δια μέσου του μετάλλου
Το κρυσταλλικό πλέγμα είναι γεωμετρικό μοντέλο που χαρακτηρίζεται από τις αποστάσεις μεταξυ γειτονικών μορίων, τον τύπο, στερεομετρία του πλέγματος (κυβικό, εξαγωνικό κ.α.) και την πυκνότητα συσκευασίας (αριθμός συντονισμού) και την ύπαρξη ή μη ατελειών λόγω προσμίξεων
Στις περισσότερες περιπτώσεις εμφανίζονται υψηλοι αριθμοί συντονισμού: Τα αλκάλια που κρυσταλλώνονται στο κυβικό σύστημα με αριθμό συντονισμού 8 και κάθε μεταλλικό ιόν έχει 8 άλλα ιόντα γύρω του, ενώ σε κυβικό πλέγμα FCC όπως νικέλιου, χαλκού, κ.α ο αριθμός συντονισμού είναι 12. Σε εξαγωνικό είναι επίσης 12
ΣΥΜΠΕΡΙΦΟΡΑ ΤΩΝ ΜΕΤΑΛΛΩΝ ΩΣ ΠΡΟΣ ΤΟΝ ΗΛΕΚΤΡΙΣΜΟ
Ζώνη σθένους: Ο όρος χρησιμοποιείται για να εξηγησει την ηλεκτρική αγωγιμότητα ιδιαίτερα των ημιαγωγών. Είναι η υψηλότερη πλήρως κατελημένη ζώνη ενέργειας ηλεκτρονίων στο απόλυτο μηδέν ή είναι οι ζώνες ηλεκτρονίων στις οποίες τα ηλεκτρόνια συμβάλουν στον χημικό δεσμό.
Στην περίπτωση των αγωγών αυτή η ζώνη σθένους είτε είναι πανομοιότυπη με την ζώνη αγωγιμότητας (όπως στην περίπτωση του Νατρίου) ή να μπορεί να επικαλύπτεται από την επόμενη ενεργειακά υψηλότερη ζώνη
Η ζώνη σθένους ενός μονοσθενούς μετάλλου όπως του Νατρίου που είναι η 3s1 και είναι μερικώς κατελημένη με 1 ηλεκτρόνιο. Στο κρυσταλλικό πλέγμα του κατασκευάζεται, κάθε άτομο συνεισφέρει ένα ηλεκτρόνιο σθένους στον χημικό ιοντικό δεσμό.
Έτσι, η ζώνη σθένους γίνεται ενεργειακά πανομοιότυπη με την ζώνη αγωγιμότητας και το μονοσθενές μέταλλο που δημιουργεί κρυστάλλους γίνεται ηλεκτρικά αγώγιμο
Αντί για το ατομικό τροχιακό του ηλεκτρονίου του ατόμου του νατρίου, αυτό επεκτείνεται σε μοριακά τροχιακά που δημιουργείται συγκεκριμένα στην νέα κατάσταση ύπαρξης του ηλεκτρονίου, αυτήν του κρυσταλλικού πλέγματος, που περιγράφεται επίσης από μια νέα μορφή της εξίσωσης Strondinger.
Κάθε μοριακό τροχιακό έχει μια ορισμένη ενέργεια που είναι πολύ κοντά στην ενέργεια ιοντισμού
( Κάθε μοριακό τροχιακό έχει μια ορισμένη ενέργεια, που χαρακτηρίζεται περίπου από ένα αντίστοιχο δυναμικό ιονισμού.)
Σε αντίθεση με τα μονοκεντρικά ατομικά τροχιακά τα τροχιακά του χημικού δεσμού (κρυσταλλικό πλέγμα στην προκειμένη περίπτωση, είναι πολυκεντρικά και σε αντιστοιχία με τα s, p, d, f, ορίζονται σαν σ, π, δ, φ.
Στα δισθενή μέταλλα όμως, η στοιβάδα σθένους είναι με δύο ηλεκτρόνια και το ατομικό τροχιακό είναι κατειλημένο και θα έπρεπε να μην διαθέτει ηλεκτρική αγωγιμότητα
για περισσότερα πάνω στο θέμα αυτό
ΤΑ ΕΛΑΤΩΜΑΤΑ ΣΤΟ ΜΕΤΑΛΛΙΚΟ ΠΛΕΓΜΑ
Ένας από τους τύπους ελαττωμάτων είναι τα ελαττώματα σημείου που δημιουργούν αποκλίσεις από την ιδανική κανονικότητα στην κρυσταλλική δομή. Τα ελαττώματα σημείου μπορεί να είναι αρνητικά ή ελαττώματα κενού που σημαίνει την απουσία κάποιου ατόμου στην κανονική του θέση στο πλέγμα, ή ελαττώματα τύπου ακαθαρσίας δηλαδή η παρουσία ατόμων άλλου χημικού στοιχείου στο πλέγμα.
Ια ελαττώματα αλλάζουν τις ιδιότητες των μετάλλων. Τα κενά αυξάνουν την ατομική κινητικότητα και την διάχυση σε ένα μεταλλικό υλικό. Οι ακαθαρσίες μπορούν να αλλάξουν τις ηλεκτρικές ιδιότητες του μετάλλου.
ΟΙ ΑΛΛΟΤΡΟΠΙΚΕΣ ΜΕΤΑΤΡΟΠΕΣ ΣΤΑ ΜΕΤΑΛΛΑ
Μέταλλα που εμφανίζονται με αλλοτροπικές μορφές είναι κυρίως εκείνα που διαθέτουν πολλούς αριθμούς οξείδωσης που αλλάζουν με την θερμοκρασία. Το μεταλλικό πλέγμα που αποτελείται από ιόντα στους κόμβους και νέφος ηλεκτρονίων, επιρρεάζεται από την θερμοκρασία. Αλλαγές στην θερμοκρασία μπορούν να προκαλέσουν αλλαγές στις κινήσεις του νέφους των ηλεκτρονιων και αυτό να επιρρεάσει τα ιόντα στους κόμβους και την μετακίνησή τους στους κόμβους ενός νέου πλέγματος. Στις αλλοτροπικές μορφές προστίθενται γράμματα από το Εληνικό αλφάβητο μπροστά (α, β, γ, δ..) Το α δείχνει αυτό που σχηματίζεται στην χαμηλότερη θερμοκρασία.
Παράδειγμα ο κασσίτερος Sn: σε θερμοκρασία μικρότερη από 13,2 έχουμε τον αSn που είναι γρίζος, κρυσταλλική σκόνη, πλέγμα διαμαντιού, μεταξύ 13,2 και 161 βαθμούς κελσίου έχουμε τον λευκό κασσίτερο βSn όλκιμο μέταλλο με μεταλλικό πλέγμα και με μεταλλική λάμψη ενώ σε υψηλότερες θερμοκρασίες 161 έως 232 τον γSn μεγάλη σκληρότητα και ευθραυστοτητα και ρομβικό πλέγμα,
Για περισσότερα

Δήμητρα Σπανού
ΠΗΓΕΣ
Valence Ribbon - Βικιπαίδεια (wikipedia.org)
Κορδέλα - Βικιπαίδεια (wikipedia.org)
Μέταλλα - Βικιπαίδεια (wikipedia.org)
Θεωρία μοριακών τροχιακών - Βικιπαίδεια (wikipedia.org)
Valence Ribbon - Βικιπαίδεια (wikipedia.org)
Κορδέλα - Βικιπαίδεια (wikipedia.org)
Κρυσταλλικά πλέγματα μετάλλων: δομή, ιδιότητες και εφαρμογή
Μονοστιβάδες διχαλκογονιδίου μετάλλου μετάπτωσης - Βικιπαίδεια (wikipedia.org)
Electrical Resistivity | The Elements Handbook at KnowledgeDoor

