Δήμητρα Σπανού συνταξιούχος χημικός καθηγήτρια Βθμιας Εκπαίδευσης
υπό κατασκευή
ΕΙΣΑΓΩΓΗ ΚΑΙ ΑΙΤΙΟΛΟΓΗΣΗ ΓΙ ΑΥΤΟΝ ΤΟΝ ΤΟΜΕΑ
Η ΧΗΜΕΙΑ ΠΕΡΙΓΡΑΦΕΙ ΤΗΝ ΥΛΗ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΠΕΡΙΟΔΙΚΟ ΣΥΣΤΗΜΑ. ΕΣΩΤΕΡΙΚΗ ΔΟΜΗ ΥΛΙΚΩΝ ΣΩΜΑΤΩΝ.
Εδώ προσπαθώ να ανασύρω τα χημικά στοιχεία μαζύ με τις φυσικές , χημικές και φυσικοχημικές ιδιότητές τους συσχετίζοντας αυτές, στα μέτρα του δυνατού, με την εσωτερική τους δομή και σαν υλικά σώματα (παράδειγμα οι διαφορές μεταξύ άμορφων και κρυσταλλικών σωμάτων) αλλά και να δώσω την ιδέα για το πως και πόσο οι ιδιότητες αυτές επιρρεάζονται από τις εξωτερικές συνθήκες (παράδειγμα οι αλλοτροπικές μορφές σχετικά με την θερμοκρασία ή οι δυνάμεις που έχουν άλλα αποτελέσματα στα απλάυλικά σώματα ανάλογα με την εσωτερική δομή τους) κ.λ.π.
Λεπτομερέστερη και πιο εξειδικευμένη πληροφορία για τα χαρακτηριστικά και τις φυσικές ιδιότητες των χημικών στοιχείων υπάρχουν σε περιοχές του διαδικτύου όπως για παράδειγμα στην σελίδα
υπό κατασκευή

υπό κατασκευή
ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ: ΤΑ ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ ΠΟΥ ΔΕΝ ΕΙΝΑΙ ΜΕΤΑΛΛΑ
Τα μη μέταλλα είναι χημικά στοιχεία που δεν έχουν μεταλλικές ιδιότητες και είναι επίσης γνωστά σαν Αμέταλλα χημικά στοιχεία. Καταλαμβάνουν την πάνω δεξιά πλευρά του περιοδικού πίνακα και χωρίζονται από τα υπόλοιπα με μια νοητή τεθλασμένη γραμμή .
Τα μη μέταλλα έχουν υψηλές ηλεκτροσυγγένειες, υψηλή ηλεκτραρνητικότητα, υψηλό δυναμικό οξειδοαναγωγής
Τα άτομά τους σχηματίζουν ομοιοπολικούς πολικούς δεσμούς με άλλα αμέταλλα, ομοιοπολικούς πολικούς με τα ίδια αμέταλλα και ιοντικούς δεσμούς με μέταλλα. Επίσης δημιουργούς διαμοριακούς δεσμούς υδρογόνου.
Από τα 118 γνωστα στοιχεία τα 23ή 22 μπορούν να θεωρηθούν αμέταλλα. Το άστατο, το πέμπτο αλογόνο πολλές φορές παραβλέπεται λόγω σπανιότητας και ραδιενέργειας
ΑΕΡΙΑ, ΥΓΡΑ ΚΑΙ ΣΤΕΡΕΑ ΜΗ ΜΕΤΑΛΛΙΚΑ ΣΤΟΙΧΕΙΑ
Υπό κανονικές συνθήκες τα μισά από αυτά είναι άχρωμα αέρια, ένα (το βρώμιο) είναι υγρό και τα υπόλοιπα είναι στερεά.
Πολλά από αυτά σε θερμοκρασία περιβάλλοντος είναι αέρια
Τα αέρια είναι τα αμέταλλα που αποτελούνται από άτομα ή μόρια που τείνουν να έχουν χαμηλά σημεία τήξεως και ζέσεως. Τα άτομα ή μόρια από τα αυτά αποταλούνται συγκρατούνται μεταξύ τους με δυνάμεις διασποράς London.
Τα υγρά αμέταλλα έχουν χαμηλές πυκνότητες και σημεία τήξης, ζέσης και είναι κακοί αγωγοί της θερμότητας και του ηλεκτρισμού.
Οι φυσικές ιδιότητες των στερεών αμετάλλων όπως η θερμική και ηλεκτρική αγωγιμότητα, η ευθραυστότητα, η πλαστικότητα κ.α. ιδιότητες σχετίζονται με την εσωτερική δομή της ύλης τους, την παρουσία κρυσταλλικών πλεγμάτων, τις δυνάμεις που ασκούνται στα εξωτερικά ηλεκτρόνια.
Τα στερεά μη μεταλλικά χημικά στοιχεία για τα οποία βρίσκονται στην πιο αριστερή πλευρά του πίνακα ή χαμηλότερα στη στήλη, έχουν συχνά κάποιες ασθενείς μεταλλικές αλληλεπιδράσεις μεταξύ μορίων, αλυσίδων ή στρωμάτων ώστε χρειάζονται μεγαλύτερη ενέργεια για να ξεπεραστεί ο ομοιοπολικός δεσμός . Ως εκ τούτου συναντώνται σαν στερεά σώματα σε συνήθη θερμοκρασία. Αυτά είναι:
το Βόριο, ο άνθρακας, ο Φωσφορος, τα Αρσενικό το Σελήνιο, το Αντιμόνιο, το τελλούριο και το ιώδιο
Γενικά τα χημικά στοιχεία που δεν είναι μέταλλα σχηματίζουν κάποιες ομάδες με χαρακτηριστικές ιδιότητες, έχουν χαμηλή πυκνότητα, είναι εύθραυστα με χαμηλή μηχανική και δομική αντοχή και κυμαινόμενη αγωγιμότητα.
ΠΟΙΑ ΕΙΝΑΙ ΤΑ ΜΗ ΜΕΤΑΛΛΙΚΑ (ΑΜΕΤΑΛΛΑ) ΧΗΜΙΚΑ ΣΤΟΙΧΕΙΑ
Στην 8Α 0μάδα (18) έχουμε τα ευγενή αέρια (όλα άχρωμα, άοσμα αδρανή με συμπληρωμένη της στοιβάδα σθένους)
Στην 7Α ομάδα (17) έχουμε τα αλογόνα με 7 ηλεκτρόνια στην στοιβάδα σθένους (Φθόριο και χλώριο αέρια, βρώμιο υγρό και ιώδιο μεταλλικό στερεό και ημιαγωγός)
Στις ομάδες τοποθετούνται χημικά στοιχεία τα
ημιμέταλλα ή μεταλλιοειδή
που ανάλογα λειτουργούν και σαν μέταλλα και σαν μη μέταλλα και εξετάζονται ξεχωριστά:
13η ομάδας (Βόριο Β), 
την 14η ομάδα (πυρίτιο Si, Γερμάνιο Ge)
την 15η ( Αρσενικό, As Αντιμόνιο Sb)
την 16η (Τελλούριο Te, Πoλώνιο Po)
και τα
αταξινόμητα αμέταλλα
από τα οποία είναι αέρια τα:
1Α ομάδα το Υδρογόνο (Η),
5Α ομάδα το Άζωτο (Ν) ,
6Α ομάδα το Οξυγόνο (Ο)
έχουν μορφή μετάλλου
4Α ομάδα ο Άνθρακας (C)
στην 5Α ομάδα του αζώτου ο Φωσφόρος (P)
στην 6Α ομάδα του οξυγόνου το Σελήνιο (Se)
και στην ομάδα του οξυγόνου το θείο (S)
ΕΣΩΤΕΡΙΚΗ ΔΟΜΗ ΚΑΤΑΣΤΑΣΗΣ ΣΤΕΡΕΩΝ ΜΗ ΜΕΤΑΛΛΙΚΩΝ ΣΤΟΙΧΕΙΩΝ
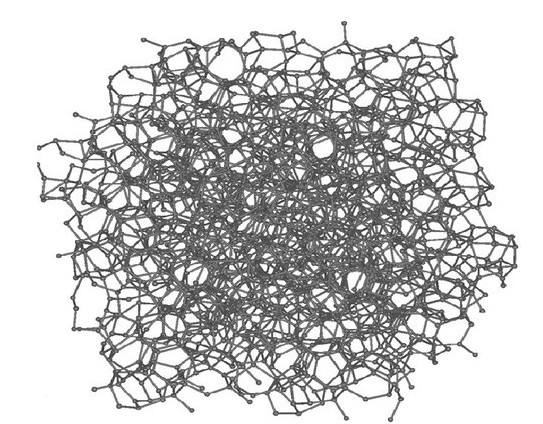
.jpg)
Αυτά που σε θερμοκρασία περιβάλλοντος είναι στερεά σχηματίζουν συνήθως γιγαντιαίες δομές όπως αλυσίδες 1000 ατόμων (σελήνιο), φύλλα (άνθρακας) ή ή τρισδιάστατα πλέγματα (πυρίτιο). Έχουν υψηλότερα σημεία τήξης και ζέσης γιατί χρειάζεται μεγάλη ενέργεια για να καταστραφούν αυτές οι δομές.
ΟΙ ΙΔΙΟΤΗΤΕΣ ΤΩΝ ΜΗ ΜΕΤΑΛΛΩΝ
Οι ιδιότητες των αμετάλλων διαφέρουν από τις ιδιότητες των μετάλλων, κυρίως γιατί στερούνται ελεύθερων ηλεκτρονίων, τα οποία και είναι υπεύθυνα για την μεταφορά ηλεκτρισμού και θερμότητας. Έτσι είναι ως επί το πλείστον κακοί αγωγοί γι αυτά.
Με εξαίρεση βέβαια όσων από αυτά είναι στον περιοδικό πίνακα πιο κοντά στην αριστερή πλευρά ή χαμηλά και παίρνουν κάποιες από τις μεταλλικές αλληλεπιδράσεις μεταξύ των μορίων, αλυσίδων ή στρωμάτων τους.
Το Βόριο, ο άνθρακας, ο φωσφόρος , το αρσενικό, το σελήνιο, το τελούριο, το αντιμόνιο και το ιώδιο εμφανίζουν υπό όρους κάποιες μεταλλικές ιδιότητες
Καλή ηλεκτρική και θερμική αγωγιμότητα παρατηρείται στον άνθρακα, αρσενικό, αντιμόνιο
Τιμές θερμικής αγωγιμότητας συγκρίσιμες με των μετάλλων βόριο, πυρίτιο, , γερμάνιο, αρσενικό
Από τα μη μέταλλα τα Βόριο, Πυρίτιο, Γερμάνιο, Αρσενικό, Αντιμόνιο, Πολώνιο Τελούριο εξαιτάζονται στα ημιμέταλλα (μεταλλοειδή
Βόριο: 1s22s22p1
Δομή στερεάς κατάστασης: Το βόριο είναι ένα ημιμέταλλο που σε στερεά κατάσταση βρίσκεται σε άμορφη ή κρυσταλλική μορφή
Ομοιοπολική ακτίνα:
Ακτίνα ιόντων
Θερμική αγωγιμότητα στους 300Κ 149W/mK
Δομή κρυσταλλικού πλέγματος: Σχηματίζει ένα κρυσταλλικό πλέγμα με ρομβοεδρική δομή α=10,17.10-10 m c=65,18 10-10m
συναντάται σε 10 αλλοτροπικές τροποποιήσεις που καθορίζονται από την θερμοκρασία: από τις κρυσταλλικές έχουμε αβόριο, ββόριο, γβόριο
Πλάτος διακένου ζώνης

γ βόριο =2,1eV

β βοριο=1,6eV,

α βόριο=2eV
Φωσφόρος : 1s22s22p63s23p3
Δομή στερεάς κατάστασης: λευκός φωσφόρος με μοριακό πλέγμα τετραέδρου, κίτρινος φωσφόρος κρυσταλλικός εύφλεκτος, κόκκινος φωσφόρος πολυμερές , μαύρος φωσφόρος κρυσταλλικός αδιάλυτος στο νερό
Ομοιοπολική ακτίνα: 106pm
Ακτίνα ιόντων 212pm
Θερμική αγωγιμότητα στους 300Κ 0,236W/mK
Δομή κρυσταλλικού πλέγματος: Κυβικό ογκοκεντρικό,
Πολυμορφικές τροποποιήσεις σε μεγάλες πιέσεις
Διηλεκτρική σταθερά: 12
Πλάτος διακένου ζώνης: 1,21eV
Σελήνιο: 1s22s22p63s23p64s23d104p4
Δομή στερεάς κατάστασης: Κρυσταλλικά: α σελήνιο, β σελήνιο, γ σελήνιο. Κόκκινο άμορφο σελήνιο. Μαύρο υαλώδες σελήνιο
Ομοιοπολική ακτίνα: 116pm
Ακτίνα ιόντων 198pm
Θερμική αγωγιμότητα στους 300Κ 0,52W/mK
Δομή κρυσταλλικού πλέγματος: εξαγωνικό
Αλλοτροπικές τροποποιήσεις σε κανονικές συνθήκες με σημαντικές διαφορές. Σταθερότερη το γ σελήνιο γρι κρυσταλλικό με παράλληλες γραμμές εξαγωνικοί κρύσταλλοι μετατρέπεται σε κυβική τροποποίηση
Ειδική ηλεκτρική αντίσταση 80Ohmm
Πλάτος διάκενου ζώνης 1,8eV
Θείο : 1s22s22p63s23p4
Δομή στερεάς κατάστασης: Είναι μη μέταλλο σε σκόνη
Ομοιοπολική ακτίνα: 102pm
Ακτίνα ιόντων 184pm
Θερμική αγωγιμότητα στους 300Κ W/mK
Δομή κρυσταλλικού πλέγματος: ,
Πολυμορφικές τροποποιήσεις σε μεγάλες πιέσεις
Διηλεκτρική σταθερά:
Πλάτος διακένου ζώνης: eV
ΠΗΓΕΣ
Βόριο (στοιχείο) - Βικιπαίδεια
χρησιμα
ακατέργαστο
| (300 Κ) 149 W/(m·K) |
