Δήμητρα Σπανού συνταξιούχος χημικός καθηγήτρια Βθμιας Εκπαίδευσης
Στο κεφάλαιο αυτό θα ερμηνευτούν οι συνθήκες υπό τις οποίες τα χημική στοιχεία ενώνονται και δημιουργούν χημικές ενώσεις.
Ανασύρουμε πολλές χρήσιμες πληροφορίες από το κεφάλαιο Ο ΚΥΚΛΟΣ ΤΩΝ ΗΛΕΚΤΡΟΝΙΩΝ ΣΤΗΝ ΥΛΗ: Κεφ 1.Τι είναι τα ηλεκτρόνια των ατόμων, Ενέργεια ιοντισμού, ηλεκτροσυγγένεια, μεταβολή ενθαλπίας ΔΗ και ελεύθερης ενέργειας ΔG
Ο ΡΟΛΟΣ ΤΩΝ ΗΛΕΚΤΡΟΝΙΩΝ ΤΗΣ ΣΤΟΙΒΑΔΑΣ ΣΘΕΝΟΥΣ ΣΤΗΝ ΣΥΜΠΕΡΙΦΟΡΑ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ
Τα ηλεκτρόνια της εξωτερικής στοιβάδας των ατόμων που λέγονται ηλεκτρόνια σθένους είναι αυτά που καθορίζουν την φυσική και χημική συμπεριφορά των ατόμων και που μπορούν να αλλάξουν θέση και δυναμικό με στόχο κυρίως την θερμοδυναμική σταθερότητα και γνώμονα την μεταβολή της ενθαλπίας των στοιχείων που συμμετέχουν στην διαδικασία.
Η συμπεριφορά του ατόμου ως προς την μετακλινηση ηλεκτρονίων της στοιβάδας σθένους του καθορίζεται από την ατομική ακτίνα του, την ενέργεια ιοντισμού των ηλεκτρονίων και την ηλεκτροσυγγένεια.
Εν συντομία θυμόμαστε τι σημαίνει το καθένα από αυτά:
Ατομική ακτίνα: ορίζεται σαν το μισό της απόστασης των πυρήνων δύο γειτονικών ατόμων . Την μετρούμε σε Αστρογκ Αο μ Χαρακτηριστικές ενέργειες ιοντισμού στον κάτω πίνακα από
Στοιχείο Ατομική ακτίνα 12Mg 2.15Å, 15P 1.97Å 20Ca 1.60Å 38Sr 1.10Å
ΕΝΕΡΓΕΙΑ ΙΟΝ(Τ)ΙΣΜΟΥ
Ενέργεια ιοντισμού καλείται το ελάχιστο ποσό ενέργειας που απαιτείται για να αποσπασθεί το ασθενέστερα συγκρατούμενο ηλεκτρόνιο ενός ελεύθερου ατόμου ή μορίου (σε αέρια φάση, θεμελιώδης κατάσταση) προς σχηματισμό κατιόντος.
Αντανακλά την ισχύ του δεσμού των εξωτερικών ηλεκτρονίων με τον πυρήνα και είναι πάντα ενδοενεργειακή αντίδραση
Εξαρτάται από τον αριθμό των στοιβάδων του ατόμου, το φορτίο του πυρήνα, την ηλεκτρονιακή ακτίνα, την ηλεκτραρνητικότητα και την θέση του στοιχείου στον περιοδικό πίνακα
Παράδειγμα: X + Ενέργεια ιοντισμού -> X+ + e-
Δίνονται η πρώτη ενέργεια ιοντισμού των παρακάτω στοιχείων: Στοιχείο 3Li 5,39 eV, 11Na 5,14eV, 19K 4,34eV, 20Ca 6,1eV,
Η δεύτερη ενέργεια ιοντισμού για την απομάκρυνση του δεύτερου ηλεκτρονίου είναι μεγαλύτερη από αυτήν για το πρώτο όπως και ηπομάκρυνση τρίτου είναι ακόμα μεγαλύτερη.
Τα ευγενή αέρια πολύ δύσκολα αποβάλουν ηλεκτρόνια από την εξωτερική τους στοιβάδα εφόσον αυτό διαταρράσει την ηλεκτρική ισοροπία τους και έχουν την μεγαλύτερη ενέργεια ιοντισμού που ταυτίζεται εδώ με την μεταβολή της ενθαλπίας τους
Ne (g) - e-→ Ne+ (g) - 2080 Kcal/mole με ΔΗ = ενέργεια ιονισμ= 2080 Kcal/mole,
Αντίθετα τα μέταλλα χρειάζονται πολύ μικρότερη ενέργεια (ιοντισμού που ταυτίζεται με την μεταβολή της ενθαλπίας τους) ώστε να αποβάλλουν τα λίγα ηλεκτρόνια της στοιβάδας σθένους (που τους φέρνουν ανισορροπία) και να μείνουν με τις συμπληρωμένες και ισόρροπες εσωτερικές τους στοιβάδες. Όταν η ενέργεια ιοντισμού είναι σχετικά μικρή και και τα άτομα εύκολα γίνονται θετικά ιόντα, λέμε ότι έχουν μεγάλη ηλεκτροθετικότητα
Na (g) - e-→ Na+ (g) - 496 Kcal/mole με ΔΗ= ενέργεια ιονισμού = 496 Kcal/mole
Τα αμέταλλα είναι δύσκολο να αποβάλλουν ηλεκτρόνια από τις μισοσυμληρωμένες στοιβάδες τους και η ενέργεια ιοντισμού, που ταυτίζεται εδώ με την μεταβολή της ενθαλπίας τους είναι πολύ μεγαλύτερη. Αντίθετα με τα μέταλλα, τα αμέταλλα έχουν μικρή ηλεκτροθετικότητα
F (g) - e-→ F+ (g) - 1680 Kcal/mole με ΔΗ= ενέργεια ιονισμού = 1680 Kcal/mole,
ΗΛΕΚΤΡΟΣΥΓΓΕΝΕΙΑ
Ηλεκτροσυγγένεια στοιχείου είναι η μεταβολή της ενέργειας που παρατηρείται κατα την πρόσληψη ενός ηλεκτρονίου από άτομο (σε αέρια φάση, θεμελιώδης κατάσταση) .
Αντανακλα την ικανότητα του ατόμου να προσκολλά επιπλέον ηλεκτρόνια
Εξαρτάται από την συνολική διαμόρφωση των ηλεκτρονίων στο άτομο, την θέση του στον περιοδικό πίνακα και την ηλεκτραρνητικότητά του
Για ηλεκτρόνια δίνεται σε (ηλεκτρονιοβόλτ αναά άτομο eV/ άτομο) νA + e → A - + ε
-
Αλλά εκφράζεται και σε kj/mol και είναι αντίθετη σε πρόσημο με την ενέργεια ιονισμού
Εκφράζεται σε kj/mol και είναι αντίθετη σε πρόσημο με την ενέργεια ιονισμού
Γενικά υπάρχει σχέση μεταξύ της ενέργειας ιονισμού και της ηλεκτροσυγγένειας. Όσο η ενέργεια ιονισμού αυξάνεται (και η δυσκολία να απομακρυνθεί ηλεκτρόνιο) συνήθως αυξάνεται και η ηλεκτροσυγγένεια (ικανότητα να δεσμεύει ηλεκτρίνεια το άτομο)
Αυτό όμως δεν είναι απόλυτο γιατί υπάρχουν διαφορές στους παράγοντες που επιρρεάζουν την ενέργεια ιοντισμού και την ηλεκτροσυγγένεια
Αυτό όμως δεν είναι απόλυτο γιατί υπάρχουν διαφορές στους παράγοντες που επιρρεάζουν την ενέργεια ιοντισμού και την ηλεκτροσυγγένεια
Στον πίνακα που ακολουθεί βλέπουμε τις τιμές της ηλεκτροσυγγένειας ε σε eV / atomo. Έχουμε και θετικές τιμές αλλά και αρνητικές τιμές πρνητικόιόν που ου σημαίνει ότι η αντίδραση πρόσληψης ηλεκτρονίου από το άτομο είναι ενδοενεργειακή ή εξωενεργειακή δηλαδή το αρνητικό ιόν είναι σταθερότερο του ατόμου και αντίστροφα
Πίνακας ηλεκτροσυγγένειας ηλεκτρονίου κατά άτομο σε eV
| Элемент | ε | Элемент | ε | Элемент | ε |
|---|---|---|---|---|---|
| H | 0,7542 | Na | 0,548 | K | 0,502 |
| He | -0,54 | Mg | -0,4 | Ca | -0,3 |
| Li | 0,618 | Al | 0,441 | Sc | 0,14 |
| Be | -0,5 | Si | 1,385 | Ti | -0,40 |
| B | 0,277 | P | 0,747 | V | -0,94 |
| C | 1,263 | S | 2,077 | Cr | -0,98 |
| N | -0,07 | Cl | 3,617 | Mn | 1,07 |
| О | 1,461 | Br | 3,365 | Fe | -0,58 |
| F | 3,399 | I | 3,06 | Co | -0,94 |
| Ne | -1,2(2) | Ni | -1,28 | ||
| Cu | -1,80 |
Cl (a) + e-→ Cl– (a) με ΔΗ = –83,32 Kcal/mole, Ο (a) + e- → Ο– (a) με ΔΗ = –53,8 Kcal/mole
Στην πρόσληψη ενός δεύτερου ηλεκτρονίου έχουμε δεύτερο βαθμό ηλεκτροσυγγένειας με διαφορετική τιμή
Αυτοί οι τρεις παράγοντες καθορίζουν την μετακίνηση ηλεκτρονίων που μπορεί να είναι
α. Μετακίνηση ολοκληρωτική, όταν το ηλεκτρόνιο απομακρύνεται μόνιμα και ολοσχερώς από το άτομο και μεταφέρεται συνήθως σε άλλο άτομο. Στην περίπτωση αυτή δημιουργούντα ιόνται τα οποία συνδέονται με ηλεκτρικές δυνάμεις που είναι γνωστές σαν ιοντικός ή ετεροπολικός δεσμός
β.Μεταφέρεται μόνο ένα κλάσμα του φορτίου του ηλεκτρονίου και προκύπτει συντονισμός του δότη και του δέκτη. Αυτό προκαλεί σύνδεση του δότη και του δέκτη οι οποίοι διατηρούν την χημική τους ταυτότητα. Αυτή η σύνδεση είναι γνωστή σαν ομοιοπολικός δεσμός
Με την μονομερή προσφορά ή με το μοίρασμα ηλεκτρονίων μεταξύ ατόμων, τα άτομα προσπαθούν να αποκτήσουν μεγαλύτερη σταθερότητα ισορροπόντας τις ηλεκτρονιακές ροπές της εξωτερικής τους στοιβάδας. Την σταθερότητα αυτή έχουν από την κατασκευή τους τα ευγενή αέρια που έχουν συμπληρωμένη την εξωτερική τους στοιβάδα και εξισορροπισμένες τις ηλεκτρονιακές τους ροπές.
ΔΥΝΑΜΙΚΟ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ
ΗΜΙΣΤΟΙΧΕΙΟ
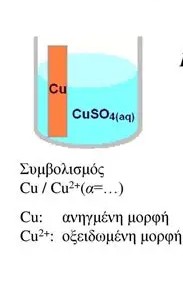 Η απομάκρυνση/ πρόσληψη ηλεκττρονίων σε ένα χημικό στοιχείο, με την δημιουργία ενός οξειδοαναγωγικού ζεύγους δίνει περιοχές με διαφορετικό ηλεκτρικο φορτίο και βέβαια μεταξύ τους αναπτύσσεται μια διαφορά ηλεκτρικού δυναμικού.
Η απομάκρυνση/ πρόσληψη ηλεκττρονίων σε ένα χημικό στοιχείο, με την δημιουργία ενός οξειδοαναγωγικού ζεύγους δίνει περιοχές με διαφορετικό ηλεκτρικο φορτίο και βέβαια μεταξύ τους αναπτύσσεται μια διαφορά ηλεκτρικού δυναμικού.
Η τιμή αυτής της διαφοράς δυναμικού καθορίζεται από πολλούς παράγοντες σημαντικότεροι από τους οποίους είναι η ενέργεια ιοντισμού και το μέγεθος των ιόντων
Για να μετρήσουμε χρησιμοποιούμε ένα ημιστοιχείο
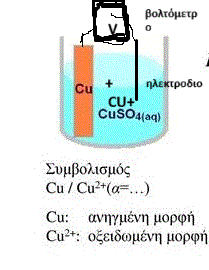 μια κατάλληλη διάταξη μετρήσεως δυναμικού με σκοπό να μετρήσουμε την τιμή του απόλυτου δυναμικού ενός ημιστοιχείου.
μια κατάλληλη διάταξη μετρήσεως δυναμικού με σκοπό να μετρήσουμε την τιμή του απόλυτου δυναμικού ενός ημιστοιχείου.
(Να σημειώσουμε ότι, κάθε ημιστοιχείο, μπορεί να κατασκευάζεται όχι μόνο από την οξειδωμένη/ ανηγμένη μορφή ενός χημικού στοιχείου αλλά από μια χημική οντότητα ατομική, μοριακή ή ιοντική που βρίσκεται σε δύο διαφορετικές καταστάσεις οξείδωσης. Αλλά αυτό δεν είναι επί του παρόντος)
Για να κατασκευαστεί ένα ημιστοιχείο, βυθίζουμε το χημικό στοιχείο σε διάλυμα ηλεκτρολύτη και συνδέουμε βολτόμετρο με το ένα ηλεκτρόδιο να βυθίζεται στο ίδιο διάλυμα και ο άλλος ακροδέκτης να συνδέεται με το στερεό στοιχείο μας, που είναι κι αυτό βυθισμένο και με αυτόν τον τρόπο έχουμε τα ιόντα του που ελευθερώνονται μέσα στο διάλυμα.
Έτσι όμως, το διάλυμα και το χημικό στοιχείο, που είναι βυθισμένο μέσα σε στερεά κατάσταση και που έχουν φτάσει σε χημική ισορροπία εμφανίζουν μια διαφορά δυναμικού εφόσον μεταξύ τους κινούνται ηλεκτρόνια. Αυτή τη διαφορά δυναμικού μετρά το βολτόμετρο του οποίου ο ένας ακροδέκτης συνδέεται με το χημικό στοιχείο και ο άλλος βυθίζεται στο διάλυμα.
Όμως το μέταλλο που έχει το ηλεκτρόδιο του βολτόμετρου επιρρεάζει την διαφορά δυναμικού στο διάλυμα καθώς και η περιεκτικότητα του νερού σε ιόντα και έτσι η μέτρηση που γίνεται δεν είναι πάντα ακριβής και επαναλήψιμη . Έτσι κατοχυρώθηκε να μετράμε αυτήν τη διαφορά δυναμικού του οξειδοαναγωγικού ζεύγους χημικού στοιχείου/ ιόντος του με θερμοκρασία 25οC και συγκέντρωση 1Μ Αυτό λέγεται πρότυπο δυναμικό του ημιστοιχείου
Για καλύτερα αποτελέσματα μετράμε την διαφορά δυναμικού , έμμεσα, συγκρίνοντας κάθε φορά το δυναμικό αυτό (το απόλυτο δυναμικο) με το δυναμικό ενός πρότυπου ηλεκτρόδιο συνήθως του ηλεκτρόδιου υδρογόνου
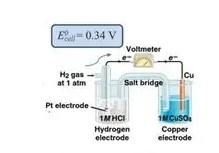
ΚΑΝΟΝΙΚΟ ή ΠΡΟΤΥΠΟ ΗΛΕΚΤΡΟΔΙΟ ΥΔΡΟΓΟΝΟΥ (SHE)
Το πρότυπο ηλεκτρόδιο υδρογόνου είναι κι αυτό ένα ημιστοιχείο που μετράμε το δυναμικό του H/H+,
H2 -> 2H+ + 2ε-
Η μέτρηση γίνεται με βολτόμετρο το οποίο έχει το ένα ηλεκτρόδιό του από λευκόχρυσο ο οποίος έχει την ιδιότητα να προσροφά το αέριο υδρογόνο στην επιφάνειά του.
ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΜΕ ΤΗΝ ΒΟΗΘΕΙΑ ΤΟΥ ΠΡΟΤΥΠΟΥ ΗΛΕΚΤΡΟΔΙΟΥ ΥΔΡΟΓΟΝΟΥ
Συνδέουμε τον θετικό ακροδέκτη του βολτόμετρου με το ημιστοιχείο που μετράμε στοιχείο μας και τον αρνητικό ακροδέκτη με το ημιστοιχείο του υδρογόνου. Τα δύο ημιστοιχεία χωρίζονται μεταξύ τους με πορώδες διάφραγμα που επιτρέπει την διέλευση των ιόντων αλλά όχι την ανάμειξη των διαλυμάτων
Η μέτρηση που γίνεται έτσι είναι
η μέτρηση της διαφοράς του δυναμικού των δύο ηλεκτροδίων.
Η διαφορά των δυναμικών τους (Δυναμικό του οξειδοαναγωγικού ζεύγους - δυναμικό του πρότυπου ηλεκτρόδιου υδρογόνου) προκύπτει ακριβής
Το πρότυπο δυναμικό του ηλεκτροδίου υδρογόνου το θεωρούμε συμβατικά ίσο με μηδέν
ΤΥΠΙΚΟ ΔΥΝΑΜΙΚΟ ΟΞΕΙΔΟΑΝΑΓΩΓΗΣ
Η διάταξη μεταλλικού ηλεκτροδίου ενός ημιστοιχείο - ηλεκτρόδιο
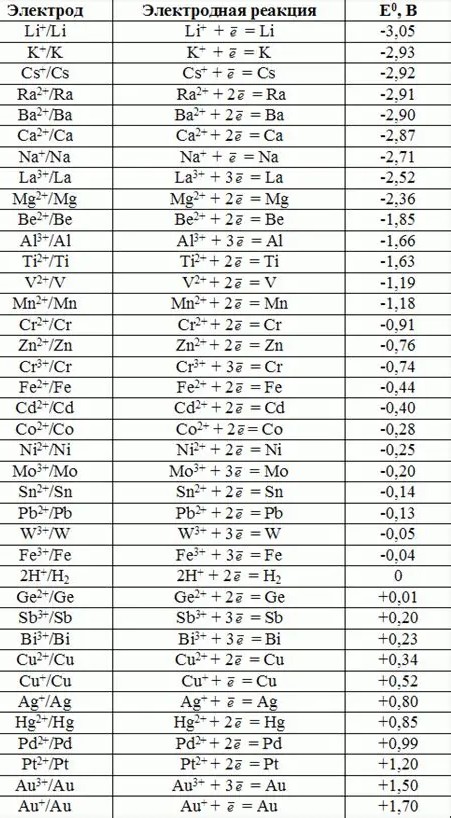
υδρογόνου δίνει την διαφορά δυναμικού που έχει μια σταθερή τιμή κάθε φορά. Για να πάρουμε όμως σταθερές τιμές ώστε να καταρτίσουμε έναν πίνακα τιμών των δυναμικών των ημιστοιχείων που να χρησιμοποιείται γενικότερα ορίζουμε σταθερές ορισμένες παραμέτρους που επιρρεάζουν την μέτρηση. Μια είναι η θερμοκρασία η οποία επιρρεάζει την ελευθέρωση κατιόντων στο διάλυμα και η άλλη είναι η συγκέντρωση των κατιόντων η οποία πρέπει να είναι 1Μ (αυτή η συγκέντρωση καθιστά αμεληταία την τυχόν ύπαρξη υπολειμμάτων κατιόντων στο νερό)
Για την κατάρτηση των πινάκων αυτών έχει ληφθεί το δυναμικό του προτύπου ηλεκτροδίου υδρογόνου ίση με μηδέν. Τα δυναμικά των ημιστοιχείων είναι δυναμικά αναγωγής
Οι αντιδράσεις αυτές απώλειας ηλεκτρονίων , όπου τα χημικά στοιχεία μετατρέπονται σε κατιόντα είναι αντιδράσεις οξείδωσης.
(Na (g) - e-→ Na+ (g) με ΔΗ = 496 Kcal/mole,)
Όμως για πρακτικούς λόγους χρησιμοποιούμε τις αντίδρασεις με την αντίθετη κατεύθυνση
( Na+ (g) + e- → Na (g) με ΔΗ = - 496 Kcal/mole,
δηλαδή τις αντιδράσεις αναγωγής και δίνονται τα δυναμικά αναγωγής .
Η οξειδωμένη και η ανηγμένη μορφή αποτελούν ένα ζεύγος που λέγεται συζευγμένο ζεύγος οξειδοαναγωγής (Νa+/Na )
Έτσι,
από τα απόλυτα δυναμικά οξειδοαναγωγής των χημικών στοιχείων που απλουστεύονται στην συνέχεια και γίνονται μετρήσιμα, προκύπτουν τα κανονικά δυναμικά οξειδοαναγωγής.
Το δυναμικό οξειδοαναγωγής βλέπουμε εύκολα την ικανότητα των χημικών στοιχείων να απομακρύνουν ηλεκτρόνια όπως είδαμε παραπάνω και σχετίζεται με την ενέργεια ιοντισμού και την ΔΗ.
ΗΛΕΚΤΡΟΧΗΜΙΚΗ ΣΕΙΡΑ ΤΩΝ ΧΗΜΙΚΩΝ ΣΤΟΙΧΕΙΩΝ
Οι πίνακες των τυπικών δυναμικών μας δίνουν πληροφορίες και στοιχεία ηλεκτροχημική δραστηριότητα ενός στοιχείου.
Η ηλεκτροχημική δραστηριότητα ενός στοιχείου εξαρτάται από τον αριθμό οξείδωσής του δηλαδή την τάση να αλλάζει τον αριθμό ηλεκτρονίων της εξωτερικής τους στοιβάδας
Όταν το τυπικό δυναμικό οξειδοαναγωγής είναι αρνητικό το χημικό στοιχείο "προτιμά" να αποβάλλει ηλεκκκτρόνια για να επιτύχει μια σταθερότερη κατάσταση ενώ αντίθετα εάν το κανονικό δυναμικό είναι θετικό το άτομο "προτιμά" να προσλάβει για τον ίδιο λόγο ηλεκτρόνια.
Από τους πίνακες αυτούς, μπορούμε να ταξινομήσουμε τα χημικά στοιχεία ανάλογα με αυτή τους την ιδιότητα δημιουργώντας την ηλεκτροχημική σειρά των στοιχείων,
που ξεκινά από τα χημικά στοιχεία που αποβάλλουν εύκολα ηλεκτρόνια, συνεχίζει με σταιχεία που είναι γενικά σταθερά και συνεχίζει με στοιχεία που εμφανίζουν την τάση να προσλαμβάνουν ηλεκτρόνια από λιγότερο έως πάρα πολύ.
Αυτή η διάταξη σε πολλές περιπτώσεις απαντά σαν δύο σειρές αλλά στην πραγματικότητα πρόκειται για μια συνέχη ταξινόμηση
Πιο συνηθισμένη είναι η σειρά των μετάλλων που είναι σειρά αύξησης των τυπικών δυναμικών των ηλεκτροδίων τους για μισές αντιδράσεις αναγωγής
Ξεκινά από τα πιο ενεργά μέταλλα όπως το λίθιο και το νάτριο ακολουθούν τα βαρύτερα μέταλλα ακολουθούν τα ημισπάνια μέταλλα όπως το μαγνήσιο και ο ψευδάργυρος καταλήγει στα ευγενή μέταλλα
| Li→Cs→Rb→K→Ba→Sr→Ca→Na→Mg |

Δήμητρα Σπανού
ΠΗΓΕΣ
Διαφορά μεταξύ συγγένειας ηλεκτρονίων και ενέργειας ιοντισμού
ΑΤΟΜΙΚΗ ΑΚΤΙΝΑ ΚΑΙ ΕΝΕΡΓΕΙΑ ΙΟΝΤΙΣΜΟΥ
Ατομικό τροχιακό - Βικιπαίδεια
Μοριακό τροχιακό - Βικιπαίδεια
Стандартные окислительно-восстановительные потенциалы полуреакций (справочная таблица)
ΗΛΕΚΤΡΟΧΗΜΕΙΑ - 3.2 ΜΕΤΡΗΣΗ ΔΥΝΑΜΙΚΟΥ ΗΜΙΣΤΟΙΧΕΙΟΥ
ΗΛΕΚΤΡΟΧΗΜΕΙΑ - 3.4 ΜΕΤΡΗΣΗ ΠΡΟΤΥΠΟΥ ΔΥΝΑΜΙΚΟΥ
ΑΚΑΤΕΡΓΑΣΤΟ
- Α. Την σύνδεση των ατόμων μέσω της μετακίνησης ηλεκτρονίων ή της διαφορετικής κατανομής των ηλεκτρονιακών φορτίων με την δημιουργία μοριακών τροχιακών. Δηλαδή μπορούμε να συμπεράνουμε ποιά δύο άτομα που συνδέονται αυξάνει τον αριθμό ηλεκτρονίων του ή το ηλεκτρικό φορτίο του (οξείδωση) ή το ηλεκτρονιακό του φορτίο και ποιο το ελαττώνει (αναγωγή).
Επίσης την περίπτωση όπου το κοινο ηλεκτρονιακό φορτίο κατανέμεται εξ ίσου.
Αυτό όμως που έχει ακόμα μεγαλύτερη σημασία έχει η σύγκριση της διαφοράς δυναμικού ανηγμένης/ οξειδωμένης μορφής -όχι μόνο για την ηλεκτροχημία και για τις οξειδοαναγωγικές χημικές αντιδράσεις που επίσης δεν είναι θέμα που μας αασχολεί σε αυτό το κεφάλαιο- αλλά και για την κατασκευή χημικών ενώσεων από τα χημικά στοιχεία που είναι η συνέχεια για την μελέτη που γίνεται.
'Ετσι χρησιμοποιούμε έναν έμμεσο τρόπο, συγκρίνοντας το δυναμικό αυτό με το δυναμικό ενός άλλου ημιστοιχείου που το ονομάζουμε ημιστοιχείο αναφοράς και εδώ χρησιμοποιούμε αυτό του Υδρογόνου. Το που το βάζουμε σαν βάση και δίνουμε στο δυναμικό
αυτό πραγματοποιείται όταν η διάταξη αποτελεί ένα Συζευγμένα ζεύγη οξειδοαναγωγής τότε αποτελούνται και από πιο σύνθετες διατάξεις
Ηλεκτροαναλυτική Χημεία - ppt κατέβασμα
Κανονικό δυναμικό οξειδοαναγωγής - Βικιπαίδεια