Δήμητρα Σπανού, χημικός, καθηγήτρια Δευτεροβάθμιας Εκπαίδευσης, Οργανική θέση στο 1ο Γυμνάσιο Δάφνης
υπό κατασκευή
σε επεξεργασά
ΕΙΣΑΓΩΓΗ
ΕΝΥΔΡΕΣ ΟΥΣΙΕΣ ΣΤΗΝ ΧΗΜΕΙΑ
Στην Χημεια, ενυδρες ουσίες είναι εκείνες που περιέχουν νερό, τα μόρια του νερού συνδέονται με άλλα μόρια ή ιόντα
- σε αντίθεση με τις ανυδρες-
ΤΥΠΟΙ ΕΝΥΔΡΩΝ ΟΥΣΙΩΝ
Υπάρχουν ανόργανες ένυδρες ενώσεις και οργανικές ένυδρες ενώσεις
Στις ανόργανες ένυδρες το νερό συνδέεται με ανόργανα μόρια ή ιόντα (Ιοντικά ένυδρα)
Στις οργανικές ένυδρες το νερό συνδέεται με οργανικά μόρια
Τα ένυδρα αέρια (κλαθρικά) που σχηματίζονται όταν αέρια εγκλωβίζονται σε υδατικά κρυσταλλικά πλέγματα
Ένυδρα μπορεί να είναι στερεά διαλύματα που περιεχουν μοριακό κρυσταλλικό νερό όπως ανόργανα ένυδρα κρυσταλλικά άλατα.
Ένυδρα επίσης είναι σύμπλοκα που διαθέτουν συνδέτες νερού, κεντρική, γεφυρωμένη ή χηλική σύνδεση
ΣΥΝΔΕΣΙΜΟΤΗΤΑ ΤΩΝ ΜΟΡΙΩΝ ΤΟΥ ΝΕΡΟΥ ΣΤΟΥΣ ΚΡΥΣΤΑΛΛΟΥΣ
ΤΡΟΠΟΣ ΣΥΝΔΕΣΗΣ ΤΟΥ ΝΕΡΟΥ
Στα ένυδρα, το νερό μπορεί να είναι συνδεδεμένο με δεσμούς υδρογόνου ή διαμοριακές δυνάμεις ή να τοποθετείται εσωτερικά (ενσωμέτωση) εάν αυτό σταθεροποιεί το κρυσταλλικό πλέγμα.
ΚΡΥΣΤΑΛΛΩΣΗ ΤΟΥ ΝΕΡΟΥ ΣΕ ΑΝΟΡΓΑΝΕΣ ΣΤΕΡΕΕΣ ΟΥΣΙΕΣ
Α. ΕΝΥΔΡΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ: ΚΡΥΣΤΑΛΛΩΣΗ ΤΟΥ ΝΕΡΟΥ ΣΕ ΣΤΕΡΕΟ ΜΕ ΔΕΣΜΟΥΣ ΥΔΡΟΓΟΝΟΥ
Ενυδάτωση έχουμε επίσης όταν σε στερεές ουσίες, το νερό αποτίθεται σε στερεά και σχηματίζει τις λεγόμενες ένυδρες κρυσταλλικές ουσίες
Το νερό που βρίσκεται δεσμευμένο σε κρυσταλλικά στερεά λάγεται κρυσταλλικό νερό
Η αιτία της δημιουργίας ένυδρων κυσταλλικων ουσιών είναι ξανά οι δεσμοί υδρογόνου, οι οποιοι αναγκάζουν τα μόρια νερού να ευθυγραμμίζονται σε κανονικές γεωμετρικές δομές .
Β. ΣΤΕΡΕΕΣ ΕΝΥΔΡΕΣ ΑΝΟΡΓΑΝΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ ΙΟΝΤΙΚΩΝ ΕΝΩΝΣΕΩΝ. ΣΥΝΔΕΣΗ ΝΕΡΟΥ ΜΕ ΙΟΝΤΑ
Στα ιοντικά ένυδρα τα ιόντα της διαλυμένης ουσίας αλληλεπιδρούν με τα μόρια του νερού και σχηματίζουν μεταξύ τους δεσμούς.
Κατά την διάρκεια της ενυδάτωσης ιοντων, σχηματίζεται γύρω από αυτά ένα κέλυφος από μόρια νερού συνήθως 4 -6. (πρώτη σφαίρα).
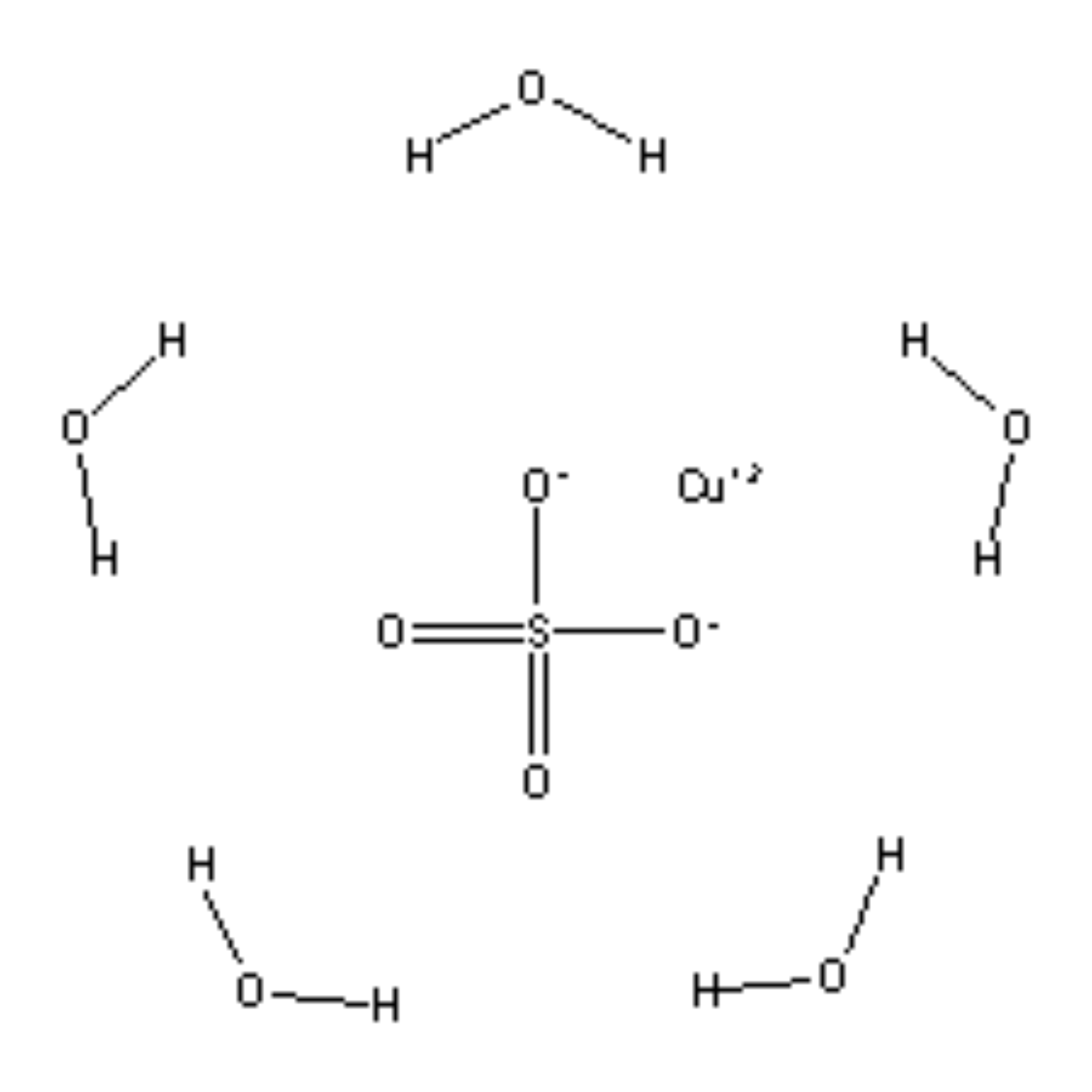
Ένα παράδειγμα ιοντικού ένυδρου είναι το ένυδρο θειϊκό νάτριο Na2SO4 . 5H2O ή Na2SO4 . 10H2O
ή ο ένυδρος θειϊκός χαλκός CuSO4 . 5H2O
Στις ένυδρες κρυσταλλικές ουσίες που στο μόριό τους περιέχουν μόρια νερού στοιχειομετρικά συνδεδεμένο στον κρύσταλλο (νερό κρυστάλλωσης ή ενυδάτωσης). Τα μόρια του νερού της κρυστάλλωσης αναφέρονται στο μόριο ή με έναν συντελεστή μπρoστά στο νερό ή με δείκτη κάτω δεξιά π.χ. CaCl2. 2(H2O) ή CaCl2 (H2O)2
 Στον πενταένυδρος θειϊκός χαλκός, μπορούμε να θεωρήσουμε και τους δύο τρόπους (μοριακό*, ιοντικό). Έχει μορφή μεγάλων λαμπρών κυανών κρυστάλλων
Στον πενταένυδρος θειϊκός χαλκός, μπορούμε να θεωρήσουμε και τους δύο τρόπους (μοριακό*, ιοντικό). Έχει μορφή μεγάλων λαμπρών κυανών κρυστάλλων
Τα τεσσερα μόρια νερού συνδέονται με το άτομο του χαλκού ενώ το 5ο με το θειϊκό ανιόν.
Cu(H20)4]SO4. H2O.
Σε επεξεργασία με θερμοκρασία 100ο ο ένυδρος θειικός χαλκός χάνει 4 μόρια νερού του κρυστάλλου του και θερμοκρασία 200ο διασπάται σε άνυδρο που έχει μορφή λευκής σκόνης.
* Γ. ΕΝΥΔΡΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ ΜΕ ΜΟΡΙΑΚΕΣ ΣΥΝΔΕΣΕΙΣ
Η ένυδρη αμμωνία ΝΗ3.Η2Ο

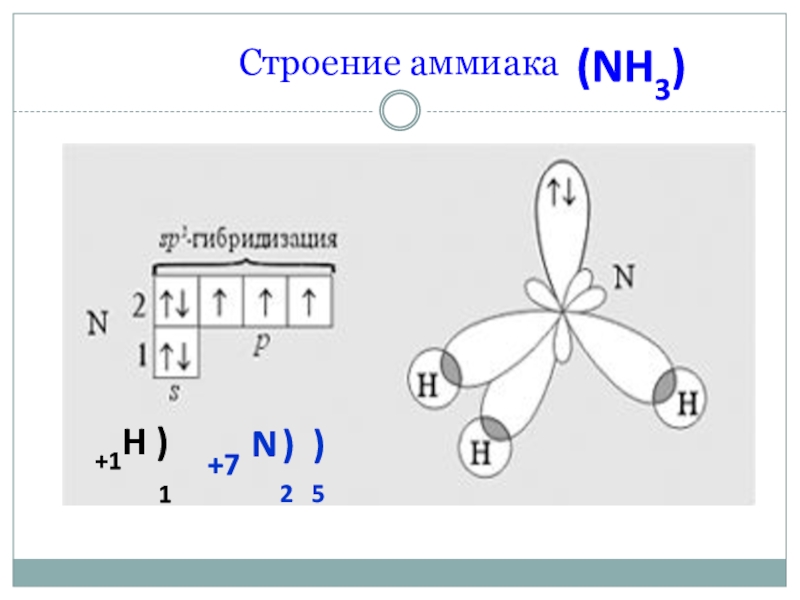
.jpg) Η ένυδρη αμμωνία ΝΗ3.Η2Ο είναι μια διμοριακή κρυσταλλική ουσία (στερεά κρυσταλλικη ουσία) που σχηματίζεται με την προσθήκη νερού (υγρό) σε μόρια αμμωνίας (αέριο).
Η ένυδρη αμμωνία ΝΗ3.Η2Ο είναι μια διμοριακή κρυσταλλική ουσία (στερεά κρυσταλλικη ουσία) που σχηματίζεται με την προσθήκη νερού (υγρό) σε μόρια αμμωνίας (αέριο).
Τόσο η αμμωνία όσο και το νερό σχηματιζουν μεταξύ των μορίων τους δεσμούς υδρογόνου. Γίνεται όμως και σύνδεση μεταξυ των μορίων αμμωνίας και υδρογόνου προς κρυσταλλική ουσια γίνεται με δεσμούς υδρογόνου (Η3Ν-ΗΟΗ). Η ένυδρη κρυσταλλική αμμωνία είναι θερμικά ασταθής και όταν βράζει με καταλύτη ΝαΟΗ αποικοδομείται πλήρως.Το υδατικό διάλυμα δίνει μια ασθενή βάση.
ΑΛΛΕΣ ΠΑΡΟΜΟΙΕΣ ΕΝΥΔΡΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ
-sulfate-heptahydrate-sample.jpg)
-komplex.jpg)
ένυδρη ουσία είναι ο ένυδρος θειϊκός σίδηρος εμφανίζεται σε διάφορες μορφές ενυδάτωσης και κρυσταλλώνεται σε υδατικά διαλύματα που πολλά βρίσκονται στη φυση, με 1, 4, 5,6, 7 μόρια νερού (FeSO4.7Η20) και το ένυδρο άλας αυτό και έχει ένα απαλό πράσινο χρώμα που οφείλεται σε οξείδωση του σιδήρου σε τρισθενή. Με την θέρμανση μόρια νερού χάνονται σταδιακά από τον κρύσταλλο από 60ο έως 300ο που χάνεται το ένυδρο. Στον ξηρό αέρα το κρυσταλλικό νερό χάνεται ευκολότερα από τους 70ο με αποτέλεσμα το μονουδρικό που διασπάται στη συνέχεια σε οξείδιο

Είναι διαλυτό στο νερό (612g/l στους 20ο ) και επίσης διαλύεται στο δικό του κρυσταλλικό νερό στους 58ο. Σε υψηλότερη θερμοκρασία περίπου 58ο
ΕΝΥΔΡΕΣ ΣΥΜΠΛΟΚΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ (ΜΕ ΣΥΝΔΕΤΕΣ ΝΕΡΟ)
Σε ιοντικά ένυδρα, είναι δυνατόν να σχηματιστει και δεύτερο κέλυφος γύρω από το πρώτο κυρίως σε μικρότερα ιοντα. (ένυδρα σύμπλοκα)
Μια σύμπλοκη ουσία είναι ένα σύνθετο σωματίδιο που μπορεί να υπάρξει σε κρύσταλλο ή σε διάλυμα. Διαθέτει ενα κεντρικο άτομο που είναι ο παράγοντας συμπλοκής και αυτό μπορεί να είναι ένα μέταλλο αλλά και κάποιο αμέταλλο στοιχείο κάποιο άτομο οξυγόνου, αζώτου, θείου, ιωδίου και τους προσδέτες, που μπορεί να είναι άτομα ή ομάδες (Η2Ο, CO, NH3, ή ανιόντα ΟΗ-, Cl- κ.λ.π.), που διατάσσονται γύρω απο τον παράγοντα συμπλοκοποίησης. Στην περίπτωση που οι προσδέτες είναι μόρια νερού έχουμε ένυδρα σύμπλοκα.
Το σύμπλοκο σχηματίζει μια εσωτερική σφαίρα που είναι ενα σύνθετο σωματίδιο από τον παράγοντα συμπλοκής και τους προσδέτες του και μια εξωτερική σφαίρα της σύμπλοκης ενωσης από τα υπόλοιπα σωματίδια, που συνδέονται με ιοντικούς ή διαμοριακους δεσμούς με το εσωτερικό σύνθετο σωματίδιο
ΕΝΥΔΡΕΣ ΚΡΥΣΤΑΛΛΙΚΕΣ ΟΥΣΙΕΣ ΧΩΡΙΣ ΤΗΝ ΣΥΝΔΕΣΗ ΤΟΥ ΜΟΡΙΟΥ ΤΟΥ ΝΕΡΟΥ ΣΤΟ ΠΛΕΓΜΑ
Τέτοιες ουσίες είναι οι ζεόλιθοι

ΖΕΟΛΙΘΟΙ
Οι αντικαταστάσεις ατόμων πυριτίου σε πυριτικά άλατα με πεντασθενή ή τρισθενή άτομα (Al), να δημιουργούνται δομές που εμφανίζουν ανισορροπία για με αποτέλεσμα οι πόροι στον κρύσταλλο να μην είναι ίδιων διαστάσεων
Η ασυμμετρία αυτή τους κάνει για να λειτουργούν σαν φίλτρα αλλά και σαν παγίδες μορίων (νερό, αμμωνία) ή κατιόντων (Νάτριο, Κάλιο, Βάριο, Ασβέστιο ,
Τέτοια Ορυκτά Μικροπορώδους υφής, χρησιμοποιούνται στη Χημεία σαν μοριακά κόσκινα, εφόσον οι ουσίες που μπορούν να διέλθουν εξαρτώνται από το μέγεθος και το σχήμα των μικροκαναλιών που σχηματίζονται.ΟΟ γενικός τύπος των ζεολίθων είναι M2/nO AL2O3/x SiO2 yH2O όπου Μ=αλκαλική γαία, n=σθένος κατιόντος, χ=αριθμός από 2 έως 10 y=αριθμός από 2 έως7
 Τα ένυδρα αέρια είναι αέριες ενώσεις χαμηλής πυκνότητας, όπως μεθανιο, υδρόθειο ή διοξείδιο του άνθρακα στις οποιες έχει παγιδευτεί νερό που συνδυάζεται αλλά δεν συνδέεται χημικά. Αυτό έχει σαν αποτέλεσμα να σχηματίζεται ένα κλαθρικό, που είναι ένα στερεό σε συνθήκες χαμηλής θερμοκρασίας και μέτριας πίεσης. Πολύ συνηθισμένο είναι το ένυδρο μεθάνιο. Υδρίτες υπάρχουν στη Γη σε θαλάσσια ιζήματα κάτω από παγετώνες. Πιστεύεται ότι υπάρχουν επίσης και σε στις επιφάνειες άλλωνς πλανητών στις επιφάνειές τους και των δορυφόρων τους σε συνθήκες διαφορετικες από τα κλαθρικά της γης και σε αυτούς ίσως οφείλεται η ελευθέρωση αερίων στις ατμόσφαιρές τους.
Τα ένυδρα αέρια είναι αέριες ενώσεις χαμηλής πυκνότητας, όπως μεθανιο, υδρόθειο ή διοξείδιο του άνθρακα στις οποιες έχει παγιδευτεί νερό που συνδυάζεται αλλά δεν συνδέεται χημικά. Αυτό έχει σαν αποτέλεσμα να σχηματίζεται ένα κλαθρικό, που είναι ένα στερεό σε συνθήκες χαμηλής θερμοκρασίας και μέτριας πίεσης. Πολύ συνηθισμένο είναι το ένυδρο μεθάνιο. Υδρίτες υπάρχουν στη Γη σε θαλάσσια ιζήματα κάτω από παγετώνες. Πιστεύεται ότι υπάρχουν επίσης και σε στις επιφάνειες άλλωνς πλανητών στις επιφάνειές τους και των δορυφόρων τους σε συνθήκες διαφορετικες από τα κλαθρικά της γης και σε αυτούς ίσως οφείλεται η ελευθέρωση αερίων στις ατμόσφαιρές τους. (1).jpg)


