της Δήμητρας Σπανού χημικού, καθηγήτριας Δευτ/θμιας Εκπαίδευσης 1ου Γυμνασίου Δάφνης
για τον Roger Hodgson
τον ιδρυτή του συγκροτήματος supertramp που η μουσική του πάντα γεμίζει το μυαλό και την καρδιά μας
υπό κατασκευή

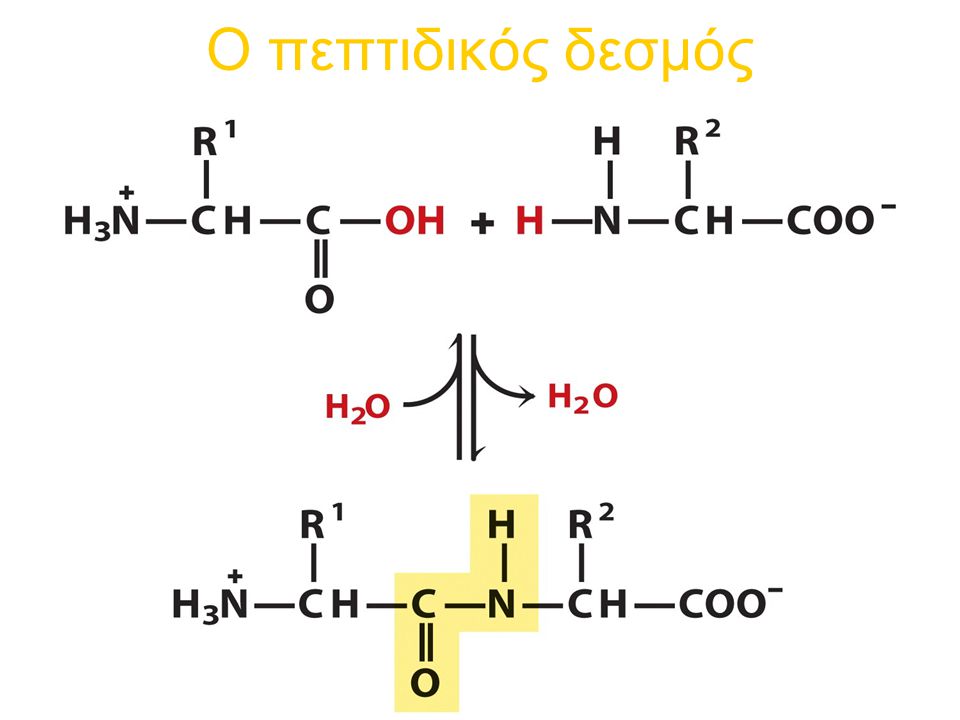
Οι πρωτεϊνες σχηματίζονται από πολυμερισμό α αμινοξέων, που ενώνονται με πεπτιδικό δεσμό αφού πρώτα ενεργοποιηθούν με ακυλομάδα (ακυλοαμινοξέα) και στην συνέχεια αντιδράσουν είτε με αδενυλικό οξύ για πεπτιδικό δεσμό ή με συνένζυμοΑ ή και με φωσφορικό οξύ για σχηματισμό πεπτιδίων, ψευδοπεπτιδίων και αμιδίων.
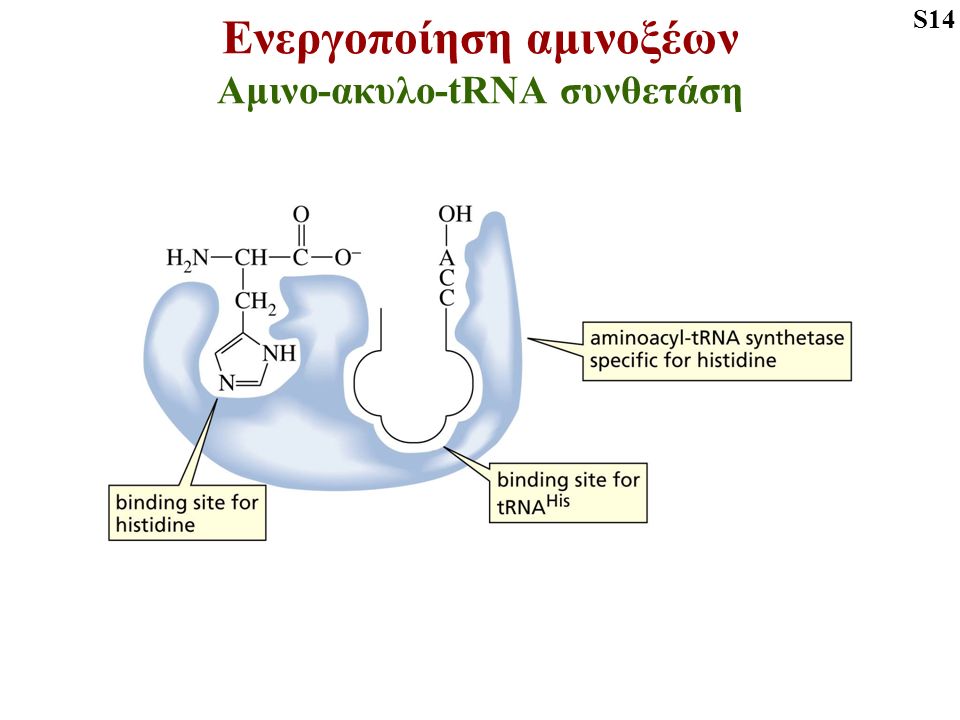
Τα ενεργοποιημένα αμινοξέα μεταφέρονται σε βοηθητικά μόρια t RNA με την βοήθεια ενζυμων που είναι οι αμίνοακύλο tRNA συνθετάσες που καταλύουν την φόρτωση του tRNA με αμινοξύ.
Αυτό συμβαίνει με ταυτόχρονη διάσπαση του ATP ώστε να δημιουργηθούν πλούσιοι σε ενέργεια δεσμοί.
Οι αμινοακύλο tRNA συνθετάσες είναι ένζυμα με μεγάλη εξειδίκευση από τον ρόλο τους στην πρωτεινοσύνθεση , ώστε μπορούν να αναγνωρίσουν μόνο το αντικωδικόνιό του κατά την πρωτεινοσύνθεση στα ριβοσώματα
Ο σχηματισμός των πεπτιδικών αλυσίδων
Η αλληλουχία των αμινοξέων για την σύνθεση της πεπτιδικής αλυσίδας και των πρωτεινών στη συνέχεια παρέχει το mRNA σαν αντίγραφο γονιδίου.
Τα ριβοσώματα που είναι μικρά υποπυρηνικά σωματίδια 15-20 nm διαθέτουν το σύνολο του μηχανισμού για την μεταφραση του κώδικα που περιέχεται στο mRNA σε πρωτείνη.
Τα ριβοσώματα διακρίνονται σε ελεύθερα ριβοσώματα που παράγουν πρωτείνες για τις ανάγκες του κυττάρου, ενώ άλλα είναι εντοπισμένα στο ενδοπλασατικό δίκτυο του κυττάρου και συνθέτουν γλυκοπρωτείνες και εκκριτικές πρωτείνες.
Το μοριακό βάρος των πρωτεινών κυμαίνεται από 5χ103 έως 6χ107.
Ο σχηματισμός του πολύκλοκου μόρίου των πρωτεινών γίνεται σε 4 βήματα, σε κάθε ένα από τα οποία οργανώνεται η δομή της στο πρώτο στάδιο (πρωτοταγής δομή στο δεύτερο στάδιο (δευτεροταγής δομή) ατο τρίτο στάδιο (τριτοταγής δομή) και τέταρτο (τεταρτοταγής δομή)
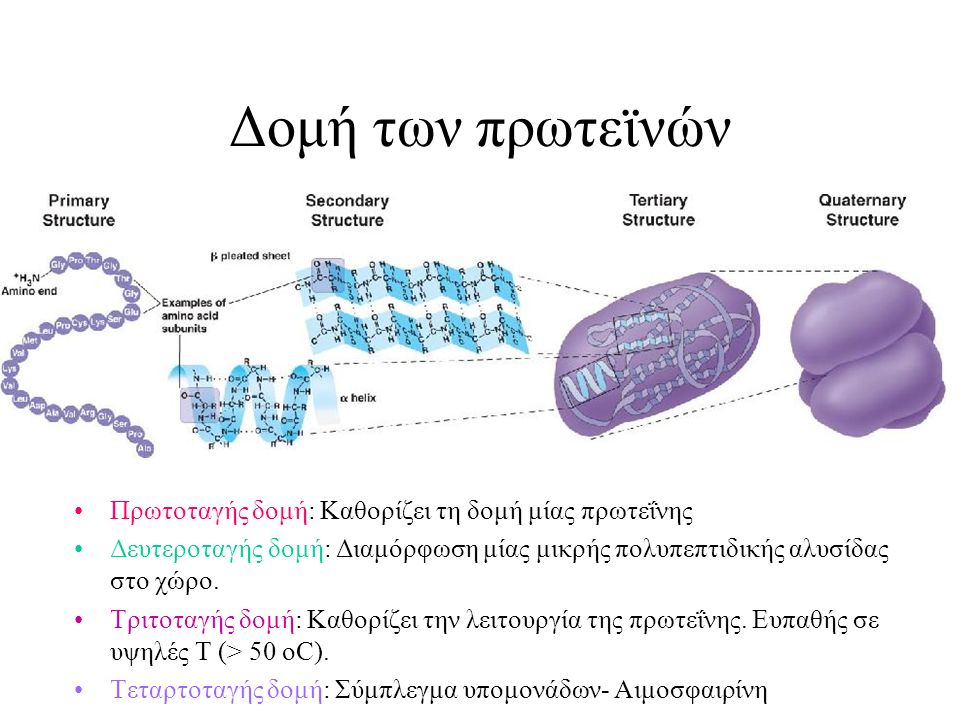
Στην πρωτοταγή δομή, τα αμινοξέα ενώνονται σε καθορισμενη σειρά με δεσμούς πεπτιδικούς,
σχηματίζοντας πεπτιδική αλυσίδα.
Η δευτεροταγής δομή διαμορφώνεται, όταν η αλυσίδα της πρωτοταγούς δομής διατάσεται στον χώρο με τέτοιν τρόπο ώστε ανάλογες ομάδες των αμινοξέων της να έθουν κοντά και να σχηματίσθούν δεσμοί υδρογόνου μεταξύ αζώτου της αμινομάδας ενός αμινοξέος και του οξυγόνου της καρβονυλίου άλλου. αμινοξέος εφόσον το υδρογόνο , το άζωτο και το οξυγόνο του καρβονυλίου βρίσκονται περίπου στην ίδια γραμμή. Η δευτεροταγής δομή περιορίζει την ελευθερία κίνησης των υδρογόνων της ένωσης και έτσι η πεπτιδική αλυσίδα λαμβάνει μια σταθερή διάταξη στον χώρο. Οι διατάξεις αυτές της δευτεροταγούς δομής είναι συνήθως δύο ειδών. Η ελικοειδής και η πριονοειδής. Ακόμα πρωτείνες που δημιουργούν και τις δυο δομές.
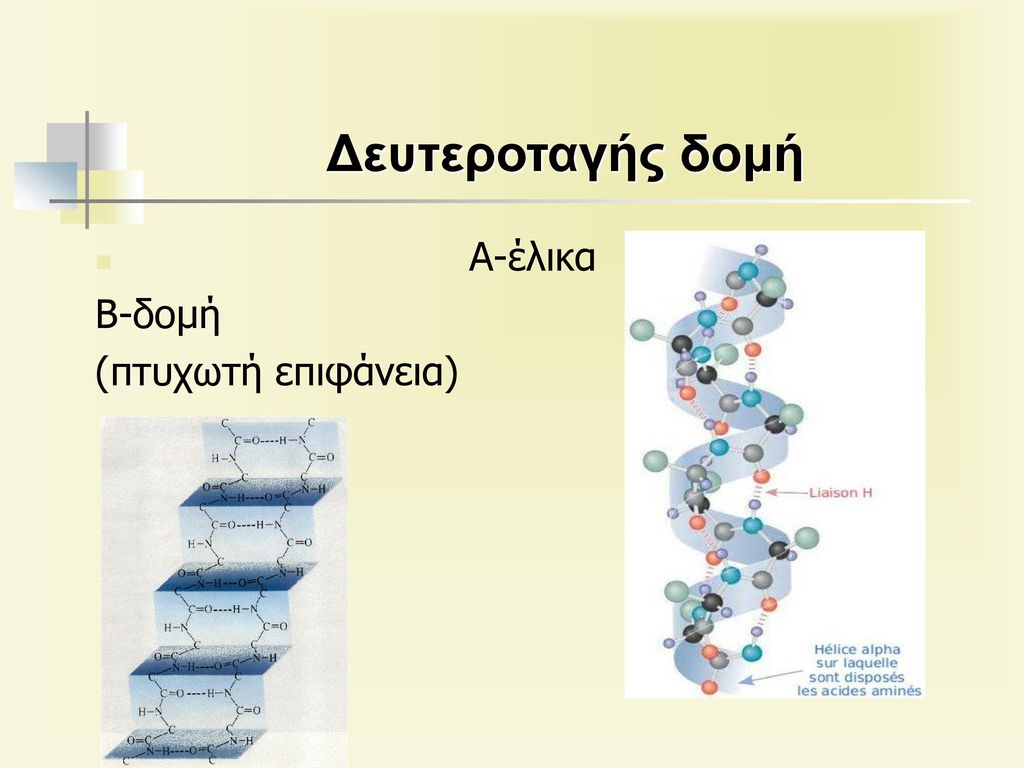
Σχηματισμοί κατά την δευτεροταγή δομή των πρωτεΊνών
Στην δευτεροταγή δομή των πρωτεϊνών έχουμε δυο βασικούς σχηματισμούς , τον ελικοειδή και τον πριονοειδή . Ακόμα
Στην ελικοειδή δομή οι δεσμοί υδρογόνου είναι ενδομοριακοί και είναι ενδιαφέρων ο σχηματισμός α ελικας που συναντάται σε πολλές περιπτώσεις που έχουμε αλληλουχία ορισμένων αμινοξέων μεταξύ αυτών το γλουταμινικό οξύ, η λευκίνη και η αλανίνη, ενώ υπάρχουν αμινοξέα που σπάζουν την α έλικα.
Το βήμα της έλικας αποτελούν αμινιξέα . Μια πλήρης στροφή της έλικας αποτελείται από 3,6 αμινοξέα και το βήμα της έλικας είναι 5,4
Αο. Η περιστροφή κατ' αμινοξύ είναι 100ο.Οι δεσμοί υδρογόνου είναι σχεδόν παράλληλοι στον κύριο άξονα της έλικας.
Εάν πρόκειται για L αμινοξέα, οι πλευρικές αλυσίδες εκτείνονται προς το εσωτερικό της έλικας και η ακριβής δομή της εξαρτάται από την πρωτοταγή δομή της πρωτεϊνης.
Παραδείγματα πρωτεϊνών του οργανισμού με α έλικα έχουμε τις πρωτείνες των μαλιών του κεφαλιού, της μυοσίνης, του ινώδους, της αιμοσφαιρίνης.
Στην πριονωειδή δομή ορισμένα αμινοξέα, όπως η βαλίνη, η μεθειονίνη και η ισολευκίνη χρησιμεύουν σαν πυρήνες για τον σχηματισμό αυτής της δομής. σχηματίζονται δεσμοί υδρογόνου μεταξύ δυο διαφορετικών πεπτιδικών αλυσίδων. Εδώ οι δεσμοί υδρογόνου είναι σχεδόν κάθετοι στην διεύθυνση ανάπτυξης της πεπτιδικής αλυσίδας .
Ώστε σε όλες τις περιπτώσεις εφόσον η αλληλουχία των αμινοξέων είναι γενετικά προκαθορισμένη άρα η χωροδιάταξη είναι επίσης γενετικά προκαθορισμένη
οι δυο δομές ελικοειδής και πριονοειδής δίνουν χαρακτηριστικό διαφορετικό φάσμα στην υπέρυθρο ακτινοβολία.
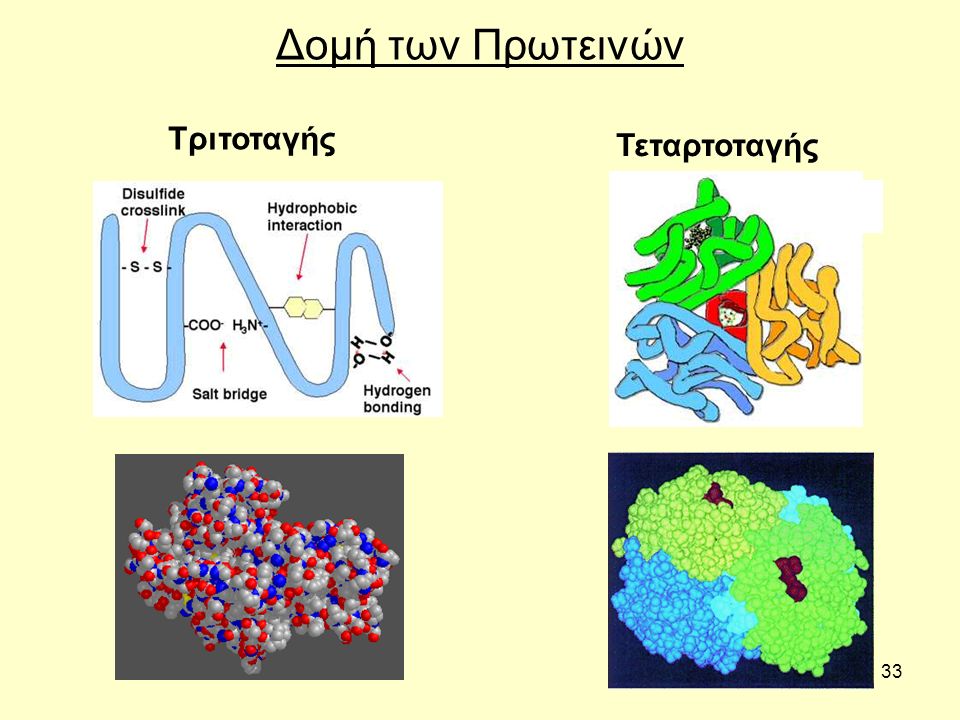
Η τριτοταγής δομή μιας πολυπεπτιδικής αλυσίδας αφορά τον τρόπο αναδίπλωσης της έλικας
και γίνεται μεταξύ πλευρικών αλυσίδων
1. με την δημιουργία είτε ομοιοπολικών δεσμών -S-S- μεταξύ δύο κυστεινών μιας ή δύο πολυπεπτιδικών αλυσίδων
2. με μη ομοιοπολικούς δεσμούς: δεσμούς υδρογόνου, μεταξύ δυο πεπτιδικών δεσμών, δεσμοί υδρογόνου μεταξύ πλευρικών αλύσων, ιοντικοί δεσμοί, απολικοί ή υδρόφοβοι δεσμοί.
Στους υδρόφοβους δεσμούς, που δημιουργείται με πλησίασμα πλευρικών ομάδων οι δυνάμεις που αναπτύσσονται είναι παρόμοιες με αυτές που δρουν ενώ συγκρατούν τα μόρια ενός κρυστάλλου.
Στην Τεταρτοταγή δομή περισσότερες από μια πολυπεπτιδικές αλυσίδες συμβάλουν στον σχηματισμό ενός μορίου πρωτείνης. Οι αλυσίδες αυτές είναι ανεξάρτητες εφόσον δεν ενώνονται με ομοιοπολικό δεσμό -S-S- ή δεσμό υδρογόνου κ.λ.π. Με την τεταρτοταγή δομή η πρωτείνη αποκτά συγκεκριμένη διάταξη στον χώρο.
Στην μυοσφαιρίνη έχουμε τέσσερα ελικοειδή κομμάτια αλυσίδων που συγκρατούνται με δευτερεύοτες δεσμούς από μια προσθετική ομάδα την αίμη. Οι ανοσοσφαιρίνες δίνουν χαρακτηριστικό τύπο β πτυχωτής (πριονωτής) επιφάνειας. Οι αφυδρογονάσες έχουν α έλικες και πριονωτές επιφάνειες σε περιοχές
Διαλυτότητα των πρωτεϊνών , φύση του διαλύτη
Η διαλυτότητα των πρωτεινών οφείλεται στην ενυδάτωση των πρωτεϊνών.
Τα άλατα επιδρούν στην διαλυτότητα των πρωτεϊνών, γιατί είναι υπεύθυνα για την ιοντική ισχύ άρα επιρρεάζουν τις ενδομηλεκτροστατικές επιδράσεις των πρωτεϊνών, επιδρούν απευθείας με ορισμένα αμινοξέα (λυσίνη , αργινίνη, γλουταμινικό, ασπαρτικό), δρουν σε ειδικές ομάδες των πρωτεϊνών (πεπτιδικοί δεσμοί, υδροξύλια, αμίδια , καρβοξυλικές ομάδες), σχηματίζουν μη πολικές επιδράσεις μεταξύ υδρόφοβων κατάλοιπων όπως (σουλφονικών καρβοξυλικών αμμωνιακών)
Άλατα που σταθεροποιούν πρωτεϊνες επιδρούν ασθενώς με αυτές με μη ειδικούς δεσμούς και εμπλουτίζουν την ενυδάτωσή των πρωτεινών
ενώ άλατα που αποσταθεροποιούν πρωτείνες επιδρούν ισχυρά στα μόριά τους με ειδικούς δεσμούς και μειώνουν την ενυδάτωση των πρωτεινών
Τ α άλατα όταν είναι σε χαμηλές συγκεντρώσεις ιόντα που προέρχονται από την διάσταση των αλάτων αυτών, επιδρούν με πρωτεινικά μόρια με μη ειδικές ηλεκτροστατικές δυνάμεις, με αποτέλεσμα την εξουδετέρωση ηλεκτροστατικών πρωτεϊνικών δυνάμεων των πρωτεινικών φορτίων.
Αυτό επιδρά συνήθως σταθεροποιητικά στην πρωτεινική δομή. (salting in)
Τέτοια είναι κυρίως ανιόντα όπως F-, Cl- , SO4- -
Αντίθετα τα ανιόντα όπως των NaSCN , NaClO
Η ύπαρξη αλάτων σε υψηλές συγκεντρώσεις μειώνει την διαλυτότητά τους και ευνοεί την καταβύθιση των πρωτεινών (salting out). Αυτό συμβαίνει γιατί η περίσσεια των αλάτων που δεν αλληλεπιδρούν με την πρωτείνη δρα ανταγωνιστικά με την πρωτείνη ως προς την αλληλεπίδραση με το διάλυμα. Η πρωτείνη δημιουργεί συσσωματώματα και καθιζάνει από το διάλυμα.
Tο salting out αποτελεί επίσης τεχνική απομόνωσης πρωτεινών.
Aλατα σε υψηλές συγκεντρώσεις >1Μ αντιδρούν με ειδικούς δεσμούς και επιρρεάζουν αρνητικά την σταθερότητα των πρωτεϊνων. Τείνουν να σπάσουν τους δεσμούς υδρογόνου και αποδιατάσουν τα μόρια της πρωτείνης
Παρ όλα αυτά, κάποια από τα άλατα αυτά σε επιρρεάζουν τι υδροφοβικές αλληλοεπιδράσεις υδροφοβικών αμινοξέων και ενισχύεται η διαλυτότητά τους σε υδατικά διαλύματα
Γενικότερα,
Στην τριτοταγή δομή παίζουν ρόλο οι απολικοί δεσμοί που συμβαίνουν μεταξύ υδρόφοβων ομάδων της πρωτείνης με μόρια νερού. Μια τέτοια ομάδα μπορεί να είναι μια αλειφατική πλευρική περιοχή που μέσα στο νερό προκαλεί ανάλογη αλλαγή στην διάταξη των μορίων του νερού γύρω της, διασπά την οργάνωση των μορίων του νερού και αυτό αυξάνεινει την εντροπία του συστήματος ΔΕ >0. Αυτό ευνοεί τον σχηματισμό απολικών δεσμών.
Μεταξύ πολικών ομάδων πλευρικών αλυσίδων της πρωτεϊνης αλλά κυρίως πολικές πλευρικές ομάδες με μόρια διαλύτη . Το ίδιο συμβαίνει και με τους δεσμούς υδρογόνου. Όμως εάν οι δεσμοί υδρογόνου με τον διαλύτη είναι πολύ ισχυροί τότε δεν ευνοείται η δημιουργία της α έλικας.
Μετουσίωση πρωτεινών
Εάν για κάποιους λόγους αυτή η διάταξη μετατραπεί, γίνεται δηλαδή αποδιάταξη ,τότε έχουμε μετουσίωση των 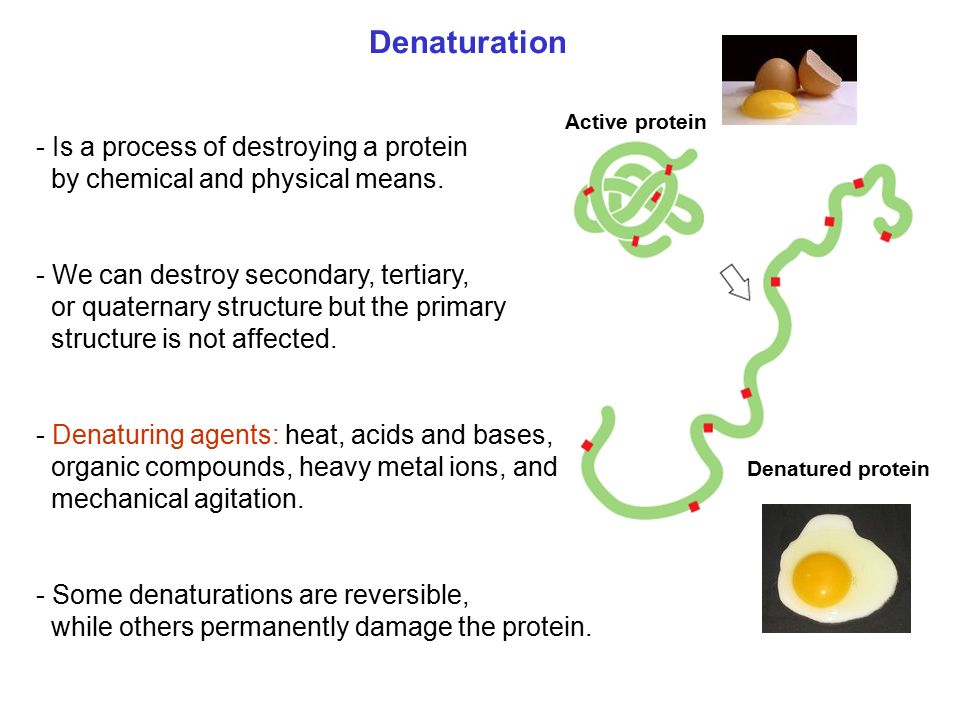

πρωτείνών. Καταστρέφονται ή επιρρεάζονται οι δεσμοί υδρογόνου, οι υδροφοβικοί δεσμοί και οι ιοντικοί δεσμοί.
Κατά την μετουσίωση έχουμε αποδιάταξη της υψηλής οργάνωσης προς την κατάσταση της αταξίας και του τυχαίου. Ταυτόχρονα μεταβάλεται και η βιολογική δράση της πρωτείνης.
Οι λόγοι μετουσίωσης μιας πρωτείνης μπορεί να είναι η θερμότητα, η πίεση , η μηχανική κατεργασία, οι οργανικοί διαλύτες, το PH , η ακτινοβολία,
Κατά την μηχανική κατεργασία ο βαθμός αποδιάταξης εξατράται από την ελαστικότητα των πρωτεϊνών
Κατά την αποδιάταξη μέσω πίεσης η αποδιάταξη εξαρτάται από τον τρόπο πακεταρίσματος των πρωτεϊνών και την ενυδάτωση, Ινώδεις πρωτεϊνες είναι καλύτερα πακεταρισμένες από τις σφαιρικές.
Κατά την αναδιάταξη λόγω θερμικής κατεργασίας είναι άλλωτε αντιστρεπτή κι άλλωτε όχι. Υπάρχει μια κρίσιμη θερμοκρασία, πάνω από την οποία οι πρωτε"ινες μεταβαίνουν απότομα από την φυσική στην αποδιατεταγμένη κατάσταση. (θερμοκρασία τήξης ή αποδιάταξης της πρωτείνης). Επειδή οι δεσμοί που καταστρέφονται εδώ είναι εξώθερμοι (υδρογόνου, van der walls, ηλεκτροστατικοί, η αποσταθεροποίηση γίνεται σε πολύ υψηλές θερμοκρασίες.
Τα απορρυπαντικά είναι ισχυροί αποδιατακτικοί παράγοντες. Τα απ.ορρυπαντικά προκαλούν συνήθως μη αντιστρεπτή μεταβολή. Τα απορρυπαντικά έχουν την δυνατότητα να σχηματίζουν χημικές γέφυρες μεταξύ υδροφιλικών και υδροφοβικών περιβάλλοντων και έτσι εξουδετερώνουν τις υδρόφοβες δυνάμεις που απαιτούνται για την διτήρηση της δομής της πρωτεϊνης.
Αποδιάταξη πρωτεϊνών σε οργανικούς διαλύτες. Οργανικοί δικαι αυτό έχει συνέπεια την εξασθένηση των υδροφοβικών επιδράσεων της πρωτείνης, με αποτέλεσμα αλύτες όπως η ακετόνη ή η αλκοόλη μπορούν να προκαλέσουν αναδιάταξη των πρωτεϊνών που εξαρτάται από τον βαθμό επίδρασης του σε πολικές και μη πολικές ομάδες της πρωτεϊνης. Οργανικοί διαλύτες σχηματίζουν δεσμούς μεταξύ πλευρικών ομάδων των πρωτεϊνών ισχυρότερους από αυτούς με το νερό και έτσι εξασθενούν οι υδροφοβικές αλληλοεπιδράσεις της πρωτείνης, απαραίτητες για την διατήρηση της δομής της.
Σε χαμηλές συγκεντρώσεις ωστόσο οργανικοί διαλύτες δρουν σαν σταθεροποιητές, αντίθετα οι ίδιοι σε υψηλές δρουν διαλυτικά για την πρωτεϊνη.
Οι μετουσιωτικές (αποδιατακτικές) ουσίες είναι ανταγωνιστές δεσμών υδρογόνου όπως πυκνά διαλύματα ουρίας, γουανιδίικά άλατα , φορμαμίδια ανταγωνίζονται τους δεσμούς υδρογόνου του νερού και τους ενδομοριακούς της πρωτείνης ώστε να αποδιατάσεται η πρωτεϊνη.
Το PH επιρρεάζει και τον διαλύτη και την διαλυμένη ουσία.
Σε ένα ζωντανό κύτταρο η μετουσίωση πρωτεινών έχει συνέπεια την διακοπή των λειτουργιών τους έως και τον κυτταρικό θάνατο, εφόσον οι μετουσιωμένες πρωτείνες χάνουν την τρισδιάστατη δομή τους , σε ορισμένες περιπτώσεις εμφανίζεται απώλεια διαλυτότητας ή και συσσώρευση λόγω έκθεσης των υδρόφοβων ομάδων. τους.

Οι δεσμοί υδρογόνου αλλά και οι δισουλφιρικοί δεσμοί, οι μη πολικές υδρόφοβες ομάδες που συντελούν στην αναδίπλωση της πολυπεπτιδικής αλυσίδας, οι οποίοι είναι μάλλον αδύναμοι επιρρεάζονται από την θερμότητα, τα οξέα, τις συγκεντρώσεις ορισμένων ουσιών κ.α. , σπάνε και δημιουργούνται άλλοι σε άλλα σημεία τελείως τυχαία, Αυτό έχει συνέπεια την μεταβολή της στερεοχημικής της δομής. Κατά την μετουσίωση καταστρέφονται η τεταρτοταγής, τριτοταγής έως και δευτεροταγής δομή όχι όμως η πρωτοταγής γιατί η επιδράσεις της μετουσίωσης δεν είναι αρκετά ισχυρές για να επιρρεάσουν και τους πεπτιδικούς δεσμούς.
Η θερμότητα επιρρεάζει τους δεσμούς υδογόνου και τις μη πολικές υδρόφοβες αλληλεπιδράσεις λογω της εντοονότερης κίνησης των μορίων λόγω αύξηση θερμοκρασίας

Το αλκοόλ διαταράσσει τους δεσμούς υδρογόνου των αμιδικών ομάδων μεταξύ πλευρικών αλυσίδων
Αλλοεστερική ρύθμιση
Με την δέσμευση μικρών μορίων είναι δυνατόν να αλλάξει η στερεοχημική δομή μιας πρωτείνης. Αυτό το φαινόμενο παίζει σημαντικό ρόλο στην ρύθμιση της ενζυματικής δραστηριότητας με την επίδραση στο ενεργό κέντρο του ενζύμου
Αντιστρεπτότητα μετουσίωσης
Η μετουσίωση είναι μια αντίδραση ενδόθερμη αλλά πάνω από μια ορισμένη κρίσιμη θερμοκρασία γίνονται ενδόθερμες
Υπάρχει αντιστρεπτή και μη αντιστρεπτή μετουσίωση.
Εφόσον η πρωτοταγής δομή διατηρείται, σε ορισμένες συνθήκες η πρωτείνη μπορεί να ανασυνταχθεί με βάση τις φυσικοχημικές ιδιότητες των δεσμών.
Σε πολλές περιπτώσεις, η αποδιάταξης πρωτεϊνών λόγω πίεσης είναι ανατρέψιμη. Τα περισσότερα ένζυμα σε αραιές συγκεντρώσεις που υπέστησαν αποδιάταξη λόγω πίεσης, αποκτούν την ενεργότητά τους σε αρκετές ώρες.
Κρυστάλλωση πρωτεϊνών

Είναι ο σχηματισμός κρυστάλλου πρωτείνης που συμβαίνει υπό παράγοντες όπως το PH, η συγκέντρωση, οι κατακρημνηστές και τα πρόσθετα.
Τα ρυθμιστικά διαλύματα και θειικό αμμώνιο και η πολυαιθύλενογλυκόλη (κατακρημνιστές πρωτεινών) είναι απαραίτητοι για τον σχηματισμό κρυστάλλων .
Το διάλυμα της πρωτεϊνης πρέπει να είναι υπερκορεσμένο. Μόρια πρωτεϊνης μπορεί να πακεταριστούν σε επαναλαμβανόμενη συστοιχίες. Ένας συνηθισμένος κρύσταλλος έχει 1015 έως 1018 μόρια πρωτείνης.
Η κρυσταλλοποίηση πραγματοποιείται κυρίως σε νερό.
Η έκθεση σε ακτίνες Χ παρέχει ένα σχέδιο περίθλασης από το οποίο μπορεί να διακριθεί η τριτοταγής δομή της πρωτείνης.
Πρωτεϊνες υπάρχουν απλές και συζευγμένες
από τις απλές που αποτελούνται μόνο από α αμινοξέα έχουμε
τις λευκωματίνες ή αλβουμίνες. Διαλυτές στο νερό και σε αραιά διαλύματα αλάτων, κροκιδώνονται όταν θερμανθούν. Στον ανθρώπινο οργανισμό έχουμε την λευκωματίνη στον ορό του αίματος, την λακταμβουμίνη στο γάλα, το μυογόνο στους μύες. Μερικές λαμβάνονται σε κρυσταλλική μορφή.
Οι σφαιρίνες, Ελάχιστα διαλυτές στο νερό διαλύονται σε διαλύματα αλάτων συνήθως περιέχουν γλυκίνη. Αρκετές έχουν ληφθεί σε κρυσταλλική μορφή. Απαντούν στον ανθρώπινο οργανισμό σαν σφαιρίνες στον ορό του αίματος, στους μύες.
Αλββουμινοειδή ή σκληροπρωτεείνες. Ζωϊκής προελευσης ,σχεδόν αδιάλυτες στο νερό είναι οι κερατίνες στις τρίχες που περιέχουν πολλά βασικά αμινοξέα και θειοαμινοξέα, και τα κολλαγόνα των τένοντων των οστών και του συνδετικού ιστού, που παρατεταμένος βρασμός με νερό τα μετατρέπει σε πηκτή και περιέχουν γλυκίνη, προλίνη και υδόξυπρολίνη.
Πρωταμίνεα. Μικρού μοριακού βάρους διαλύονται σε νερό , διαλύματα οξέων , βάσεων, αραιά αμμωνία. Βασικές, δεν κατακρημνήζονται, αλλά λόγω της βασικότητάς τους, κατακρημνίζουν άλλες πρωτείνες σε διαλύματα
Ιστόνες. Σχετικά μικρό μοριακό βάρος ποικίλει η διαλυτότητά τους σε νερό και αραιά διαλύματα αλκαλίων και οξέων. Αδιάλυτες στην αμμωνία. λόγω της βασικότητάς τους . Βρίσκονται στους ιστούς συνδεδεμένες με οξέα όπως με τα νουκλεινικά οξέα (συνδέονται DNA και δημιουργούν νουκλεοσώματα). Στην αιμοσφαιρίνη η γλοβίνη είναι ιστόνη.
και τελειώνοντας αφιερώνουμε στους φίλους μας τους στοίχους του τραγουδιου 'Κύριος ήρθα και κύριος φεύγω" του Τάκη Μουσαφίρη που ερμηνεύει ο Στράτος Διονυσίου

Κύριος ήρθα και κύριος φεύγω
Κύριος ήρθα και κύριος φεύγω
εγώ σ’ αγάπησα, εγώ σε τίμησα
εγώ σε πρόσεξα και σε σεβάστηκα
Κύριος ήρθα και κύριος φεύγω
Κύριος ήρθα και κύριος φεύγω
εγώ σ’ αγάπησα, εγώ σε τίμησα
εγώ σε πρόσεξα και σε σεβάστηκα
Κύριος ήρθα και κύριος φεύγω
ΠΗΓΕΣ
ΙΑΤΡΙΚΗ ΧΗΜΕΙΑ Ε.ΜΟΙΡΑ
Βιοχημεία Peter Karlson
https://el.wikipedia.org/wiki/%CE%91%CE%BC%CE%B9%CE%BD%CE%BF%CE%BE%CE%AD%CE%B1
https://slideplayer.gr/slide/11368753/
https://www.biologydiscussion.com/organism/dna-and-eukaryotic-organisms-with-diagram/50875
https://en.wikipedia.org/wiki/Denaturation_(biochemistry)
https://chemistry.elmhurst.edu/vchembook/568denaturation.html
https://eclass.uoa.gr/modules/document/file.php/BIOL199/3_ASKISI_13.pdf
https://en.wikipedia.org/wiki/Protein_crystallization
https://biophysics.biol.uoa.gr/courses/biophysics/crystallization/crystallization.htm

