της Δήμητρας Σπανού καθηγήτριας Χημικού στην Β/θμια Εκπαίδευση
υπό κατασκευή
Εδώ θα περιγράψουμε έναν άλλο κύκλο πολύ πιο γενικό και ολοκληρωτικό που συμπεριλαμβάνει κάθε χημική μεταβολή στο άβιο και έμβιο περιβάλλον.
Τον κύκλο των ηλεκτρονίων.
Τι είναι τα ηλεκτρόνια και πια ηλεκτρόνια μετακινούνται μεταξύ των υλικών σωμάτων
Τα ηλεκτρόνια είναι ένα από τα θεμελιώδη υποατομικά σωματίδια της ύλης με αναλοίωτη (στοιχειώδη) μάζα 9,109,10-31kg και είναι αρνητικά ηλεκτρικά φορτισμένο με φορτίο 1,6 ,10-19Cb
Τα ηλεκτρόνια στα άτομα περιστρέφονται ταχύτατα σε τροχιές διαβαθμισμένων ενεργειών γύρω από μια κεντρική περιοχή που αποτελείται από άλλα μεγαλύτερα σωματίδια , τα πρωτόνια και τα νετρόνια και ονομάζεται πυρήνας.
Τα πρωτόνια του πυρήνα ενός ατόμου είναι επίσης φορτισμένα σωματίδια με θετικό φορτίο, κατ΄ απόλυτη τιμή ίσο με το φορτίο του ηλεκτρονίου και ίσα σε αριθμό με τα ηλεκτρόνια που περιστρέφονται στις στοιβάδες.
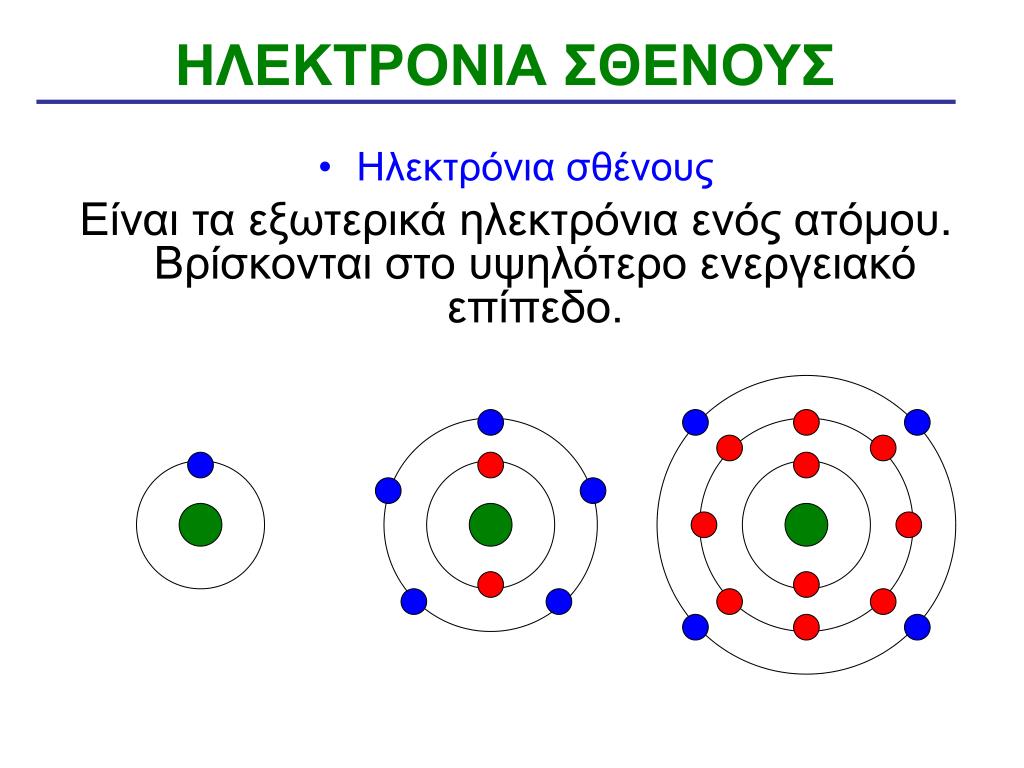
Από τα ηλεκτρόνια που μπορούν να αλλάξουν θέση και δυναμικά είναι κυρίως αυτά της εξωτερικής στοιβάδας των ατόμων που λέγονται ηλεκτρόνια σθένους. Αυτά καθορίζουν την φυσική και χημική συμπεριφορά των ατόμων όπως και τις μετακινήσεις και τους κύκλους μέσα στην ύλη
Όπως καταλαβαίνουμε στο άτομο με τον θετικά φορτισμένο πυρήνα και τα αρνητικά ηλεκτρόνια των στοιβάδων αναπτύσσεται ηλεκτρικό πεδίο και ηλεκτρικά δυναμικά σε διάφορα σημεία του
Έτσι στο πεδίο αυτό αναπτύσσονται ηλεκτρικές δυνάμεις που δυσχεραίνουν ή διευκολύνουν την κίνηση ηλεκτρονίων.
Εδώ μπορούμε να υπολογίσουμε την ατομική ακτίνα, την ενέργεια ιοντισμού και την ηλεκτροσυγγένεια που καθορίζουν την συμπεριφορά του ατόμου.
Δεδομένου ότι η έλξη που ασκεί ο πυρήνας σε κάθε ένα ηλεκτρόνιο εξαρτάται από την απόσταση αυτού από τον πυρήνα (ατομική ακτίνα)και από το ν αριθμό πρωτονίων του πυρήνα (πυρηνικό φορτίο) η συμπεριφορά των ηλεκτρονίων εξαρτάται από την θέση του στοιχείου στον περιοδικό πίνακα
Ο κύκλος των ηλεκτρονίων των ατόμων αφορά το άβιο και το έμβιο περιβάλλον
Όπως αναφέρθηκε η κίνηση των ηλεκτρονίων και οι κύκλοι τους συμπεριλαμβάνουν κάθε χημική μεταβολή στο άβιο και έμβιο περιβάλλον. Εφόσον:
-Οι φυσικοί και χημικοί νόμοι που διέπουν τα έμβια συστήματα είναι ίδιοι που διέπουν τα άβια
-Hχημική σύσταση και οι μεταβολικές διαδικασίες όλων των ζωντανών οργανισμών είναι σε μεγάλο βαθμό όμοιες , παρά τις μεγάλες αποκλίσεις που παρατηρούνται
Άλλα ηλεκτρόνια απομακρύνονται εντελώς από το άτομο κι άλλα μεταφέρουν μέρος του ηλεκτρονιακού τους φορτίου σε άλλο άτομο
Τα ηλεκτρόνια μπορεί να μετακινηθούν μόνιμα και χωρίς επιστροφή, από το άτομο που βρίσκονται προς κάποιο άλλο άτομο. Το αρχικό άτομο , το οποίο που είναι δότης ηλεκτρονίων, έτσι οξειδώνεται και υφίσταται μόνιμη χημική αλλοίωση.
Ωστόσο σε πολλές περιπτώσεις το ηλεκτρόνιο δεν μεταφέρεται πλήρως αλλά μεταφέρει ένα κλάσμα μόνο του ηλεκτρονιακού του φορτίου και προκύπτει συντονισμός του ηλεκτρονίου του δότη και του δέκτη. Αυτό οδηγεί πολλές φορές στον σχηματισμό συμπλόκου μεταξύ του δότη και του δέκτη οι οποίοι διατηρούν σε μεγάλο βαθμό την χημική τους ταυτότητα
Ένας τρόπος να μελετηθούν οι ιδιότητες των στοιχείων, που σχετίζονται με την κίνηση των ηλεκτρονίων σθένους, είναι να μετρήσουμε υπό ποιες συνθήκες μπορούν αυτά να μεταβληθεί η έλξη από τον πυρήνα τους ή και να ξεφεύγουν από την έλξη του πυρήνα τους , και το άτομο να μετατραπει σε ιόν. Αυτά αναφέρονται στην ενέργεια ιοντισμού και την ηλεκτροχημική συγγένεια
Απομάκρυνση ενός ηλεκτρονίου από ελεύθερο άτομο (έως το άπερο)ι
Ενέργεια ιοντισμού ενός στοιχείου Χ και ηλεκτροθετικότητα
Η ενέργεια ιοντισμού ενός στοιχείου είναι η ελάχιστη ενέργεια που απαιτείται για την απόλυτη απομάκρυνση ενός ηλεκτρονίου από ελεύθερο άτομο (έως το άπειρο) από το υψηλότερα κατειλημμένο τροχιακό.
Αυτό υπολογίζεται με τα άτομα του στοιχείου να βρίσκονται σε θεμελιώδη κατάσταση και σε αέρια κατάσταση ώστε το στοιχείο αυτό να μετατραπεί σε ιόν.
Κάθε ηλεκτρόνιο του ατόμου βρισκεται στο ηλεκτροστατικό πεδιο του πυρήνα και αν η μέση απόσταση από αυτόν είναι α το δθναμικό στο σημείο αυτό είναι
Για να απομακρυνθεί από τον πυρήνα εφόσον υπάρχει έλξη απαιτείται ενέργεια και η απομάκρυνση αυτή είναι
ενδόθερμη διαδικασία . Αν συνυπολογίσουμε και άλλους παράγοντες όπως η έλξη άλλων ηλεκτρονίων ή οι κινητικές ενέργεις και θεωρήσουμε ότι η απομάκρυνση γίνεται αδιαβατικά (δεν υπάρχει ανταλλαγή θερμότητας) αυτή η ενέργεια είναι η ενέργεια ιοντισμού. Σε άλλα στοιχεία η απομάκρυση είναι ευκολότερη και σε άλλα όχι.
. Η ενέργεια αυτή μπορεί να προσφερθεί από φωτόνια, άλλα ηλεκτρόνια ή σωματίδια.
Τα μέταλλα που έχουν λίγα ηλεκτρόνια στην εξωτερική τους στοιβάδα έχουν σχετικά χαμηλές ενέργειες ιοντισμού και έτσι ευκολότερα αποβάλλουν τα ηλεκτρόνια σθένους και μετατρέπονται σε θετικά ιόντα.
Χαρακτηρίζονται σαν ηλεκτροθετικά στοιχεία.
Na (g) - e-→ Na+ (g) με ΔΗ = 496 Kcal/mole,
ενώ σε άλλα δυσκολότερα
F (g) - e-→ F+ (g) με ΔΗ = 1680 Kcal/mole,
στα ευγενή αέρια είναι ακόμα πιο δύσκολο
Ne (g) - e-→ Ne+ (g) με ΔΗ = 2080 Kcal/mole,
Γενικεύοντας η τάση που έχουν τα στοιχεία να αποβάλλουν ηλεκτρόνια λέγεται ηλεκτροθετικότητα
Συμβολίζεtαι με Ει και ταυτίζεται με την μεταβολή της Ενθαλπίας ΔΗ, κατά την μεταφορά ενός ηλεκτρονίου από την θέση του στο άπειρο και έχει μονάδες kj/mol
. Η ενέργεια αυτή μπορεί να προσφερθεί από φωτόνια, άλλα ηλεκτρόνια ή σωματίδια.
Μετακίνηση ηλεκτρονίων σε άλλα άτομα ώστε τα άτομα με μοίρασμα ή μονομερή προσφορά ηλεκτρονίων να αποκτούν ηλεκτρονική δομή ευγενούς αερίου
Ηλεκτροσυγγένεια και ηλεκτραρνητικότητα
Σε πολλές περιπτώσεις το ηλεκτρόνιο δεν μεταφέρεται πλήρως κάπου αλλού, αλλά μεταφέρει ένα κλάσμα μόνο του ηλεκτρονιακού του φορτίου και προκύπτει συντονισμός του ηλεκτρονίου του δότη και του δέκτη. Αυτό οδηγεί πολλές φορές σε σύνδεση και στον σχηματισμό συμπλόκου μεταξύ του δότη και του δέκτη οι οποίοι διατηρούν σε μεγάλο βαθμό την χημική τους ταυτότητα. Από την σύνδεση αυτή μεταβάλεται η ενέργεια του ατόμου που δέχεται ηλεκτρόνιο και αυτό ονομάζεται ηλεκτροσυγγένεια
Γενικά τα αμέταλλα έχουν γενικά μεγάλη ηλεκτροσυγγένεια (διάθεση να προσλάβουν ηλεκτρόνια) και χαρακτηρίζονται σαν ηλεκτροαρνητικά στοιχεία
Η τάση να δέχονται τα στοιχεία ηλεκτρόνεια ονομάζεται ηλεκτραρνητικότητα.
Είναι ένας αριθμός χωρίς διαστάσεις
άλλα στοιχεία έχουν μεγαλύτερη και άλλα μικρότερη ηλεκτραρνητικότητα. Π.Χ. Το Νάτριο έχει 0,9 ενώ το χλώριο έχει 3
Κίνηση λοιπόν των ηλεκτρονίων σθένους ατόμου μπορεί να συμβεί και κατά την «μετακόμισή « του σε άλλο άτομο. Αυτό συμβαίνει γιατί,
τα άτομα τείνουν να γίνονται όσο το δυνατόν σταθερότερα, δηλαδή να ισορροπήσουν τις ηλεκτρονιακές ροπές στην εξωτερική τους στοιβάδα ηλεκτρονίων, τόσο καλά όπως είναι τα ευγενή αέρια. για την ισορροπία αυτή που συνεπάγει σταθερότητα,
Ισχύει ο κανόνας των δύο ηλεκτρονίων για την πρώτη περίοδο του περιοδικού πίνακα , των οκτώ για την δεύτερη και Τρίτη περίοδο και των 18 για σύμπλοκες και οργανομεταλλικές ενώσεις ώστε τα άτομα να αποκτήσουν δομή των σταθερών ατόμων των ευγενών αερίων.
, Κατά την πρόσληψη ηλεκτρονίου, παρατηρείται όπως είναι φυσικό μεταβολή στην ενέργεια ενός στοιχείου.
Αντιστοιχεί επίσης σε μεταβολή της Ενθαλπίας ΔΗ
Ποια είναι η σημασία της ηλεκτραρνητικότητας στην κίνηση ηλεκτρονίων σθένους με στοχο την μεγαλύτερη σταθερότητα των ατόμων μέσω της δημιουργίας χημικών δεσμών
Αν δυο στοιχεία βρεθούν σε κατάλληλες συνθήκες και υπάρχει διαφορά ηλεκτραρνητικότητας είναι πιθανόν αυτό με την μικρότερη ηλεκτραρνητικότητα να απομακρύνει ή να αποβάλλει ηλεκτρόνια τα οποία θα προσλάβει το άλλο με την μεγαλύτερη σχετικά ηλεκτραρνητικότητα
Αν δυο άτομα ιδιας ηλεκτραρνητικότητας συνδεθούν με ομοιοπολικό δεσμό έχουμε ομοιοπολικό μη πολικό όπως Η-Η > Η2
Αν δυο άτομα διαφορετικής ηλεκτραρνητικότητας συνδεθούν με ομοιοπολικό δεσμό έχουμε ομοιοπολικό πολικό
Όσο μεγαλύτερη η διαφορά ηλεκτραρνητικότητα τόσο πολικότερος είναι ο ομοιοπολικός δεσμός
Na(s) + Cl (g) --> Η+δCl-δ ( +δ και -δ δείχνει την πυκνότητα φορτίου σε κάθε άτομο)
Σε πολύ μεγάλη διαφορά στην ηλεκτραρνητικότητα έχουμε πλήρη απομάκρυνση του ηλεκτρονίου και σχηματισμό ιόντων και ιοντικού δεσμού
Na(s) + Cl (g) --> Na+ + Cl- Ηλεκτραρνητικότητα Νατρίου είναι 0,9 και χλωρίου είναι 3,0
Ιοντικός δεσμός
Αυτό συμβαίνει συνήθως αν υπάρχει μεγάλη διαφορά στην ενέργεια ιοντισμού (ηλεκτροθετικότητα) Παράδειγμα το Νάτριο Να με Ενέργεια ιοντισμού Ε=496kj/mol και το χλώριο με ενέργεια ιοντισμού Ε=-349kj/mol έχουν μεγάλη διαφορά στην ηλεκτροθετικότητά τους
To νάτριο παραχωρεί ένα ηλεκτρόνιο στο χλώριο και μετατρέπονται σε ιόντα Νa+ , Cl-
Ο σχηματισμός ιόντων απαιτεί πρόσθετη ενέργεια Ε= 496-349 = 147kj/mol
Τα δυο ιόντα συνδέονται τώρα με ιοντικό δεσμό, που είναι η έλξη που αναπτύσσεται μεταξύ τους λόγω των αντιθέτων φορτίων τους.
Σημείωση: Οι ενώσεις του άνθρακα (με 4 ηλεκτρόνια στην στοιβάδα σθένους του) στις οργανικές ουσίες που περιέχουν σε μεγάλο βαθμό συνδέσεις C-C , C-H και άλλους αντίστοιχους δεν σχηματίζουν ιοντικούς δεσμούς αφού δεν επιτυγχάνεται αυτή η μεγάλη διαφορά ηλεκτροθετικότητας . Ο Ανθρακας εμφανίζει την μικρότερη ηλεκτροθετικότητα από τα κατιόντα.
Αλλά εμφανίζει και την μικρότερη ηλεκτραρνητικότητα από τα αμέταλλα.
Ομοιοπολικός δεσμός
Ωστόσο σε πολλές περιπτώσεις το ηλεκτρόνιο δεν μεταφέρεται πλήρως αλλά μεταφέρει ένα κλάσμα μόνο του ηλεκτρονιακού του φορτίου και προκύπτει συντονισμός του ηλεκτρονίου του δότη και του δέκτη. Τα άτομα συνδυάζονται ώστε να πετύχουν την σταθερότερη ηλεκτρονιακή δομή. Αυτή προκύπτει με την συμπλήρωση της στοιβάδας σθένους με δύο αν πρόκειται για την 1η με οκτώ για την δεύτερη και Τρίτη και με δέκα οκτώ για συμπλοκα
Αυτό οδηγεί πολλές φορές στον σχηματισμό δεσμού μεταξύ του δότη και του δέκτη με ζευγάρια ηλεκτρονίων τα οποία διαμοιράζονται μεταξύ των ατόμων . Τα άτομα που συμμετέχουν, διατηρούν σε μεγάλο βαθμό την χημική τους ταυτότητα
Μπορούμε να μελετήσουμε την δημιουργία ομοιοπολικού δεσμού βάσει της ηλεκτροσυγγένειας (ηλεκτραρνητικότητα) δηλαδή της τάσης των ατόμων να έλκουν ηλεκτρόνια για την συμπλήρωση της εξωτερικής τους στοιβάδας
Αν η διαφορά στις ηλεκτραρνητικότητες των ατόμων που σχηματίζουν ομοιοπολικό δεσμό είναι μεγάλη, το ζεύγος ηλεκτρονίων που διαμοιράζονται έλκεται από το αρνητικότερο άτομο και ο δεσμός εμφανίζει πολικότητα. Πολικός ομοιοπολικός δεσμός
Εάν όχι όπως δεσμοί ομοίων ατόμων έχουμε ομοιοπολικό μη πολικό δεσμό.
Η έννοια της οξείδωσης και της αναγωγής
Για χημικά στοιχεία
Κατά την απομάκρυνση ηλεκτρονίων από ένα άτομο συμβαίνει οξείδωση του ατόμου αυτού
Κατά την πρόσληψη ή προσέγγιση ηλεκτρονίων σε ένα άτομο συμβαίνει αναγωγή του ατόμου αυτού.
Οξείδωση είναι η αποβολή ηλεκτρονίων από το άτομο ενώ αναγωγή είναι η πρόσληψη ηλεκτρονίων από το άτομο
Για ιοντικό δεσμό
Συνήθως όταν από ένα άτομο απομακρύνονται ηλεκτρόνια αυτά δεν καταλήγουν στο άπειρο , ώστε το φαινόμενο να περιγράφεται με την ενέργεια ιοντισμού, αλλά σε κάποιο άλλο άτομο που τα προσλαμβάνει, Επομένως συμβαίνουν ταυτόχρονα οξείδωση για το ένα και αναγωγή για το άλλο άτομο
Αντίστοιχα όταν ένα άτομο προσλαμβάνει ηλεκτρόνια (ηλεκτροσυγγένεια) αυτό συνήθως έρχεται από κάποιο γειτονικό άτομο και όχι από το άπειρο.
Στην δημιουργία ιοντικού δεσμού μεταξύ νατρίου και χλωρίου
Na + Cl --> Na+ + Cl-
Ταυτόχρονα το νάτριο οξειδώνεται και το χλώριο ανάγεται. Είναι αντίδραση οξειδοαναγωγής.
Άλλο παράδειγμα
Zn(s) --> 2e + Zn(aq)2+
Cu(aq)2+ +2e à Cu(s)
Εάν τις συνδέσουμε παίρνουμε μια συνολική αντίδραση οξειδοαναγωγής.
Zn(s) + Cu(aq)2+ --> Cu(s)+ Zn(aq)2+
Σημείωση
Υπάρχουν αντιδράσεις που τα ηλεκτρόνια των στοιχείων δεν μετακινούνται ως προς τα άτομα στα οποία ανήκουν, αλλά μετατίθενται ολόκληρα άτομα ή ομάδες ατόμων. Είναι οι μεταθετικές αντιδράσεις.
Για ομοιοπολικό δεσμό
Επίσης σε ομοιπολικούς δεσμούς υπάρχει οξείδωση και αναγωγή μόνο σε πολικούς ομοιοπολικούς που θεωρείται μετακίνηση φορτίου προς το ηλεκτραρνητικότερο μέρος.
Εδώ υπολογίζουμε την μικρή περίσσεια ηλεκτρονού φορτίου ή το μικρό έλλειμα λόγω της πολικότητας του ομοιοπολικού δεσμού
H2 +Cl2 --> 2HCl
Στο HCl το υδρογόνο έχει αποκτήσει ένα μικρό έλλειμμα ηλεκτρονιακής πυκνότητας (+δ) ενώ το Cl μια μικρή περίσσεια ηλεκτρονιακού φορτίου (-δ)
Οξειδοαναγωγικό ζεύγος
Σε μια αντίδραση οξείδωσης και αναγωγής το ζεύγος της οξειδωμένης και ανηγμένης μορφής στοιχείου ονομάζεται οξειδοαναγωγικό ζεύγος
Zn (s) à Zn2+ (aq) + 2e το οξειδοαναγωγικό ζεύγος είναι Zn+2/Zn
Ag+ (aq) +eàAg(s) το οξειδοαναγωγικό ζεύγος είναι Ag+/Ag
Εφόσον τα ιοντικά δυναμικά των ατόμων και των ιόντων τους δεν είναι ίδια (
Ας σημειώσουμε πως όσο μεγαλώνει η ατομκή ακτίνα του ουδέτερου ατόμου τόσο μικραίνει η διαφορά μεταξύ ατομικής ακτίνας του ουδέτερου και του φορτισμένου ατόμου
Τα κατιόντα έχουν μικρότερη ακτίνα από τα ουδέτρα άτομα
Τα ανιόντα έχουν μεγαλύτερη ατομική ακτίνα από το ουδέτερο άτομο
. Μεταξύ κάθε ημιαντίδρασης των οξειδοαναγωγικών ζευγών Zn+2/Zn και Ag+/Ag
αναπτύσεται Διαφορά Δυναμικού που είναι ανάλογο της πορείας της ημιαντίδρασης και των παραγόμενων ιόντων και δεν είναι δυνατόν να μετρηθεί το δυναμικό αυτό.
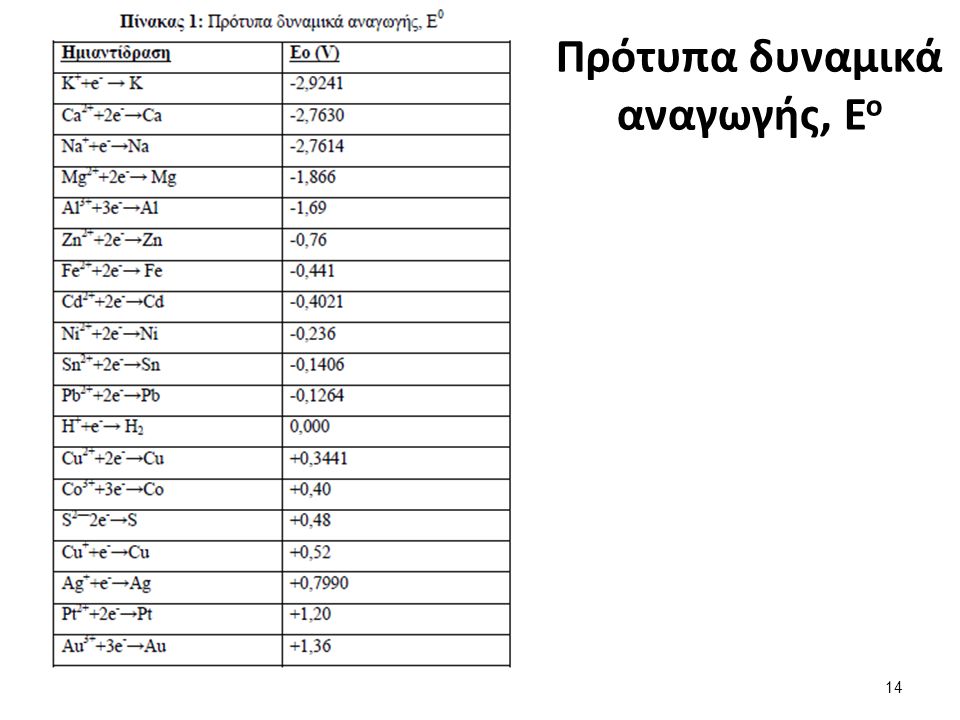 Έτσι σε ανάλογες διατάξεις αφού σταθεροποιήσουμε τα δυναμικά αυτά τα μετράμε σε σύγκριση με το δυναμικό της ημιαντίδρασης Η/Η+ και το ονομάζουμε Πρότυπα Δυναμικά
Έτσι σε ανάλογες διατάξεις αφού σταθεροποιήσουμε τα δυναμικά αυτά τα μετράμε σε σύγκριση με το δυναμικό της ημιαντίδρασης Η/Η+ και το ονομάζουμε Πρότυπα Δυναμικά
Σημείωση Το οξειδοαναγωγικό δυναμικό επιρεάζεται από μεταβολές στις συγκεντρώσεις των αντιδρώντων σωμάτων Επίσης, διαφορέτικές τιμές ΡΗ προκαλούν μεγάλες μεταβολές στα οξειδοαναγωγικά δυναμικά παρουσία υδρογόνου ή ιόντων υδροξυλίου
Η ισχύς ενός συστήματος να δωρίσουν ή να δεχθούν ηλεκτρόνια δεν είναι πάντα ίδια.
Το μέτρο αυτής της ισχύος εκφράζεται σε κάθε περίπτωσηαπό τοΔυναμικό οξειδοαναγωγής ενός συστήματος :
Ένα σύστημα που παρέχει αυθόρμητα ηλεκτρόνια σε κάποιο άλλο λειτουργεί σαν αναγωγικό και έχει ένα πιο αρνητικό δυναμικό οξειδοαναγωγής από το δεύτερο που τα δέχεται
Το σύστημα αποδοχής των ηλεκτρονίων είναι αυτό που πετυχαίνει το πιο θετικό οξειδοαναγωγικό δυναμικό
Mn(OH)2 + OH ⎯ = Mn(OH)3 + e ―0,40
Fe(OH)2 + OH ⎯ = Fe(OH)3 + e ―0,56
---------------------------------------------------------------------------------------------------
Chem021_Lecture_04
